阿莫西林是一种最常用的 β-内酰胺抗生素,作为基本医疗系统中最重要药物之一被世界卫生组织基本药物标准清单收录。 其杂质L,即:(2 S,5 R,6 R) -6 -((2 S,5 R,6 R) -6 -(( R)-2-氨基-2-(4-羟基苯基)乙酰氨基)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酰胺)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸(6-APA amoxicillin amide),由于含量少难以获取成为影响产品质量的因素之一,因此,我们以6-氨基青霉素烷酸和阿莫西林三水合物为原料,分别通过3步和1步转化为相应的中间体化合物3和6,并使用酰胺缩合试剂六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBOP)以76%的收率实现了化合物3和6的脱水缩合,得到的关键中间体化合物7在Pd/C催化条件下一步脱除苄基及两个苄氧羰基保护基,首次通过化学方法合成了 β-内酰胺化合物阿莫西林杂质L,反应使用简单易得的原料,温和的反应条件,无需复杂的分离纯化处理,对以阿莫西林为代表的 β-内酰胺类抗生素的过敏研究以及新型 β-内酰胺抗生素的开发和作用机制研究等有着参考和借鉴意义。
Amoxicillin is a β-lactam antibiotic used for the treatment of a number of bacterial infections. It is on the World Health Organization's List of Essential Medicines, and one of the most important medications needed in a basic health system. The insufficient sources of its impurity L, i.e., (2 S,5 R,6 R) -6 -((2 S,5 R,6 R) -6 -(( R)-2-amino-2-(4-hydroxyphenyl)acetamido)-3,3-dime-thyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxamido)-3,3-dimethyl-7-oxo-4-thia-1-azabicy-clo[3.2.0]heptane-2-carboxylic acid(6-APA amoxicilin amide), affect the quality control of the product. Herein, the first synthesis of amoxicillin impurity L, was reported by using a simple and efficient method. The starting materials of 6-aminopenicilanic acid and amoxycillin trihydrate were converted to intermediate compounds 3 and 6 through three-step and one-step reactions, respectively. By using benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate(PyBOP) as peptide coupling reagent, we successfully synthesized key intermediate 7 from compounds 3 and 6 in 76% yield, which was subsequently transformed to 6-APA amoxicillin amide by fully deprotection of benzyl and two carbobenzyloxy(Cbz) protecting groups. This method not only increases the source of the standard substance for quality control of amoxicillin, but also provides inspiration for novel β-lactam antibiotic and antiallergic research.
β-内酰胺类抗生素由于其高效、低毒而在临床上应用十分广泛,但其过敏反应也居各类药物之首[1,2]。 其中,引发 β-内酰胺类抗生素速发型过敏反应的过敏原并不是 β-内酰胺类抗生素本身,而是其中存在的大分子杂质[3,4,5,6]。 抗生素药物中的大分子杂质按其来源通常分为外源性杂质和内源性杂质:外源性杂质包括蛋白、多肽、多糖等,也包括抗生素和蛋白、多肽、多糖等的结合物,外源性杂质一般来源于发酵工艺;内源性杂质指抗生素药物自身的聚合产物,聚合物可来自生产过程,又可在储存中形成,甚至在用药时也可由使用不当产生[7,8]。
阿莫西林杂质L,即:(2 S,5 R,6 R) -6 -((2 S,5 R,6 R) -6 -(( R)-2-氨基-2-(4-羟基苯基)乙酰氨基)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环庚烷-2-甲酰胺)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸(6-APA amoxicillin amide),是欧洲药典8.0版中公开的最新杂质,是在酶法制备阿莫西林的工艺中产生的导致过敏的杂质之一[2,9]。 现有的阿莫西林杂质L是采用色谱技术从阿莫西林药物中分离得到的,由于其含量极少,致使其分离效率低下,很难得到足够的产品进行后续的研究[10],因此,通过化学合成方法由商品化原料出发,完成阿莫西林杂质L的合成和优化变得尤为重要。
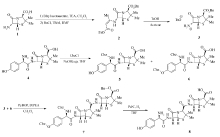
本文以阿莫西林三水合物和6-氨基青霉素烷酸为原料,首次报道了阿莫西林杂质L的化学合成(如Scheme 1所示)。 通过分别对阿莫西林三水合物的氨基和酚羟基以及6-氨基青霉素烷酸的羧基进行保护,再筛选适当的酰胺缩合试剂完成了两片段的脱水缩合,最后通过保护基脱除完成了阿莫西林杂质L的合成。 为阿莫西林抗过敏研究、商品化 β-内酰胺类抗生素的生产工艺和质量研究以及新型 β-内酰胺类抗生素的开发等提供了参考和依据。
Bruker 300MHz,500MHz型核磁共振仪(瑞士Bruker公司);Bruker MicrOTOF-Q2型高分辨质谱仪(瑞士Bruker公司)。
阿莫西林三水合物和6-氨基青霉素烷酸(TCI)上海化成工业发展有限公司),六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBOP)及Pd/C(Sigma-Aldrich)。 其它试剂由安乃吉化学采购,均为市售分析纯,直接使用无需进一步处理,所用溶剂为市售分析纯用孔径为0.4 nm分子筛干燥处理24 h。
1.2.1 (2 S,5 R,6 R) -苄基6 -((( Z)丁烯酸乙酯-2-基)氨基)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸酯(2)的合成 在100 mL圆底烧瓶中,加入原料6-氨基青霉素烷酸2.16 g(10 mmol)和20 mL CH2Cl2,冰水浴冷却至0 ℃滴加三乙胺2.02 g(20 mmol),搅拌至原料完全溶解,向其中滴加1.30 g(10 mmol)乙酰乙酸乙酯,室温反应并用薄层液相色谱(TLC)监测,反应完毕后减压蒸馏除去溶剂,将得到的油状物溶于25 mL干燥的DMF中,向其中加入四丁基碘化铵(TBAI)37 mg(0.1 mmol),再滴加1.39 g(11 mmol)苄氯并室温搅拌3 h,得到的混合物用40 mL水稀释,并用(40 mL×4)乙醚萃取,合并有机相并水洗,饱和食盐水洗并无水硫酸镁干燥,过滤得到的有机相减压除去溶剂得到无色粘稠液体(化合物2)2.95 g,产率70%。1H NMR(300 MHz,CDCl3), δ:9.03(d, J=8.9 Hz,1H),7.37(s,5H),5.60(d, J=4.4 Hz,1H),5.19(d, J=1.2 Hz,2H),5.12(dd, J=9.1,4.4 Hz,1H),4.64(s,1H),4.51(s,1H),4.11(q, J=7.1 Hz,2H),2.01(s,3H),1.63(s,4H),1.43(s,3H),1.24(t, J=7.1 Hz,3H);HRMS-ESI计算值C21H26N2O5S[M+H]+:419.1635,实测值:419.1642。
1.2.2 (2 S,5 R,6 R)-2-(苄氧羰基)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-6-氨基对甲苯磺酸盐(3)的合成 将2.95 g(7 mmol)化合物2溶于7 mL干燥的丙酮中,向其中加入1.34 g(7 mmol)对甲苯磺酸一水合物,搅拌析出大量白色沉淀,继续反应10 min后向其中加入30 mL乙醚,抽滤,固体用乙醚洗涤,得白色固体产物2.50 g,产率74%,mp 156~157℃。1H NMR(300 MHz,CD3OD), δ:7.72(d, J=8.2 Hz,2H),7.48~7.31(m,5H),7.25(d, J=8.0 Hz,2H),5.62(d, J=4.3 Hz,1H),5.25(q, J=12.0 Hz,2H),5.03(d, J=4.2 Hz,1H),4.63(s,1H),2.38(s,3H),1.68(s,3H),1.43(s,3H);13C NMR(75 MHz,CD3OD), δ:167.66,167.15,141.98,140.41,135.11,128.67,128.50,128.41,
128.34,125.59,70.12,67.26,65.75,64.35,57.39,30.53,25.94,19.98;HRMS-ESI计算值C15H19N2O3S[M]+:307.1115,实测值:307.1111。
1.2.3 (2 S,5 R,6 R)- 3,3-二甲基-6-[( R)-2-(苄氧羰基氨基)-2-(4-苄氧羰基氧苯基)乙酰胺基]-7-氧带-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸(6)的合成 100 mL圆底烧瓶中,加入3.65 g(10 mmol)阿莫西林三水合物和NaOH水溶液(1.0 mol/L,30 mL)及30mL THF,混合物室温搅拌15 min,冰浴下向其中滴加20 mmol氯甲酸苄酯,TLC监测反应至原料转化完全,加入盐酸(1.0 mol/L)至混合物呈酸性,调节pH值至4~5,加入乙酸乙酯分液,有机层,水洗、饱和氯化钠洗、无水硫酸镁干燥、抽滤、有机相旋干,并经过柱层析分离( V(CH2Cl2): V(MeOH)=20:1)分别得到化合物5( Rf=0.33)和化合物6( Rf=0.19)。 其中化合物5为白色固体,0.88 g,产率14%,mp 162~165 ℃。1H NMR(500 MHz,DMSO-d6), δ:13.34(s,1H),9.38(s,1H),8.86(d, J=7.9 Hz,1H),7.84(d, J=8.5 Hz,1H),7.41~7.28(m,6H),7.22(d, J=8.5 Hz,2H),6.68(d, J=8.4 Hz,2H),5.52(dd, J=7.7,3.9 Hz,1H),5.40(d, J=4.0 Hz,1H),5.34(d, J=8.5 Hz,1H),5.07~4.99(m,2H),4.19(s,1H),1.55(s,3H),1.42(s,3H);13C NMR(75 MHz,CD3OD), δ:173.28,171.86,169.78,157.33,156.61,136.65,128.90,128.66,
128.11,127.66,127.56,115.05,70.54,67.33,66.42,63.70,58.39,58.08,57.91,29.71,25.95;HRMS-ESI计算值C24H25N3O7S[M-H]-:498.1340,实测值:498.1332。 化合物6为白色固体,4.81 g,产率76%,mp 97~99 ℃。1H NMR(500 MHz,DMSO-d6),δ: 9.07(d, J=7.5 Hz,1H),8.08(d, J=8.5 Hz,1H),7.51(d, J=8.5 Hz,2H),7.48~7.34(m,9H),7.32(dd, J=8.3,4.1 Hz,1H),7.21(d, J=8.5 Hz,2H),5.76(s,1H),5.53(d, J=8.6 Hz,1H),5.49(dd, J=7.2,4.0 Hz,1H),5.39(d, J=3.9 Hz,1H),5.27(s,2H),5.14~5.00(m,2H),4.20(s,1H),1.52(s,3H),1.40(s,3H);13C NMR(75 MHz,CD3OD), δ:172.88,170.90,169.63,156.54,153.57,151.16,136.58,135.18,128.64,128.36,
128.34,128.16,127.73,127.63,121.11,70.41,70.03,67.41,66.56,63.71,58.74,57.76,30.04,25.84;HRMS-ESI计算值C32H31N3O9S[M-H]-:632.1708,实测值:632.1702。
1.2.4 (2 S,5 R,6 R) -苄基 6 -((2 S,5 R,6 R) -6 -(( R)-2-(苄氧羰基氨基)-2-(4-(苄氧羰基氧苯基)乙酰氨基)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酰胺)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸酯(7)的合成 将633 mg(1 mmol)化合物6溶于3 mL二氯甲烷中,加入0.37 mL(2 mmo) N'N-二异丙基乙基胺,冰浴下加入624 mg(1.2 mmol)PyBOP,搅拌2 min,得到混合溶液Ⅰ;将480 mg(1 mmol)化合物3溶于3 mL二氯甲烷中,加入0.37(2 mmol) mL N'N-二异丙基乙基胺,搅拌2 min,得到混合溶液Ⅱ;将混合溶液Ⅱ加入上述混合溶液Ⅰ中,搅拌监测,原料反应完毕后加入10 mL水及10 mL二氯甲烷,分离有机层并水洗,无水硫酸镁干燥,减压除去溶剂,得到的残余物柱层析( V(CH2Cl2): V(MeOH)=100:1)得到白色固体(化合物7, Rf=0.54)703 mg,产率76%,mp 102~105 ℃。1H NMR(500 MHz,DMSO-d6), δ:9.04(dd, J=14.6,7.4 Hz,2H),8.09(d, J=8.6 Hz,1H),7.51(d, J=8.6 Hz,3H),7.48~7.40(m,9H),7.37(q, J=7.4 Hz,6H),7.34~7.29(m,1H),7.21(d, J=8.6 Hz,2H),5.63~5.57(m,1H),5.54(dd, J=11.3,6.5 Hz,2H),5.47~5.43(m,1H),5.40(d, J=3.9 Hz,1H),5.26(s,2H),5.21(q, J=12.2 Hz,2H),5.06(q, J=12.6 Hz,2H),4.54(s,1H),4.48~4.42(m,1H),1.59(s,3H),1.46(s,3H),1.36(s,3H),1.31(s,3H);13C NMR(75 MHz,CD3OD), δ:173.66,172.79,170.96,168.12,167.68,153.56,151.20,136.63,135.22,135.05,
128.62,128.59,128.31,128.28,128.10,127.66,127.54,121.06,70.75,
70.35,69.98,67.31,67.10,66.46,64.57,63.85,58.53,58.39,29.97,29.27,25.83;HRMS-ESI计算值C47H48N5O11S2[M+H]+:922.2786,实测值:922.2773。
1.2.5 阿莫西林杂质L(8)的合成 将92.1 mg(0.1 mmol)化合物7溶于1.5 mL四氢呋喃溶液中,加入310 mg Pd/C(Pd质量分数10%),通入氢气(2 MPa)室温反应2 h,反应完毕后过滤除去Pd/C,水洗并减压蒸馏除去溶剂得到白色固体(化合物8)48 mg,产率86%,mp >200 ℃。1H NMR(300 MHz,D2O), δ:7.23(d, J=8.5 Hz,2H),6.84(d, J=8.5 Hz,3H),5.42(ddd, J=10.7,6.8,3.8 Hz,4H),5.02(s,1H),4.28(s,1H),4.12(s,1H),1.49(s,3H),1.37(s,3H),1.27(s,6H);HRMS-ESI计算值C24H29N5O7S2[M-H]-:562.1436,实测值:562.1425。
通过对于阿莫西林杂质L(化合物8)结构分析,可以看到其整体结构来源于发酵过程中阿莫西林与6-氨基青霉素烷酸的酰胺缩合,然而,此两个片段都分别含有氨基和羧基,因此,为了高选择性地合成化合物8,需要分别将阿莫西林中的氨基(或者氨基和酚羟基)以及6-氨基青霉素烷酸中的羧基进行保护,再进行酰胺缩合,最后通过去除保护基完成化合物8的合成。
如Scheme 1所示,化合物3的合成以6-氨基青霉素烷酸为原料,使用乙酰乙酸乙酯与其反应生成亚胺并异构化为烯胺对6-氨基青霉素烷酸的氨基进行保护,再使用苄氯在TBAI催化下对其羧基进行保护得到羧酸苄酯,最后在对甲苯磺酸的作用下水解氨基保护基得到6-氨基青霉素烷酸苄酯对甲苯磺酸盐化合物3。 该方法虽然通过3步反应实现对羧酸的保护,但是相对于已有的一步保护的路线[11],其反应转化率及产率均比较高,反应产物单一不需要进行柱层析进行分离,最后所得到的产品经乙醚洗涤可以直接用于下一步的反应之中。
为了后续的去保护能在Pd/C氢气的条件下一步完成,化合物4的保护基筛选为苄氧羰基保护基,将化合物4与氯甲酸苄酯在NaOH水溶液中反应,通过控制氯甲酸苄酯的量以及反应时间可以选择性的合成得到氨基保护的产物化合物5或者氨基与酚羟基双保护的化合物6,在下一步与化合物3的缩合反应中,未使用化合物5作为原料是因为在该条件下主要得到化合物5自身分子间酯缩合的产物。
在筛选化合物3和化合物6的酰胺缩合反应条件的过程中,我们筛选了一些列的酰胺缩合试剂或者羧酸活化试剂(表1)。 我们发现,使用常见的缩合试剂如二环己基碳二亚胺(DCC,entry 1,表1)、1-(3-二甲氨基丙基)-3-乙基-碳二亚胺盐酸盐(EDCI,entry 2)或者将化合物6活化为其混合酸酐(entry 3)以及活化为丁二酰亚胺酯(entry 4)均不能得到化合物7。 进一步的条件筛选中, O-苯并三氮唑-四甲基脲六氟磷酸酯(HBTU,entry 5)作为缩合试剂能够实现化合物3和6的酰胺缩合反应,并以5%的产率合成得到化合物7。 1 H-苯并三唑-1-基氧三吡咯烷基六氟磷酸盐(ByBOP)能够以76%的产率得到目标化合物7。 化合物7在四氢呋喃做溶剂的的条件下,使用Pd/C氢气条件去除分子中3个保护基,得到产物化合物8。 其中 n(Pd)/ n(C)=3,以保证保护基在此条件下完全脱除。
| 表1 化合物7的合成条件筛选 a Table 1 Optimization of synthetic conditions of compound 7 a |
以阿莫西林三水合物和6-氨基青霉素烷酸为原料,通过适当的保护基筛选、酰胺缩合反应条件的优化以及保护基脱除策略,首次报道了阿莫西林杂质L的化学合成。 反应使用简单易得的原料,温和的反应条件,无需复杂的分离纯化处理,易于放大合成。 阿莫西林杂质L的合成对以阿莫西林为代表的 β-内酰胺类抗生素的过敏研究以及新型 β-内酰胺抗生素的开发和作用机制研究等有着参考和借鉴意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|