报道了一种以KF/Al2O3催化合成4-甲基-4-氮杂-21 E-苯亚甲基-5-孕烯-3,20-二酮类化合物的方法。 以黄体酮为原料,经NaIO4/KMnO4氧化裂解、胺解关环得到重要中间体4-甲基-4-氮杂-5-孕烯-3,20-二酮,后者在KF/Al2O3催化下经克莱森缩合得到目标产物。 考察了不同的催化剂、反应温度、催化剂用量对目标产物的影响。 条件优化的结果为: n(3)∶ n(KF/Al2O3)=1∶1,回流状态下反应4 h,产率为56%~68%。 此方法适用性好,为4-氮杂甾体苯亚甲基衍生物的合成提供了一种方便而有效的方法。
The method of synthesis of 4-methyl-4-aza-21 E-benzylidene-5-pregnene-3,20-dione catalyzed by KF/Al2O3 was reported. 4-Methyl-4-aza-5-pregnene-3,20-dione, as a key intermediate, was synthesized by cleavage of A-ring and ring-closure from progesterone and which was then converted to the target product through Claisen condensation catalyzed by KF/Al2O3. The effects of different catalysts, reaction temperature and catalyst dosage were investigated. 56%~68% yields are obtained under optimal conditions: n(3)∶ n(KF/Al2O3)=1∶1, reaction time 4 h under reflux. This study provides a simple and efficient approach to the synthesis of 4-aza-steroidal benzylidene derivatives.
甾体化合物及其衍生物广泛存在于自然界,与许多生命过程密切相关[1]。 甾体是一种维持生命、保持正常生活、促进性器官发育、维持生殖的重要生物活性物质,不仅能治疗乳腺癌[2]、前列腺增生等疾病[3],而且也是计划生育及产生免疫抑制等方面不可缺少的药物[4]。 苯亚甲基类化合物是一类具有多种生理活性的物质且是多种有机合成的底物,同时这类化合物可应用于治疗抗利什曼虫、抗炎、抗疟疾、抗真菌、抗艾滋病等[5,6,7,8,9]。 利用药物设计中的拼合原理,将两大药效基团拼合得到的甾体苯亚甲基物质可以作为脱氢酶抑制剂、抗菌药物和抗肿瘤药物[10,11,12]。
之前对于氮杂类甾体苯亚甲基类化合物研究很少[13],本文设计合成了以黄体酮为原料,经过多步反应合成了目标化合物。 在甾体分子中引入苯亚甲基这一反应中,多以甾体酮和芳醛在NaOH(KOH)作用下[14,15],通过Claisen-Schmidt 缩合反应得到,但该方法反应时间比较长,使用强碱后处理较麻烦。 KF/A12O3作为一种温和的固体催化剂,在有机合成上有着广泛的应用[16]。 利用此方法该反应后处理简单且产率较高,为苯亚甲基甾体衍生物的合成提供了一种方便而有效的方法。
X4型数字显微熔点测定仪,温度计未较正(北京福凯科技发展有限公司);AV400型核磁共振仪(美国Bruker公司);BIO-RAD-FTS-3000型傅里叶红外光谱仪(美国BIO-RAD公司);VGZAB-HS型质谱仪(英国VG公司)。
除黄体酮为工业品外,其它试剂均为市售分析纯。 催化剂KF/Al2O3参考文献[17]制备。
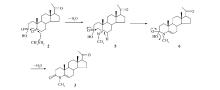
将黄体酮(15 g,47.8 mmol)和叔丁醇(450 mL)加入四口瓶中,搅拌下加入溶于水(20 mL)和无水Na2CO3(6.1 g,57.6 mmol)的溶液,升温至回流,缓慢滴加高碘酸钠(61.4 g,286.8 mmol)和高锰酸钾(0.45 g,2.9 mmol)溶于热水300 mL形成的溶液,滴加完毕后回流4 h左右,停止反应,稍微冷却,过滤,用水洗涤滤饼(10 mL×3)。 蒸去绝大部分叔丁醇,加入水(150 mL),HCL调节pH=2.0,二氯甲烷萃取(100 mL×3),水洗 (100 mL×3)。 无水硫酸镁干燥,过滤,浓缩得到14.11 g淡黄色固体2,产率88.7%。 产物无需精制,直接进行下一步反应。 ESI-MS( m/z):333.5(M-H)- 。
将化合物2(10 g,29.8 mmol)、乙二醇50 mL和甲胺醇40 mL加入四口瓶中,室温下搅拌一夜。 加热回流18 h后反应完全,冷却至室温,加入冷水100 mL搅拌1 h,烯盐酸调pH值为2.0左右,加入二氯甲烷50 mL溶解,再用二氯甲烷(100 mL×3)萃取,水洗(100 mL×3),无水硫酸镁干燥,过滤,旋干得粗品。 柱色谱分离( V(石油醚)∶ V(乙酸乙酯)=3∶1)得到纯品6.80 g,产率是69%。
1H NMR(500 MHz,CDCl3), δ:0.66(s,3H,18-CH3),1.05(s,3H,19-CH3),2.13(s,3H,21-CH3),3.12(s,3H,4N-CH3),5.04(m,1H,6-H);ESI-MS( m/z):330.3(M+H)+;C21H31NO2元素分析计算值(实测值)/%:C 76.55(76.89),H 9.48(9.31),N 4.25(2.49)。
将化合物3(0.5 g,1.50 mmol),无水乙醇15 mL,催化剂KF/Al2O3(0.24 g,1.50 mmol)和芳香醛(1.65 mmol)加入三口瓶中,加热回流4 h,冷至室温过滤,浓缩得粗品,柱色谱分离(洗脱剂: V(石油醚)∶ V(乙酸乙酯)=5∶1)得产品。
4-甲基-4-氮杂-21 E-对溴苯亚甲基-5-孕烯-3,20-二酮(4a):产率58%;1H NMR(500 MHz,CDCl3), δ:0.67(s,3H,18-CH3),1.04(s,3H,19-CH3),3.12(s,3H,4N-CH3),5.04(m,1H,6-H),6.75(d,1H, J=16.0 Hz,21H),7.42(d,2H, J=9.0 Hz,Ph—H),7.47(d,1H, J=16.0 Hz,22H),7.53(d,2H, J=8.0 Hz,Ph—H);13C NMR(125 MHz,CDCl3), δ:200.08,168.68,144.16,140.38,133.71,132.24,129.74,127.12,124.66,104.73,62.09,56.90,48.81,45.07,38.89,35.41,31.76,31.34,31.13,30.65,28.90,24.62,22.83,21.02,18.89,13.58;ESI-MS( m/z):496.4(M+H)+;C28H34BrNO2元素分析计算值(实测值)/%:C 67.74(67.89),H 6.90(7.11),N 2.82(2.89)。
4-甲基-4-氮杂-21 E-对甲基苯亚甲基-5-孕烯-3,20-二酮(4b):产率68%;1H NMR(500 MHz,CDCl3), δ:0.64(s,3H,18-CH3),1.07(s,3H,19-CH3),2.38(s,3H,CH3—Ph),3.18(s,3H,4N—CH3),5.08(m,1H,6-H),6.72(d,1H, J=16.0 Hz,21H),7.20(d,2H, J=8.0 Hz,Ph—H),7.46(d,2H, J=8.0 Hz,Ph—H),7.54(d,1H, J=16.0 Hz,22H);13C NMR(125 MHz,CDCl3), δ:200.13,170.75,141.09,138.95,136.48,134.77,132.02,129.83,125.75,104.75,61.79,57.21,49.85,44.99,43.69,38.77,33.34,30.36,29.28,24.78,22.74,21.66,21.54,21.46,20.75,13.61;ESI-MS( m/z):432.5(M+H)+;C29H37NO2元素分析计算值(实测值)/%:C 80.70(80.81),H 8.64(8.57),N 3.25(3.21)。
4-甲基-4-氮杂-21 E-苯亚甲基-5-孕烯-3,20-二酮(4c):产率56%;1H NMR(500 MHz,CDCl3), δ:0.64(s,3H,18-CH3),1.09(s,3H,19-CH3),3.11(s,3H,4N—CH3),5.06(m,1H,6-H),6.76(d,1H, J=16.0 Hz,21H),7.26~7.38(m,4H,22H+Ph—H),7.54~7.58(m,2H,Ph—H);13C NMR(125 MHz,CDCl3), δ:200.08,179.12,142.08,135.64,134.76,130.57,129.08,128.68,126.63,104.63,61.83,57.14,49.90,45.00,43.76,38.73,34.49,33.40,30.25,29.82,29.33,24.73,24.29,22.70,21.51,13.61;ESI-MS( m/z):418.3(M+H)+;C28H35NO2元素分析计算值(实测值)/%:C 80.53(80.67),H 8.45(8.55),N 3.35(3.41)。
化合物3(0.5 g,1.50 mmol),无水乙醇15 mL和对溴苯甲醛(0.303 g,1.65 mmol)加入三口瓶中,加入不同催化剂,结果见表1。 由表1可知:当利用KOH催化此反应时,室温下反应24 h,仍有少量原料反应不完全,有副产物的生成且与主产物的极性相近,使分离难度增大产率只有24%;当在回流状态下反应时,产物更杂产率只有20%;选用有机碱CH3ONa和 t-BuOK催化此反应时需绝对无水乙醇,TLC检测发现当催化剂为CH3ONa时不反应, t-BuOK时只有约10%左右反应;自制的催化剂KF/Al2O3催化此反应时回流4 h,薄层液相色谱(TLC)检测反应完全,产率可达58%,故选用KF/Al2O3催化此反应。
| 表1 不同催化剂对化合物4a产率的影响 Table 1 Effect of different catalysts on the yield of compound 4a |
化合物3(0.5 g,1.50 mmol),无水乙醇15 mL和对溴苯甲醛(0.303 g,1.65 mmol)加入三口瓶中,加入不同量的KF/Al2O3,结果见表2。 在 n(Al2O3/KF)/ n(compound 3)=0.4时,反应时间延长12 h仍有部分原料反应不完全,产率只有24%,随着催化剂量的增加,化合物4a的产率也随之增加,当 n(Al2O3/KF)/ n(compound 3)=1时产率可达58%,继续增加催化剂的量产率没有明显变化,故催化剂的量应选择 n(Al2O3/KF)/ n(compound 3)=1为宜。
| 表2 不同KF/Al2O3与化合物3的摩尔比对化合物4a产率的影响 a Table 2 Effect of molar ratio of Al2O3/KF to compound 3 on the yield of compound 4a |
化合物4a的1H NMR可知, δ 0.67、1.04、3.12的单峰分别为18、19、4位氮甲基峰,5.04为5位双键氢,而6.75和7.47 分别是21和22位氢,且裂分为两重峰,偶合常数为16.0 Hz,当烯烃的两个H 处于反式时偶合常数一般为14.0以上,由此可知经过Claisen-Schmidt 缩合反应得到的烯烃为反式烯烃。 7.42和7.53分别是苯环上的氢且裂分为两重峰。 另外,从质谱和元素分析数据可进一步确认其结构。
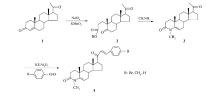
由化合物2在甲胺醇溶液条件下关环合成化合物3的反应机理如Scheme 2所示。 首先在室温下甲胺和化合物2中反应活性更强的5位羰基作用生成中间体亚胺5,之后5位C—H键迁移C═N键电子云进攻3位羰基得过渡态6,氧负离子迁移高温脱水得目标产物3。
以黄体酮为原料,经A环开环,在甲胺的作用下关环引入氮甲基,在KF/Al2O3的催化下取代的苯甲醛与化合物3合成4-甲基-4-氮杂-21 E-取代苯亚甲基-5-孕烯-3,20-二酮,产率56%~68%。 苯环上的取代基不论是吸电子还是供电子基团对产率的影响不大。 此方法后处理简单,产率较好,为4-氮杂甾体类苯亚基衍生物的合成提供了一种方便而有效的方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|