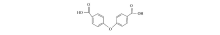
合成了4例二苯羧酸类稀土配合物:[Re2(oba)3(H2O)5]·H2O[Re=La(1)、Ce(2)、Sm(3)、Er(4)](oba=4,4'-二羧基二苯基醚),利用元素分析、红外光谱和粉末X射线衍射等技术手段对其结构及组成进行了表征,热重分析表明,4例配合物具有良好的热稳定性。 采用微量热法,实时跟踪监测4种目标配合物对藤黄微球菌的抑制作用,得到了热谱曲线。 依据热动力学模型对热谱曲线进行解析,计算了生长和抑制过程的热动力学函数,在不同浓度配合物存在时,获得了细菌生长速率常数( k)、最大产热功率( Pmax)、传代时间( tG)以及抑制率(I)等参数。 结果表明,4种配合物对藤黄微球菌均具有抑制作用,抑菌效果依次为:[Er2(oba)3(H2O)5]·H2O(4)>[Sm2(oba)3(H2O)5]·H2O(3)>[Ce2(oba)3(H2O)5]·H2O(2)>[La2(oba)3(H2O)5]·H2O(1)。
Four isostructural rare earth complexes, namely [Re2(oba)3(H2O)5]·H2O[Re=La(1), Ce(2), Sm(3), Er(4), H2oba=4,4'-oxybisbenzoic acid], have been synthesized under solvothermal conditions and characterized by elemental analysis, infrared(IR) spectrometry, and powder X-ray diffraction. Thermogravimetric analysis demonstrates that these complexes possess good thermostability. Micrococcus luteus inhibition by these complexes have been real-time detected by means of microcalorimetry. The growth rate constant k, maximum power Pmax, passage time tG and inhibitive ratio I, respectively, have been obtained. Experimental results indicate that the title complexes present effective inhibition on Micrococcus luteus, and the order is listed as follows:[Er2(oba)3(H2O)5]·H2O(4)>[Sm2(oba)3(H2O)5]·H2O(3)>[Ce2(oba)3(H2O)5]·H2O(2)>[La2(oba)3(H2O)5]·H2O(1).
测定药物生物活性的方法有许多种,其中,跟踪测量生物体系代谢过程热效应的微量热法具有很高的灵敏度,能够准确揭示生物代谢过程的热力学和动力学规律,可用来检测药物的抑菌效果,受到了热化学家和生物学家的广泛关注[1,2]。 相对皿内微生物实验,微量热法具有以下独到之处[3,4,5]:1) 在生物代谢过程的测量中,无需引进任何试剂,对生物体的正常生长代谢无任何影响;2)必要时可以有目的地加入相关物质,以研究该物质的生物活性;3) 量热实验所需样品量少,对研究体系没有破坏,且对后续研究与分析无影响。 近年来,微量热法被广泛应用在抑菌领域,科学家从热动力学角度研究了抑菌剂的生物活性,获得了诸多成果[6,7]。 侯安新、刘义等[8]利用停流法研究铒离子及其阳离子卟啉配合物对金黄色葡萄球菌的代谢作用;包翔宇等[9] 利用微量热法探究了生物材料与大肠杆菌的相互作用。
作为一种革兰阳性球菌,藤黄微球菌( Micrococcus luteus, M.luteus IAM 14879)广泛分布于空气、水、土壤中,也常见于动物与人眼睛、咽部、皮肤等部位,适宜生长温度为25~37 ℃,是人和动物常见的条件致病菌[10,11]。 由于其广谱的存在形式及高度的药物灵敏性,被广泛应用在药敏实验的测试中,是检测抑菌剂药效能力的常用微生物之一。 截至目前,利用微量热法对藤黄微球菌的抑制实验未见报道,在这方面开展系统深入的研究工作很有必要。
稀土及其配合物的特殊生物化学效应、药理作用效果引起了化学家、生物学家、药学家的高度重视,研究结果表明,稀土与生物分子的亲和力强,参与重要的生命过程,对多种酶或酶原具有刺激或抑制作用,具有明显的抗凝血、抗炎杀菌、抗肿瘤的作用[12,13,14];同时,具有抑菌作用的稀土配合物,其配体多数是含有羧基、羟基或磺酸基的芳香族化合物[15]。 2013年,蒋志强等[16]以4,4'-二羧基二苯基醚(H2oba)为配体合成了一例稀土配合物[Tm2oba3(H2O)5]·H2O,对其结构进行了分析;罗芸等[17]合成了系列稀土配合物[Ln2(oba)3(H2O)5]·H2O,对其荧光特性进行了探究,研究结果值得关注。 综合文献分析,以配位能力很强的二羧酸衍生物—4,4'-二羧基二苯基醚(Scheme 1)为配体合成具有抑菌效果的稀土配合物具有以下优势:1)其结构中含有两个抑菌活性较强的羧酸基团,具有丰富的配位模式,易于形成结构稳定的高维配位聚合物;2)独特的结构特点使得羧基周围具有较低的空间位阻,提供了与金属离子配位的可能;3)其稳定的共轭体系有助于获得具有刚性结构的金属-有机骨架化合物。 然而,此前报道的系列H2oba类稀土配合物的生物活性并未受到足够的重视,因此,对其抑菌性能进行深入系统地研究亟待开展。
基于以上考虑,本文采用水热法合成了系列稀土配合物:[Re2(oba)3(H2O)5]·H2O(Re=La、Ce、Sm、Er),并对其结构和理化性质进行了表征。 采用热导式微量量热仪测定了4例配合物与藤黄微球菌作用的生长热谱曲线,通过热动力学模型对热谱曲线进行解析,得到了藤黄微球菌生长代谢的速率常数和传代时间等热动力学参数,研究了目标配合物对藤黄微球菌的抑制效果,探讨了配合物的抑菌机理。
Re(NO3)3· nH2O、H2oba、DMF(二甲基甲酰胺)等试剂均为市售分析纯。 藤黄微球菌( Micrococcus luteus, M.luteus IAM 14879)由宁夏大学微生物实验室提供。 藤黄微球菌培养基:酵母膏0.5 g,蛋白胨0.8 g,Na2HPO4 0.53 g,NaCl 0.50 g,葡萄糖0.50 g(分装),蒸馏水100 mL,0.01 mol/L磷酸盐缓冲溶液(1 L)。 Vario EL III型元素分析仪(德国Elementar公司);雷磁DDS-11C型电导率仪(上海精密科学仪器有限公司);EQINOX-55型红外光谱仪(德国Bruker公司);Smart-APEXH CCD型粉末X射线衍射仪(德国Bruker公司);SETSYS-1750CSEvol型热重分析仪(法国赛特拉公司);RD-496型微量量热仪(中国工程物理研究院绵阳中物热分析仪器有限公司)。
通过改进文献[16-17]方法,4种配合物的合成步骤如下:按摩尔比1:2(0.02 mmol)称取H2oba和Re(NO3)3,装入15 mL聚四氟乙烯内衬中,加入2 mL DMF和5 mL蒸馏水,室温搅拌20 min,加入反应釜中。 于140 ℃恒温96 h,降温至100 ℃后保温11 h,然后以6 ℃/h的速率降至室温。 产物经蒸馏水和DMF的混合溶液洗涤、干燥,得到配合物,其元素分析和摩尔电导率 Λm如下: [La2(oba)3(H2O)5]·H2O(1):实验值(计算值)/%:C 43.51(43.47),H 3.15(3.12)。 Λm(S·cm2·mol-1):17.7。 [Ce2(oba)3(H2O)5]·H2O(2):实验值(计算值)/%:C 43.58(43.56),H 3.13(3.11)。 Λm(S·cm2·mol-1):17.3。 [Sm2(oba)3(H2O)5]·H2O(3):实验值(计算值)/%:C 42.86(42.85),H 3.05(3.04)。 Λm(S·cm2·mol-1):17.7。 [Er2(oba)3(H2O)5]·H2O(4):实验值(计算值)/%:C 41.64(41.65),H 2.98(2.97)。 Λm(S·cm2·mol-1):17.4。
利用微量量热仪,系统控温35 ℃下测量细菌的生长代谢曲线。 将8 mL玻璃安瓿瓶洗涤干净、高温灭菌、干燥备用,每个玻璃安瓿瓶中加入4 mL液体培养液及8 μL菌液。 一个安瓿瓶中不加试剂,作为空白实验。 其余安瓿瓶中按要求加入一定量的试剂,摇匀,编号,盖上瓶盖并用专用钳压紧。 将安瓿瓶依次吊入仪器的通道,将量热仪温度调整恒定到35 ℃,待仪器走出一条稳定的基线后进行数据采集,连续记录真菌生长代谢热功率曲线,绘制出细菌生长代谢热谱曲线。 以上各步均为无菌操作。
2.1.1 配合物的晶体结构 参考文献[17],4个配合物具有类似的结构,属于同构物,结构描述仅以配合物[La2(oba)3(H2O)5]·H2O(1)为例。 单晶X射线衍射分析表明,配合物在晶体学上均属于单斜晶系,晶胞参数为 a=23.662(4), b=6.0657(10), c=29.414(6), α=90°, β=102.034(7)°, γ=90°[CCDC号:815115(1);894569(3)]。 配合物具有三维网络结构。 其最小不对称单元包含2个晶体学独立的金属离子、3个去质子化的oba2-配体、5个配位水分子和1个游离水分子(图1 A)。 2个八配位的稀土金属离子均展示了略微扭曲的双帽三棱柱几何构型。 金属离子Re1与8个氧原子配位,其中,6个氧原子来自于6个不同的oba2-配体,2个氧原子来自于2个配位水分子。Re2离子与5个不同的oba2-配体上的5个氧原子以及3个配位水分子的氧原子配位。 2个金属离子Re1和Re2依靠2个羧基基团桥连形成了二聚单元,3个oba2-配体包含6个羧基基团,其中5个羧基展现了双齿桥连的配位模式,另外一个羧基采用单齿模式与金属离子配位。 结晶水分子与配合物分子之间形成了氢键网络。 2个金属离子由oba2-配体上的羧基氧原子桥连生成一维链状结构。 最终,Re1原子形成的链和Re2原子形成的链之间进一步依靠oba配体的桥连作用构筑得到了配合物的三维框架结构(图1 B)。
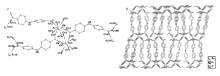 | 图1 配合物的配位环境图( A);配合物的三维框架图( B)Fig1 The coordination environment in complexes( A); View of the three-dimensional architecture of complexes( B) |
2.1.2 配合物的红外光谱分析 根据文献[18]对配体与配合物的红外光谱(辅助材料图S1和S2)进行指派。 配合物1~4的红外光谱图在3045 cm-1处均有一个小峰,对应于苯环中C—H的伸缩振动峰;2000~1700 cm-1处出现的一系列小峰为苯环的泛频区; 1550~1450 cm-1之间的一系列强吸收峰可视为苯环的骨架振动引起的;1275~1000 cm-1和900~650 cm-1之间的强吸收峰分别归为苯环中C—H的面内吸收峰和面外吸收峰。 苯环上的羧酸在1700 cm-1处强而宽的特征吸收峰在配合物种红移到1667~1659 cm-1处,与理论值1660与1668 cm-1基本一致;这表明稀土金属离子与羧基中的氧原子具有稳定的红外振动。 OCO—的对称伸缩振动峰由1434~1420 cm-1红移到1413~1405 cm-1处,表明苯环上的羧酸均与稀土离子进行配位[19]。 此外,4种配合物在3400~3500 cm-1处均存在H2O中O—H键的特征吸收峰,且在523 cm-1处出现配位水的振动峰, ρr(HOH)(600~500 cm-1),表明配合物中同时具有配位水分子和结晶水分子[20]。
2.1.3 粉末X射线衍射表征 4种配合物的粉末X射线衍射(PXRD)图(辅助材料图S3)中主晶相出现的特征峰位置与文献[16,17]报道单晶X射线衍射结果的理论拟合衍射峰位置一致,进一步确认了所制备的粉末态样品的结构及相纯度。
2.1.4 热重分析 4种稀土配合物的热重曲线,显示出几近相同的失重过程,以配合物[La2(oba)3(H2O)5]·H2O(1)为例(见辅助材料图S4)进行讨论分析。 可知,第一步失重过程发生在30~250 ℃温度范围内,失重率为8.81%,与配合物中结晶水和配位水的理论值一致(9.12%);在280~450 ℃范围内配合物的主体框架稳定存在,说明配合物具有良好的热稳定性,随后,配合物的结构骨架开始坍塌,出现了一步急剧的失重过程,直至700 ℃左右完全分解,最终残余率(29.56%)与La2O3理论残余率(28.25%)非常接近。
2.2.1 藤黄微球菌的生长代谢热谱曲线
图2所示为35 ℃下微量量热仪测定的藤黄微球菌正常生长(即空白样品)热谱曲线及其在浓度为100 μmol/L的溶剂、配体、稀土配合物作用下的热谱曲线 (横坐标是时间t,纵坐标是藤黄微球菌生长代谢热功率 Pt)。 从图中可以看出,藤黄微球菌的生长代谢为放热反应,且生长周期分为4个阶段:停滞期、指数生长期、稳定期以及衰减期,在探究稀土配合物的抑菌活性实验时重点研究藤黄微球菌的停滞期、指数期和稳定期,因此,后续的量热实验中只收集藤黄微球菌生长代谢的前3个周期数据。 加入溶剂和配体后的热谱曲线与空白条件下的热谱曲线基本一致;加入一定量的稀土配合物后藤黄微球菌的生长代谢热谱曲线发生明显变化,热谱曲线中的停滞期延长,指数生长期明显变缓,曲线斜率变小,稳定期的热功率数值 Pt变小且时间延长。 结果表明,稀土配合物加入后藤黄微球菌生长代谢热功率 Pt明显减小,但仍然表现为放热过程,同时,配合物与藤黄微球菌发生化学作用的热效应在热谱曲线上基本表现不出来,从而可以判断,热谱曲线中的热效应主要来自于藤黄微球菌的生长热效应,配合物对藤黄微球菌的生长具有明显的抑制作用。
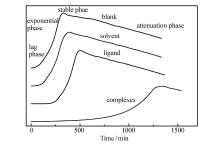 | 图2 35 ℃时藤黄微球菌及其在溶剂、配体、稀土配合物作用下的热谱曲线Fig.2 Power-time curves of Micrococcus luteus and growth in the presence of solvent, ligand and complexes at 35 ℃, respectively |
为了探究稀土配合物的用量与藤黄微球菌作用的热动力学关系,通过微量量热仪测定了藤黄微球菌在35 ℃下不同浓度稀土配合物[Re2(oba)3(H2O)5]·H2O(Re=La、Ce、Sm、Er)作用下的藤黄微球菌的生长代谢热谱曲线图,参见图3。 从图3可以看出,4种同构的配合物对藤黄微球菌的生长代谢均有一定的影响,相同浓度不同配合物作用下的热谱曲线基本一致,同一稀土配合物但浓度不同时藤黄微球菌生长代谢热效应差别较大,从热谱曲线中得到,当抑菌剂的浓度从5 μmol/L增加到200 μmol/L的过程中,藤黄微球菌在停滞期的时间逐渐延长,指数生长期的曲线变缓,稳定期的时间范围越来越宽,且稳定期数值变小。
 | 图3 35 ℃下不同浓度稀土配合物[Re2(oba)3(H2O)5]·H2O(Re=La、Ce、Sm、Er)作用下的藤黄微球菌的生长代谢热谱曲线Fig.3 Power-time curves of Micrococcus luteus growth at different concentrations of complexes [Re2(oba)3(H2O)5]·H2O at 35 ℃ |
2.2.2 藤黄微球菌的生长速率( k)、抑制率( I)、半抑制浓度(IC50)、传代时间( tG)、最大产热功率( Pmax) 为了获得细菌的热动力学参数,本文根据武汉大学屈松生、刘义建立的微生物生长代谢非线性动力学模型[21],结合微生物生长的Logis-tic模型[22],建立了藤黄微球菌的生长代谢动力学模型对图3所示的热谱曲线进行拟合。 藤黄微球菌在指数生长期内的生长代谢遵循特定的指数规律,其数学表达式为:
藤黄微球菌在指数生长期内的某一时间为 t,生长期开始的时间为 t0,藤黄微球菌在 t和 t0时所对应数量为 mt和 m0。 每个细菌在生长中的热功率( W)相同则:
令 Pt=mtw, P0 =m0 w,设 t0=0,带入式(2)得:
式中, Pt是 t时刻的细菌生长代谢的热功率,热谱图中的热曲线的最大产热功率 Pmax代表了藤黄微球菌生长代谢的活性,活性越高 Pmax越大。 k为特定条件下藤黄微球菌的生长速率常数,以ln Pt-t线性拟合可得到生长速率常数 k。 k值的大小直接反映了一定浓度药物作用下细菌的生长、繁殖快慢。
传代时间 tG:在特定条件下细菌的传代时间遵循[23]:
抑制率 I:定义药物对细菌生长代谢过程的抑制率为[24]:
式中, k0为空白实验(不添加稀土配合物)下的速率常数, kc为添加稀土配合物浓度为 c时的速率常数。 I表示一定浓度的稀土配合物对藤黄微球菌生长代谢的抑制程度。 一定浓度的稀土配合物对藤黄微球菌生长的抑制作用越强烈, I值越大,当细菌被完全抑制时, I值刚好达到100%。 通过获取在不同浓度配合物作用下藤黄微球菌生长的速率常数,可得到该配合物对藤黄微球菌作用的 I-c曲线,这是通常的剂量效应曲线,它反映了细菌生长代谢与配合物浓度的关系特征。 当抑制率为50%所对应的化合物浓度为半抑制浓度IC50,半抑制浓度IC50可用于衡量细菌被化合物抑制的敏感性,IC50越小,表示活菌对该化合物越敏感,化合物对细菌的抑制作用就越明显。 从热谱曲线中获得了不同浓度配合物作用下藤黄微球菌的最大产热功率 Pmax及其对应的时间 tmax,利用式(3)、式(4)以及式(5)拟合热谱曲线,可以得到不同浓度稀土配合物作用下藤黄微球菌指数期生长的生长速率常数 k、抑制率 I、传代时间 tG、半抑制浓度IC50等热动力学参数,详见辅助材料表S1。 从表S1中数据可以看出,随着[Re2(oba)3(H2O)5]·H2O(Re=La,Ce,Sm,Er)浓度的增大,生长速率常数 k随之减小,藤黄微球菌的最大产热功率 Pmax也随之减小;抑制率 I和传代时间 tG逐渐变大。 此外,4个配合物的的最大上限浓度均为200 μmol/L,其中,配合物[La2(oba)3(H2O)5]·H2O(1)、[Ce2(oba)3(H2O)5]·H2O(2)和[Sm2(oba)3(H2O)5]·H2O(3)的IC50数值均超过了200 μmol/L,无法得到具体的IC50数值。 通过计算得到,配合物[Er2(oba)3(H2O)5]·H2O(4)的IC50为127 μmol/L,低于200 μmol/L。 可以看出,配合物[Er2(oba)3(H2O)5]·H2O(4)的抑菌活性优于另外3个配合物。
2.2.3 速率常数 k、抑制率 I与配合物浓度 c的关系 如辅助材料表S1所示,当配合物的浓度在5~10 μmol/L时,藤黄微球菌的生长速率常数 k与 k0差别很小,传代时间 tG变化不大,最大产热功率 Pmax减小的幅度不大;[Re2(oba)3(H2O)5]·H2O(Re=La,Ce,Sm,Er)作用下藤黄微球菌的生长速率常数 k大于 k0,抑制率I为负值。
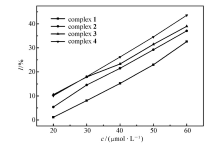
在20~60 μmol/L分别以生长速率常数 k和抑制率 I对浓度 c作图,如图4和5所示,随着配合物浓度的增加,藤黄微球菌的生长动力学参数发生显著变化,速率常数 k逐渐变小、抑制率 I逐渐变大,且在此浓度范围内 k、 I与 c呈现一定的线性关系,显然,藤黄微球菌的生长代谢随着配合物浓度的增加而受到抑制,表现出明显的剂量效应(Dose-dependent),并且,4种配合物对藤黄微球菌的抑制作用存在一定的差异,在浓度相同时配合物[Er2(oba)3(H2O)6]对藤黄微球菌的抑制作用最大,[La2(oba)3(H2O)6]的抑制作用最小。 当浓度达到90 μmol/L及以上时,浓度已不是影响藤黄微球菌生长代谢的主要因数,随着浓度的增加藤黄微球菌生长速率虽然减小,但减小的特别缓慢,抑制率也基本保持不变。
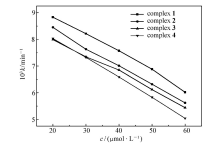 | 图4 不同浓度的配合物抑制下对藤黄微球菌的生长速率常数的影响Fig.4 Effect of Micrococcus luteus growth rate constant( k) at different concentrations of complexes |
稀土配合物具有高效、稳定、持久的抑菌性能,且比许多有机合成物和过渡金属毒性低,从抑菌机理上来说,现在普遍认同的是稀土离子与有机配体的螯合效应[25]。 稀土金属以配位键的方式与有机配体相结合形成配合物,此时稀土离子所带正电荷向配体上移动,螯合环上的部分电子发生离域效应,导致稀土离子的极性减小,使得稀土配合物的脂溶性增强,易于穿过细胞膜的类脂层,这种增强的穿透作用导致细胞死亡[25]。 此外,脂多糖(LPS)是构成细胞壁的重要成分,而细胞内充足的Ca2+离子是维持LPS稳定的重要条件,由于稀土元素的原子半径(0.0848~0.1034 nm)与Ca2+离子半径(0.104 nm)相近,使得稀土离子扮演了拮抗病原菌细胞内Ca2+离子的角色,稀土离子通过取代LPS周围的Ca2+离子,使细胞表面的LPS遭到破坏,改变细胞膜的通透性和功能,影响细胞正常的生理活动[8]。
藤黄微球菌胞壁的主要成分为磷壁酸和肽聚糖。 当溶液中配合物浓度较低时,其主要与肽聚糖中的—C═O、COOH或磷壁酸中的—P—O—、—P═O发生化学作用,通过改变肽聚糖的构象使细胞壁松弛产生一定的缝隙,营养物质可更容易地通过细胞壁进入细胞内,刺激细胞生长。 随着配合物浓度的增加,磷壁酸和肽聚糖中的—P—O—、—P═O或肽聚糖中的—C═O、COOH与稀土配合物作用完全,改变了磷壁酸和肽聚糖的构象,形成通道,大量配合物分子完全进入细胞内,与蛋白质、酶、DNA等发生相互作用,影响细胞的正常生理活动,当配合物浓度达到一定值时,表现为毒性作用,从而抑制藤黄微球菌的生长繁殖[8]。
利用微量量热法研究了羧酸类稀土配合物对藤黄微球菌的抑制作用。 4例配合物对藤黄微球菌的生长代谢均具有一定的抑制效果,不同浓度区间内抑制效果不同,在低浓度范围内,稀土配合物的抑制作用不明显,随着配合物浓度增大,抑菌效果逐渐增强,但当浓度大于90 μmol/L时,抑制率随浓度的增加变化缓慢。 综合比较得出配合物抑制效果依次为:[Er2(oba)3(H2O)5]·H2O(4)>[Sm2(oba)3(H2O)5]·H2O(3)>[Ce2(oba)3(H2O)5]·H2O(2)>[La2(oba)3(H2O)5]·H2O(1),表现出随稀土原子序数的增加,稀土配合物的抑菌效果逐渐加强的规律。 其中稀土配合物[La2(oba)3(H2O)5]·H2O(1)和[Ce2(oba)3(H2O)5]·H2O(2)对藤黄微球菌的生长代谢表现出双向调节作用,在低浓度时表现为刺激作用,在高浓度时表现为抑制作用。 本文通过热化学手段例证了羧酸类稀土金属配合物作为抑菌剂展示了良好的生物活性,为相关研究工作提供了充分的理论及实践指导。
辅助材料(Supporting Information)[图S1和S2为配体和配合物的红外光谱图,图S3为配合物的PXRD图,图S4为配合物的热重图,表S1为藤黄微球菌在不同浓度的稀土配合物作用下生长期的热动力学参数表]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|