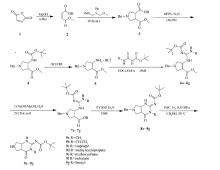
以顺丁烯二酸酐为原料,经过水解、缩合、库尔提斯重排、脱保护得到1-苄基-3-氨基-吡咯烷-4-羧酸甲酯盐酸盐,再与硫脲衍生物缩合得到1-苄基-4-(2-甲酸叔丁酯-3-胍基)吡咯烷-3-羧酸甲酯衍生物,最后经过水解、酯化、脱保护得到六氢-1 H-吡咯并[3,4-d]嘧啶衍生物,其结构经1H NMR、13C NMR、ESI-MS和元素分析表征。 3-(4, 5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测试其抗肿瘤活性,实验结果表明,其中化合物9d和9g对肿瘤细胞(Bel-7402)株具有明显的抑制活性。
Using maleic anhydride as the starting material, hexahydro-1 H-pyrrolo[3,4-d] pyrimidine derivatives were synthesized. The structures of all compounds were characterized by1H NMR,13C NMR, ESI-MS and elemental analysis. Their antitumor activities against Bel-740 human liver cancer cells were determined by the 3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide(MTT) assay. The results indicate that these compounds have a certain inhibitory activity in Bel-740 human liver cancer cells, and the inhibitory activity of compounds 9d and 9g reach the average level.
含氮杂环化合物的种类繁多、数量巨大,在自然界分布极为广泛,许多天然含氮杂环化合物在动植物体内均起着重要的生理作用,如植物中的叶绿素、动物体内组成蛋白质的某些氨基酸以及核苷酸的碱基等,因此含氮杂环化合物广泛应用于材料、农药和医药等领域。 吡咯是一类重要的五元氮杂环化合物,许多具有重要生物活性的天然物质都含有吡咯环,如叶绿素、血红素等。 嘧啶类化合物是一类非常重要的的六元氮杂环化合物,自然界中许多具有重要生理作用的物质都含有嘧啶结构,如胸腺嘧啶核苷酸和胞嘧啶核苷酸等。 吡咯并嘧啶是嘌呤类似物,广泛存在于生物体内,在生物的生命发展过程中起着重要作用,是生命体所必须的。 具有吡咯并嘧啶环结构的化合物具有良好的生物活性和药理活性,例如抗菌[1]、抗病毒[2]、抗癌[3,4,5,6]以及腺苷激酶抑制作用[7,8]和核苷代谢抑制作用[9]等。 从吡咯并嘧啶类衍生物的应用可以看出,寻找和探索这类新的化合物对于寻找新的农药及医药等先导化合物具有重要的理论和应用价值。 因此,我们合成了一系列新型吡咯并[3,4-d]嘧啶类化合物,并对其合成方法和抗肿瘤活性进行了研究。
本文以顺丁烯二酸酐为原料,经过水解、缩合、库尔提斯重排、脱保护得到1-苄基-3-氨基-吡咯烷-4-羧酸甲酯盐酸盐(5),化合物5再与硫脲衍生物缩合得到1-苄基-4-(2-甲酸叔丁酯-3-胍基)吡咯烷-3-羧酸甲酯衍生物(6a~6g),化合物6a~6g再经过水解、酯化、脱保护得到一系列六氢-1 H-吡咯并[3,4-d]嘧啶衍生物(9a~9g)。 所得到的7种化合物均未见文献报道,其结构经过1H NMR、13C NMR、 ESI-MS和元素分析表征,并测试其抗肿瘤活性。 化合物的合成路线如下Scheme 1所示。
所有试剂均为市售分析纯。 Avance 400 MHz型核磁共振仪(瑞士Bruker公司);Waters Acquity型液相-质谱联用仪(美国Waters公司);PE2400-Ⅱ型元素分析仪(美国Perkin-Elmer公司);WK-1B型数字熔点仪(上海精密科学仪器厂)。
1.2.1 富马酸单甲酯(2)的合成 在反应瓶中加入150 g(1.53 mol)顺丁烯二酸酐和500 mL甲醇,加热至回流,反应5 h后把反应液浓缩得到180 g纯净的无色液体富马酸单甲酯(2),收率90%。1H NMR(400 MHz,CDCl3), δ:9.07(s,1H),6.38~6.30(m,2H),3.85(s,3H);MS(ESI)C6H5O6[M+H]+:131.1。
1.2.2 1-苄基-3-羧基-吡咯烷-4-羧酸甲酯(3)的合成 在反应瓶中加入15.0 g(0.114 mol)化合物2、3 mL三氟乙酸和200 mL二氯甲烷,并将反应体系温度降至-15 ℃,向反应体系中缓慢滴加60 mL(0.17 mol) N-甲氧甲基- N-三甲基硅苄胺,滴加完毕,在室温下反应过夜,有白色固体析出,抽滤,并用乙酸乙酯洗涤滤饼,烘干滤饼后得到28 g 1-苄基-3-羧基-吡咯烷-4-羧酸甲酯(3),收率93%。1H NMR(400 MHz,D2O), δ:7.41~7.23(m,5H),4.35(s,2H),3.60(s,3H),3.48~3.39(m,4H),3.35~3.30(m,2H);MS(ESI)C14H17NO4[M+H]+:264.1。
1.2.3 1-苄基-3-Boc氨基-吡咯烷-4-羧酸甲酯(4)的合成 在反应瓶中,把15.0 g(0.057 mol)化合物3溶入150 mL叔丁醇中,在N2气保护下,缓慢加入16 mL(0.114 mol)三乙胺和14.7 mL(0.068 mol)叠氮磷酸二苯酯(DPPA)的混合液,滴加完后加热回流反应10 h,TLC检测原料反应完全,浓缩反应液,粗品经硅胶柱层析(洗脱剂 V(石油醚): V(乙酸乙酯)=5:1)提纯得到淡黄色的9.4 g 1-苄基-3-Boc氨基-吡咯烷-4-羧酸甲酯(4),收率50%。1H NMR(400 MHz,CDCl3), δ:7.40~7.20(m,5H),4.45~4.41(m,1H),3.67(s,3H),3.61(s,2H),3.31(t, J=9.0 Hz,1H),2.98~2.92(m,2H),2.50~2.43(m,2H),2.48(t, J=7.8 Hz,1H),1.42(s,9H);MS(ESI)C18H26N2O4[M+H]+:335.2。
1.2.4 1-苄基-3-氨基-吡咯烷-4-羧酸甲酯盐酸盐(5)的合成 在反应瓶中加入10 g(0.31 mol)化合物4和50 mL含有4 mol/L盐酸的四氢呋喃溶液,在室温下反应10 h,有大量白色固体析出,抽滤,用20 mL乙醚淋洗滤饼,滤饼烘干后得到6.7 g 1-苄基-3-氨基-吡咯烷-4-羧酸甲酯盐酸盐(5),收率78%。1H NMR(400 MHz,CDCl3), δ:7.37~7.22(m,5H),3.70(s,3H),3.62~3.57(m,1H),3.61(s,2H),3.01~2.97(m,1H),2.77~2.71(m,3H),2.48~2.45(m,1H);MS(ESI)C13H18N2O2[M+H]+:235.1。
1.2.5 化合物6a~6g的合成(化合物6a为例) 在反应瓶中加入10.0 g(0.037 mol)化合物5、8.7 g(0.046 mol)1-叔丁氧羰基-3-甲基硫脲和100 mL DMF,在0 ℃条件下缓慢滴加10.7 g(0.056 mol)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI)和18.4 mL(0.111 mol) N, N-二异丙基乙胺(DIEA)组成的混合溶液,滴加完后升至室温,反应大约10 h,TLC检测化合物5反应完全,向反应液中加入100 mL水,用70 mL乙酸乙酯萃取3次,合并有机相,浓缩后得到的产物粗品经硅胶柱层析分离(洗脱剂 V(石油醚): V(乙酸乙酯)=5:1)提纯,得到淡黄色的9.1 g 1-苄基-4-(2-甲酸叔丁酯-3-甲基胍基)吡咯烷-3-羧酸甲酯(6a)。 用类似的方法合成化合物6b~6g。
化合物6a:收率63%;1H NMR(400 MHz,CDCl3), δ:10.04(s,1H),7.40~7.20(m,5H),4.25~4.21(m,1H),3.74(s,3 H),3.65~3.62(m,3H),3.19~3.02(m,2H),2.90(s,3H),2.88~2.83(m,1H),2.72~2.62(m,1H),1.52(s,9H);MS(ESI)C20H30N4O4[M+H]+:391.2。
1-苄基-4-(2-甲酸叔丁酯-3-乙基胍基)吡咯烷-3-羧酸甲酯(6b):收率59%;1H NMR(400 MHz,CDCl3), δ:9.46(s,1H),7.40~7.20(m,5H),4.20~4.10(m,1H),3.90~3.70(m,2H),3.65(m,2H),3.40~3.30(m,3H),3.25~3.15(m,2H),3.10~3.00(m,3H),1.52(s,9H),1.15(t, J=8.0 Hz,3H);MS(ESI)C21H32N4O4[M+H]+:405.2。
1-苄基-4-(2-甲酸叔丁酯-3-异丙基胍基)吡咯烷-3-羧酸甲酯(6c):收率52%;1H NMR(400 MHz,CDCl3), δ:9.43(s,1H),7.30~7.17(m,5H),4.27~4.21(m,1H),3.75(s,3H),3.56~3.45(m,3H),2.90~2.82(m,3H),2.76~2.69(m,1H),2.66~2.59(m,1H),1.50(s,9H),1.19~1.14(m,6H);MS(ESI)C22H34N4O4[M+H]+:419.2。
1-苄基-4-(2-甲酸叔丁酯-3-甲基环丙烷胍基)吡咯烷-3-羧酸甲酯(6d):收率62%;1H NMR(400 MHz,CDCl3), δ:9.45(s,1H),7.34~7.27(m,5H),4.29~4.23(m,1H),3.87~3.79(m,3H),3.71~3.65(m,1H),3.60(s,3H),3.29~3.08(m,2H),3.02~2.88(m,3H),1.49(s,9H),1.07~0.98(m,1H ),0.57~0.38(m,4H);MS(ESI)C23H34N4O4[M+H]+:431.0。
1-苄基-4-(2-甲酸叔丁酯-3-乙基甲醚胍基)吡咯烷-3-羧酸甲酯(6e):收率71%;1H NMR(400 MHz,CDCl3), δ:9.43(s,1H),7.31~7.26(m,5H),3.72(s,3H),3.63~3.59(m,4H),3.37~3.32(m,4H),3.09~3.03(m,2H),2.83(t, J=7.6 Hz,2H),2.81~2.65(m,3H),1.49(s,9H);MS(ESI)C22H34N4O5[M+H]+:435.2。
1-苄基-4-(2-甲酸叔丁酯-3-异丁基胍基)吡咯烷-3-羧酸甲酯(6f):收率61%;1H NMR( 400 MHz,CDCl3), δ:9.48(s,1H),7.85~7.21(m,5H),4.25~4.21(m,1H),3.71(s,3H),3.67~3.51(m,3H),3.31~3.21(m,1H),3.13~2.95(m,2H),2.95~2.80(m,1H),2.80~2.59(m,2H),1.79~1.70(m,1H),1.47(s,9H) ,0.99~0.82(m,6H);MS(ESI)C23H36N4O4[M+H]+:433.3。
1-苄基-4-(2-甲酸叔丁酯-3-苄基胍基)吡咯烷-3-羧酸甲酯(6g):收率60%;1H NMR(400 MHz,CDCl3), δ:9.59(s,1H),7.38~7.19(m,10H),4.65~4.59(m,1H),4.54~4.48(m,1H),4.24~4.19(m,1H),3.62(s,3H),3.47(q, J=12.0 Hz,2H),3.02~2.98(m,2H),2.70~2.65(m,2H),2.54~2.49(m,1H),1.48(s,9H);MS(ESI)C26H34N4O4[M+H]+:467.1。
1.2.6 化合物7a~7g的合成(以化合物7a为例) 在反应瓶中将8.0 g(0.02 mol)化合物6a和2.5 g(0.06 mol)氢氧化钠加入到40 mL甲醇和水的混合溶液( V(甲醇): V(水)=3:1)中,在室温下搅拌反应3 h,反应结束后把甲醇蒸出,再加入30 mL水,用4 mol/L盐酸调节反应液的pH=6,有白色固体析出,抽滤,滤饼烘干后得到的白色产品7.2 g 1-苄基-4-(2-甲酸叔丁酯-3-甲基胍基)吡咯烷-3-羧酸(7a)。 用类似的方法合成化合物7b~7g。
化合物7a:白色固体(收率93%);1H NMR(400 MHz,DMSO-d6), δ:7.40~7.30(m,5H),4.20~4.14(m,1H),3.70~3.51(m,3H),2.90~2.70(m,4H),2.60~2.49(m,3H),1.45(s,9H);MS(ESI)C19H28N4O4[M+H]+:377.3。
1-苄基-4-(2-甲酸叔丁酯-3-乙基胍基)吡咯烷-3-羧酸(7b):白色固体(收率92%);1H NMR(400 MHz,CDCl3), δ:7.40~7.30(m,5H),4.30~4.23(m,1H),3.70~3.60(m,2H),3.20~3.10(m,4H),3.00~2.80(m,3H),1.45(s,9H),1.20(t, J=8.0 Hz,3H);MS(ESI)C20H30N4O4[M+H]+:391.2。
1-苄基-4-(2-甲酸叔丁酯-3-异丙基胍基)吡咯烷-3-羧酸(7c):白色固体(收率88%);1H NMR(400 MHz,CD3OD), δ:7.40~7.26(m,5H),4.49~4.41(m,1H),4.10~4.05(m,1H),3.95~3.89(m,2H),3.47~3.41(m,1H),3.31~3.22(m,4H),1.54(s,9H),1.26~1.21(m,6H);MS(ESI)C21H32N4O4[M+H]+:405.1。
1-苄基-4-(2-甲酸叔丁酯-3-甲基环丙烷胍基)吡咯烷-3-羧酸(7d):白色固体(收率91%);1H NMR(400 MHz,CD3OD), δ:7.38~7.29(m,5H),4.33~4.29(m,1H),3.77~3.70(m,3H),3.68~3.54(m,1H),3.29~3.25(m,1H),3.16~3.08(m,2H),2.98~2.88(m,2H),1.49(s,9H),0.97~0.94(m,1H ),0.55~0.40(m,4H);MS(ESI)C22H32N4O4[M+H]+:417.2。
1-苄基-4-(2-甲酸叔丁酯-3-乙基甲醚胍基)吡咯烷-3-羧酸(7e):白色固体(收率83%);1H NMR(400 MHz,CD3OD), δ:7.31~7.27(m,5H),3.63~3.59(m,4H),3.37~3.33(m,4H),3.10~3.03(m,2H),2.82(t, J=8.0 Hz,2H),2.81~2.68(m,3H),1.50(s,9H);MS(ESI)C21H32N4O5[M+H]+:421.2。
1-苄基-4-(2-甲酸叔丁酯-3-异丁基胍基)吡咯烷-3-羧酸(7f):白色固体(收率85%);1H NMR(400 MHz,CD3OD), δ:7.40~7.21(m,5H),4.21~4.17(m,1H),3.67~3.51(m,3H),3.28~3.21(m,2H),3.13~2.95(m,2H),3.10~2.95(m,2H),1.79~1.60(m,1H),1.45(s,9H),0.99~0.87(m,6H);MS(ESI)C22H34N4O4[M+H]+:419.1。
1-苄基-4-(2-甲酸叔丁酯-3-苄基胍基)吡咯烷-3-羧酸(7g):白色固体(收率90%);1H NMR(400 MHz,CDCl3), δ:7.40~7.10(m,10H),4.49~4.43(m,1H),4.38~4.31(m,2H),4.10~3.90(m,2H),3.63~3.56(m,1H),3.29~3.22(m,1H),3.10~2.90(m,2H),2.81~2.74(m,1H),1.50(s,9H);MS(ESI)C25H32N4O4[M+H]+:453.1。
1.2.7 化合物8a-8g的合成(以化合物8a为例) 在反应瓶中加入6 g(0.016mol)化合物7a、12.4 g(0.024 mol)六氟磷酸苯并三唑-1-基-氧基三吡咯烷(PyBOP)、6.7 mL(0.048 mol)三乙胺和80 mL DMF,在室温下反应10 h,TLC检测化合物7a反应完全,反应液经100 mL水洗后用100 mL乙酸乙酯萃取,合并有机相,蒸出有机相后得到的产物粗品经硅胶柱层析分离(洗脱剂 V(石油醚): V(乙酸乙酯)=5:1)提纯得到4.8 g白色的6-苄基-3-甲基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8a)。 用类似的方法合成化合物8b~8g。
化合物8a:白色固体(收率84%);1H NMR(400 MHz,CDCl3), δ:10.12(s,1H),7.40~7.25(m,5H),4.15(m,1H),3.70~3.60(m,2H),3.34(s,3H) 3.29~3.22(m,1H),3.10~2.09(m,2H),2.98~2.92(m,1H),2.70~2.65(m,1H),1.47(s,9H);MS(ESI)C19H26N4O3[M+H]+:359.2。
6-苄基-3-乙基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8b):白色固体(收率79%);1H NMR(400 MHz,CDCl3), δ:10.12(s,1H),7.30~7.20(m,5H),4.10~3.90(m,1H),3.90~3.65(m,2H),3.70~3.60(m,2H) 3.12(t, J=8.4 Hz,1H),3.10~2.95(m,2H),2.83~2.72(m,2H),1.47(s,9H),1.12(t, J=8.0 Hz,3H);MS(ESI)C20H28N4O3[M+H]+:373.2。
6-苄基-3-异丙基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8c):白色固体(收率84%);1H NMR(400 MHz,CDCl3), δ:10.25(s,1H),7.28~7.19(m,5H),5.08~5.03(m,1H),3.80~3.71(m,2H),3.72~3.65(m,1H),3.15~3.09(m,1H),2.30~2.23(m,2H),2.78~2.71(m,2H),1.50(s,9H),1.40~1.31(m,6H);MS(ESI)C21H30N4O3[M+H]+:387.1。
6-苄基-3-甲基环丙烷-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8d):白色固体(收率84%);1H NMR(400 MHz,CDCl3), δ:10.17(s,1H),7.34~7.24(m,5H),3.95~3.92(m,1H),3.90~3.80(m,3H),3.79~3.68(m,1H),3.17(t, J=8.4 Hz,1H),3.15~2.07(m,2H),2.90~2.82(m,2H),1.49(s,9H),1.16~1.14(m,1H),0.43~0.39(m,4H);MS(ESI)C22H30N4O3[M+H]+:399.2。
6-苄基-3-乙基甲醚-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8e):白色固体(收率84%);1H NMR(400 MHz,CDCl3), δ:9.98(s,1H),7.33~7.27(m,5H),4.28~4.25(m,2H),4.15(m,1H),3.67~3.58(m,4H),3.33(s,3H),3.27~3.24(m,1H),3.07~2.97(m,3H),2.72~2.68(m,1H),1.49(s,9H);MS(ESI)C21H30N4O4[M+H]+:403.0。
6-苄基-3-异丁基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8f):白色固体(收率82%);1H NMR(400 MHz,CDCl3), δ:10.09(s,1H),7.38~7.22(m,5H),3.95~3.82(m,2H),3.82~3.72(m,1H),3.72~3.58(m,1H),3.22~3.01(m,2H),2.92~2.80(m,2H),2.72~2.69(m,2H),2.15~2.08(m,1H),1.49(s,9H),0.92~0.82(m,6H);MS(ESI)C22H32N4O3[M+H]+:401.2。
6-苄基-3-苄基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(8g):白色固体(收率88%);1H NMR(400 MHz,CDCl3), δ:10.04(s,1H),7.30~7.08(m,10H),5.30~5.25(m,2H),4.20(m,1H),3.80~3.70(m,2H),3.30~3.10(m,3H),2.93(m,2H),1.50(s,9H);MS(ESI)C25H30N4O3[M+H]+:435.1。
1.2.8 化合物9a~9g的合成(以化合物9a为例) 在高压釜中加入4 g化合物8a、1.2 g 10%Pd/C(30%/w)和50 mL甲醇,通入H2气,压力达到0.35 MPa,在反应温度50 ℃的条件下反应过夜,反应结束后过滤反应液,滤液浓缩后经硅胶柱层析分离提纯(洗脱剂 V(二氯甲烷): V(甲醇)=20:1)得到淡黄色油状液体的2.2 g 3-甲基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9a)。 用类似的方法合成化合物9b~9g。
化合物9a:淡黄色油状液体(收率73%);1H NMR(400 MHz,CDCl3), δ:9.90(s,1H),4.15~4.08(m,1H),3.50~3.46(m,1H),3.34~3.30(m,4H),3.22~3.11(m,3H),1.51(s,9H);13C NMR(100 MHz,CDCl3), δ:173.9,158.7,151.9,78.8,51.6,50.0,47.1,45.2,28.7,25.5;MS(ESI)C12H20N4O3[M+H]+:269.1;C12H20N4O3元素分析计算值(实测值)/%:C 53.72(53.69),H 7.51(7.47),N 20.88(20.91)。
3-乙基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9b):白色固体(收率86%);mp 216~218 ℃;1H NMR(400 MHz,CDCl3), δ:9.90(s,1H),4.10~4.04(m,1H),4.01~3.90(m,2H),3.50~3.40(m,1H),3.30~3.25(m,1H),3.15~3.10(m,3H),1.51(s,9H),1.16(t, J=8.0 Hz,3H);13C NMR(100 MHz,CDCl3), δ:175.7,159.5,152.1,80.2,51.9,49.8,48.0,46.3,34.7,28.8,13.0;MS(ESI)C13H22N4O3[M+H]+:283.1;C13H22N4O3元素分析计算值(实测值)/%:C 55.30(55.24),H 7.85(7.91),N 19.84(19.83)。
3-异丙基-4-氧代-2(3 H)-甲酸叔丁酯亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9c):黄色油状液体(收率78%);1H NMR(400 MHz,CDCl3), δ:9.98(s,1 H),5.28~5.20(m,1H),4.07~4.02(m,1H),3.45(dd, J=9.6,2.4 Hz,1H),3.26(q, J=8.4 Hz,1H),3.12(m,2H),3.03(m,1H),1.52(s,9H),1.42~1.38(m,6H);13C NMR(100 MHz,CDCl3), δ:168.6,157.5,154.1,81.1,65.2,51.2,48.4,46.9,41.5,28.6,21.1;MS(ESI)C14H24N4O3[M+H]+:297.1;C14H24N4O3元素分析计算值(实测值)/%:C 56.74(56.79),H 8.16(8.21),N 18.90(18.82)。
3-甲基环丙烷-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9d):白色固体(收率80%);mp 183~185 ℃;1H NMR(400 MHz,CD3OD), δ:4.23~4.15(m,1H),4.13~4.06(m,2H),3.49~3.44(m,1H),3.33~3.20(m,4H),3.12~3.08(m,1H),1.49(s,9H),1.21~1.17(m,1H),0.49~0.40(m,4H);13C NMR(100 MHz,CD3OD), δ:170.5,158.7,152.2,79.1,51.8,50.9,48.3,47.0,45.2,28.6,8.7,3.9;MS(ESI)C15H24N4O3[M+H]+:309.1;C15H24N4O3元素分析计算值(实测值)/%:C 58.42(58.45),H 7.84(7.77),N 18.17(18.11)。
3-乙基甲醚-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9e):白色固体(收率84%);mp 146~148 ℃;1H NMR(400 MHz,CDCl3), δ:9.85(s,1H),4.23~4.15(m,2H),4.13~4.10(m,1H),3.68~3.55(m,2H),3.50~3.40(m,1H),3.37~3.28(m,4H),3.18~3.12(m,3H),1.48(s,9H);13C NMR(100 MHz,CDCl3), δ:171.2,157.4,152.1,78.6,70.7,65.3,51.9,49.8,48.2,46.4,29.1,15.3;MS(ESI)C14H24N4O4[M+H]+:313.1;C14H24N4O4元素分析计算值(实测值)/%:C 53.83(53.90),H 7.74(7.67),N 17.94(17.89)。
3-异丁基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9f):黄色固体(收率72%);mp 203~205 ℃;1H NMR(400 MHz,CDCl3), δ:9.92(s,1H),4.11~4.05(m,1H),3.92~3.79(m,2H),3.52~3.40(m,1H),3.32~3.22(m,1H),3.22~3.05(m,3H),2.18~2.01(m,1H),1.50(s,9H),0.88~0.81(m,6H);13C NMR(100 MHz,CDCl3), δ:170.7,158.9,152.3,80.3,52.0,50.9,48.0,47.1,45.4,29.6,28.5,20.9;MS(ESI)C15H26N4O3[M+H]+:311.2 ;C15H26N4O3元素分析计算值(实测值)/%:C 58.04(58.12),H 8.44(8.47),N 18.05(18.12)。
3-苄基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9g):黄色油状液体(收率72%);1H NMR(400 MHz,CDCl3), δ:9.89(s,1H),7.42(d, J=7.2 Hz,2H),7.29(m,3H),5.20(q, J=14.0 Hz,2H),4.12~4.09(m,1 H),3.46(t, J=9.2 Hz,1 H),3.28~3.25(m,1H),3.19~3.12(m,3H),1.50(s,9H);13C NMR(100 MHz,CDCl3), δ:171.5,158.2,152.7,135.9,128.0,126.6,121.9,80.3,51.7,49.6,47.1,45.4,43.0,28.9;MS(ESI)C18H24N4O3[M+H]+:345.1;C18H24N4O3元素分析计算值(实测值)/%:C 62.77(62.79),H 7.02(7.07),N 16.27(16.33)。
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)比色法测定化合物9a~9g对人肝癌细胞(Bel-740) 和人肺癌细胞(A549)的抑制作用[10,11,12,13]。 分别取处于对数生长期的细胞,经0.25%胰酶处理,用15%胎牛血清和RPMI-1640培养液稀释为2×105个/mL。 加到96孔细胞培养板中(每孔100 μL),培养24 h后,按照预先设定好的浓度梯度加入待测试样品,每一个浓度梯度共设3个平行孔,并设置阿霉素阳性对照组和空白孔。 在37 ℃、5%CO2条件下作用36 h。 然后每孔加入5 g/L MTT培养液100 μL作用4 h,弃去上层清液,加入100 μL DMSO,轻微震荡后,于490 nm波长下用酶标仪每孔的吸光值(OD值)。 利用下式计算药物各个浓度对肿瘤细胞的抑制率。
细胞抑制率/%=
根据抑制率对药物浓度作图,最后求出每个样品的半抑制浓度IC50值。
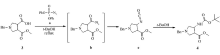
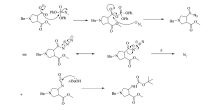
1-苄基-3-Boc氨基-吡咯烷-4-羧酸甲酯(4)的合成,该反应属于库尔提斯重排,有文献[14]报道,该路线合成方法是使用三乙醇胺作为碱性催化剂,甲苯作为溶剂,加热至回流,但是该方法的反应温度过高,导致邻位的酯基也发生重排反应,副产物较多,产品收率不到10%,于是我们加大反应物叔丁醇的量,使其作为溶剂,三乙胺为催化剂,在60 ℃反应,能有效抑制副产物生成,使产品收率提高到50%。 反应的具体过程及机理如Scheme 2和Scheme 3:羧酸3作为反应底物,与叠氮磷酸二苯酯a引发形成的酰基叠氮中间体b在加热条件下重排,形成异氰酸酯c,氮宾(nitrene)式的中间体c形成后,保持立体构型不变进行重排反应得到终产物4。
化合物6a和化合物8a均涉及氨基的缩合,理论上均可以用到相同的缩合催化剂或偶联催化剂,因此我们选择了10组复合催化剂对这2个反应进行研究,结果见表1。
| 表1 催化剂的优化 Table 1 Optimal catalyst of the reaction conditions a |
由表1可见,化合物6a的合成中使用DIEA为碱性化合物与不同的缩合或偶联试剂搭配催化反应,产品收率普遍高于使用三乙胺作为碱性化合物与不同的缩合或偶联试剂搭配作为复合催化剂,其中EDCI与DIEA复合催化收率最高,达到63%。 化合物8a的合成反应是氨基与羧基的缩合,采用BOP偶联试剂类似物PyBOP作为催化剂,反应效果明显优于使用别的缩合或偶联试剂,其中与三乙胺作为复合催化剂反应收率最好,达到84%。
为了探索所得到的7个目标化合物的体外抑制肿瘤细胞生长增殖活性,分别选取了人肝癌细胞(Bel-7402)和人肺癌细胞(A549)两种细胞株作为研究对象。 利用所合成的目标化合物对上述2种细胞株进行了体外抑制肿瘤细胞生长增殖的活性筛选,选用阿霉素和4-氯-7 H-吡咯并[2,3-d]嘧啶作为对照,其测试结果如表2所示。
| 表2 体外抑制肿瘤细胞生长增殖活性测试 Table 2 Antiproliferative activity of the compounds(IC50,μmol/L)* |
目标化合物对肿瘤细胞抑制结果如表2所示,由实验结果可知,一些化合物均显示出了抗人肝癌细胞(Bel-7402)和人肺癌细胞(A549)的效果。 当引入大体积的甲基环丙烷基和苯甲基,化合物9d和9g对肿瘤细胞具有明显的抑制作用。 所以在后期的研究过程中可以通过研究取代基的电子效应和空间效应来进一步研究化合物的抗肿瘤活性。
本文以顺丁烯二酸酐为起始原料,合成了7个六氢-1 H-吡咯并[3,4-d]嘧啶衍生物。 该合成方法具有操作简便、原料价廉易得、产物收率较高等优点,所得到的六氢-1 H-吡咯并[3,4-d]嘧啶衍生物中3-甲基环丙烷-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9d)和3-苄基-4-氧代-2(3 H)-甲酸叔丁酯-亚氨基-六氢-1 H-吡咯[3,4-d]嘧啶(9g)具有明显的抗肿瘤活性,该研究为六氢-1 H-吡咯并[3,4-d]嘧啶衍生物的合成及新型抗肿瘤药物的研发提供了新的思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|