通过浮石负载壳聚糖制备了吸附剂壳聚糖/浮石复合物,采用扫描电子显微镜(SEM)、热重分析(TGA)、元素分析、傅里叶红外光谱(FT-IR)、X射线衍射(XRD)和X射线荧光光谱(XRF)等技术手段表征了吸附剂性质,考察了吸附剂量、吸附时间、溶液pH值、离子强度和温度对该吸附剂吸附去除水中丙溴磷的影响,研究了再生吸附剂的吸附性能。 结果表明,负载在浮石上的壳聚糖占吸附剂总量的8.69%;在pH值3.0~7.0内,壳聚糖/浮石对丙溴磷的吸附率大于90%;这种吸附剂对丙溴磷的吸附受溶液离子强度影响较小,随温度升高而稍微减小。 在溶液温度25 ℃、pH=7.0、丙溴磷浓度40 mg/L、壳聚糖/浮石剂量为0.7 g/L和吸附平衡时间为90 min条件下,此吸附剂对丙溴磷最大吸附率为93.3%(最大吸附量为53.4 mg/g)。 壳聚糖/浮石连续经过3次吸附/再生循环,每次循环对丙溴磷的吸附率下降约12%。 可见壳聚糖/浮石通过吸附可有效地去除水中的农药丙溴磷。
An adsorbent named chitosan/pumice has been prepared for adsorptive removal of profenofos from aqueous solutions. The effects of solution pH, adsorbent dosage, contact time, ion strength and temperature on the adsorption of profenofos were investigated by batch experiments. The immobilization of chitosan was characterized by SEM, TGA, elemental analysis, FT-IR, XRD and XRF. The resultsshow that the chitosan loaded on pumice accounts for 8.69% of the amount of adsorbent; the adsorbent can be employed at pH 3.0~7.0 for quantitative adsorption rate(>90%); the adsorption for profenofos is hardly influenced by ion strength, and slightly decreases with temperature increase. Under the condition of 25 ℃, pH=7.0, 40 mg/L for the concentration of profenofos and 0.7 g/L for dose of chitosan/pumice, the adsorption equilibrium time is 90 min and the maximum adsorption rate of profenofos is 93.3%(53.4 mg/g for adsorbing capacity). The adsorbent can be reused at least three consecutive times with about 12% decrease on profenofos adsorption efficiency. This method for the adsorptive removal of profenofos from aqueous solution is simple, low cost, rapid and effective.
农药污染一直是最重要的环境问题之一,水中农药的迁移对环境和人类健康产生严重的危害。 丙溴磷是一种目前和未来均会广泛使用的有机磷农药,可用于防止棉花、水稻、烟叶和蔬菜等农作物免受害虫危害。 它能抑制乙酰胆碱酯酶的作用,在土壤中半衰期短,但即使在低浓度时也具有较大毒性[1,2]。 根据世界卫生组织(WHO),丙溴磷被划分为中等毒性农药[3]。 这种农药在水中的溶解度为28 mg/L(25 ℃),能随水流动而迁移[4,5]。 因此,必须采取有效措施除去水中的丙溴磷。 吸附是除去水中污染物的重要方法之一,该方法装置简单,耗能少而效率高[6,7]。
浮石是火山岩浆的凝固物,在世界各地广为分布。它多孔、密度小,常能浮在水面,含60%~75% SiO2,表面粗糙,这为吸附污染物提供大量的附着点[8];含大量活性较大的硅醇基[9],能和多种官能团结合,这有利于负载物的固定。 近年来,有报道用浮石除去油脂和脂肪[10]、天然有机质[11]、磷和二氧化硫[12]的研究。
壳聚糖是甲壳素脱乙酰基的产物,分子中含胺基和羟基,这些基团是很好的活性吸附点[13,14]。 因此,壳聚糖是一种很好的吸附剂,能除去多种污染物,例如氟化物、染料、重金属离子和腐植酸[13,14,15]。 但原壳聚糖较软,在水中易团聚或形成胶体,使大多数胺基和羟基难以接近污染物[16,17];另外,它对pH很敏感,可溶于强酸性溶液[18],这些性质导致壳聚糖难以单独用作吸附剂。 但壳聚糖复合材料具有较大的吸附容量和较强的耐酸性[13]。 多种物质可与壳聚糖制成复合物吸附剂,例如膨润土[16,17]、硅镁土[18]、飞灰[19]、苦土[20]、蒙脱石[21]、活性粘土[22]和颗粒活性炭[23]等。
本文利用浮石和壳聚糖的优点以及这两种物质容易接近的特性(浮石含硅醇基,壳聚糖含胺基及羟基,这些都是极性基团),将壳聚糖负载在浮石上制成复合吸附剂壳聚糖/浮石,然后利用这种吸附剂吸附去除水中的农药丙溴磷。 考察壳聚糖/浮石吸附水中丙溴磷的主要影响因素如溶液pH值、吸附剂用量、吸附时间、离子强度和吸附温度以优化吸附方法;探索壳聚糖/浮石再生后对丙溴磷的吸附效果。
丙溴磷标准品,纯度96.93%(Sigma-Aldrich公司)。该农药在中性和酸性条件下稳定,碱性时不稳定;用含1.0%丙酮的超纯水配制丙溴磷储备液,然后再用超纯水将其稀释成各种浓度。 浮石,购于河北灵寿县溢盛矿产品加工厂,粒径为250~1000 μm;其它试剂均为分析纯。 EA3000型元素分析仪(意大利欧维特公司),S-3400N型扫描电子显微镜(日本日立公司),Diamond TG/DTA型热重分析仪(美国PE公司),Nicolet 6700型傅里叶红外光谱仪(美国赛默飞世尔科技),D8 ADVANCE型X射线衍射仪(德国布鲁克公司),S4PIONEER型扫描X射线荧光光谱仪(德国布鲁克AXS有限公司),LA-950型激光散射粒度分布仪(日本HORIBA公司),BELSORP-mini II型比表面积测定仪(荷兰Ankersmid有限公司)。
首先用酸处理浮石除去其中可能影响吸附容量的物质[24],过程如下:将5.0 g浮石加入草酸溶液(100 mL,10.0%(g/mL))中,室温下搅拌4 h;然后过滤,用去离子水冲至中性,在70 ℃烘箱中干燥24 h,接着将此浮石磨成粉末。 取一个干燥洁净烧杯,加入200 mL草酸溶液(10.0%(g/mL));将1.0 g壳聚糖粉末溶于其中,加热至40~50 ℃直到溶液澄清,然后将5.0 g酸处理浮石慢慢加入壳聚糖溶液中,40~50 ℃搅拌90 min后,体系中过量的草酸用 NaOH溶液(0.1 mol/L)中和至pH=7.0,过滤,再用超纯水冲洗,最后在60 ℃烘箱中干燥12 h,使用前磨碎。 测出浮石的粒径和比表面积分别为145 μm和62.9 m2/g,壳聚糖/浮石的粒径和比表面积分别为83 μm和43.4 m2/g。 将1.0 g固体样品与10 mL水混合搅拌2 h,取上清液测定其pH值。 结果表明,浮石和壳聚糖/浮石的pH值分别为6.8和7.3。
采用振荡平衡法研究浮石、壳聚糖和壳聚糖/浮石对丙溴磷的吸附效果,实验在水浴振荡器(转速为150 r/min)中进行,用HCl和NH3·H2O调节溶液pH值。 考察溶液pH值、吸附剂量、吸附时间、离子强度和吸附温度对壳聚糖/浮石吸附丙溴磷影响。 吸附完毕,离心分离溶液。 每次实验平行操作3次。
为了确定各种参数的影响,实验中设定吸附剂壳聚糖/浮石剂量0.1~1.1 g/L,浓度10~90 mg/L的200 mL丙溴磷溶液,溶液pH值2~10,吸附时间2~90 min,溶液温度25~75 ℃,用NaCl溶液将溶液离子强度调节为0.01~0.08 mol/L。
结合文献[25,26],用以下方法提取和测定壳聚糖/浮石吸附的丙溴磷:
1)当pH≤8时,离心后,取5 mL上层清液,加入等体积的二氯乙烷萃取2次,将2次萃取的二氯乙烷层合并,用无水Na2SO4干燥,然后在(28±2) ℃下用旋转蒸发仪蒸发近干,用乙腈将样品溶出并定容1.0 mL,经0.22 μm滤膜过滤后,用Flexar高效液相色谱仪(美国PE公司)测出其中丙溴磷的含量。 分别用式(1)和(2)计算丙溴磷吸附量 q(mg/g)及吸附率 p(%)。
式中, m0为吸附剂质量(g), ρ0和 ρe分别为吸附前后溶液中丙溴磷的浓度(mg/L), V0为溶液体积(L)。
2)当pH>8时,由于丙溴磷在碱性环境中不稳定,此时往离心后的吸附剂中加入10 mL CH2Cl2,超声提取15 min,将2次提取的二氯乙烷层合并,用无水Na2SO4干燥,然后在(28±2) ℃下用旋转蒸发仪蒸发近干,用乙腈将样品取出并定容1.0 mL,经0.22 μm滤膜过滤后,用Flexar高效液相色谱仪测出其中丙溴磷的含量。 分别用式(3)和(4)计算丙溴磷吸附量 q(mg/g)及吸附率 p(%)。
式中, m1为吸附剂吸附的丙溴磷质量(g), ρ0为吸附前溶液中丙溴磷的浓度(mg/L)。
高效液相色谱测定丙溴磷的条件为:检测波长为为224 nm;流动相为乙腈-水(体积比70:30),流速0.9 mL/min;柱温25 ℃;样品进样量20 μL。 在此条件下,丙溴磷的保留时间为11.0 min,检出限为2 μg/L,相对标准偏差(RSD)为1.1%~5.7%( n=6),标准加入回收率为83.9%~108%。
经元素分析仪测定,壳聚糖、浮石和壳聚糖/浮石的N、C和H元素含量见表1。 由表中3种吸附剂中C含量可计算出制备的壳聚糖/浮石复合物中含8.69%(质量分数)壳聚糖;另外,在3次取样测定中,各元素的相对标准偏差(RSD)均较小,这说明壳聚糖均匀地负载在浮石上。
| 表1 元素分析结果( n=3) Table 1 Results of the elemental analysis( n=3) |
浮石和壳聚糖/浮石的SEM照片如图1所示。 由图1 A和1 B可知,浮石孔隙管道较多,壳聚糖成功地固定在浮石表面特别是孔隙中,这样使得壳聚糖间团聚程度很小,大大增加了壳聚糖/浮石的表面有效活性吸附点。
浮石、壳聚糖和壳聚糖/浮石从室温(28 ℃)到920 ℃的热重(TG)分析如图2所示。 由图2可知,当温度上升至800 ℃时,壳聚糖几乎全部碳化,最后失重约82%;28~97 ℃间的失重可认为是除去的表面水,98~266 ℃的较小量失重是分子中的键合水,266~800 ℃的失重是壳聚糖分解所致。对于浮石,在28~920 ℃范围内,只有少量的失重(约6%),这可能是浮石中混入少量的有机物分解缘故。 壳聚糖/浮石的TG行为介于壳聚糖和浮石之间,在230 ℃以上才有明显的失重,最终失重率约为10%,高温时较小失重是由于该复合物中固定的壳聚糖和原浮石中少量有机物分解造成。
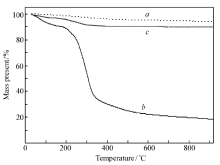 | 图2 浮石( a)、壳聚糖( b)和壳聚糖/浮石( c)的TG曲线Fig.2 TG curves of pumice( a), chitosan( b) and chitosan/pumice( c) |
浮石、壳聚糖和壳聚糖/浮石的红外光谱分别见图3 A、3 B和3 C。 其中浮石的吸收峰归属如下:3457 cm-1为水分子中OH伸缩振动,1638 cm-1为OH弯曲振动,1047 cm-1为Si—O—Si伸缩振动,784和463 cm-1为Si—O—Si伸缩振动。 壳聚糖主要吸收峰如下:3411 cm-1为OH和NH2伸缩振动,2935 cm-1为CH伸缩振动,1638 cm-1为NH2弯曲振动,1382 cm-1为CN伸缩振动,1150 cm-1为CO伸缩振动,1024 cm-1为CO骨架伸缩振动,572 cm-1为CO弯曲振动。 壳聚糖/浮石和浮石的红外光谱图大致相似,但壳聚糖/浮石在2924 cm-1处存在较小吸收峰,这说明有少量的壳聚糖负载在浮石上。
 | 图3 浮石( A)、壳聚糖( B)和壳聚糖/浮石( C)的红外光谱图Fig.3 FTIR spectra of pumice( A), chitosan( B) and chitosan/pumice( C) |
图4 A、4 B和4 C分别为浮石、壳聚糖和壳聚糖/浮石的XRD谱图。 由图4可知,浮石和壳聚糖/浮石的结构相似,说明负载的壳聚糖并没有使浮石结构产生很大影响,2 θ在10°~30°间的圆顶表明样品中存在某些非晶体。
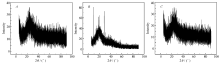 | 图4 浮石( A)、壳聚糖( B)和浮石/壳聚糖( C)的X射线衍射图Fig.4 XRD patterns of pumice( A), chitosan( B) and chitosan/pumice( C) |
用X射线荧光光谱分析浮石化学组分。 结果表明,浮石的主要成分是SiO2和Al2O3,其含量分别为52.08%和7.468%。
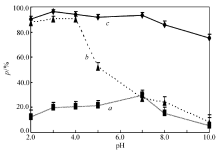
2.2.1 溶液pH值的影响 浮石、壳聚糖和壳聚糖/浮石对丙溴磷的吸附随pH值变化结果见图5。 由图5可知,在实验pH值范围内,浮石不能有效地吸附水溶液中丙溴磷(吸附率6.0%~30%)。 壳聚糖只在pH值3.0~4.0时才能有效吸附丙溴磷(吸附率约90%),这可能是因为壳聚糖表面存在的正电荷基团(质子化的NH2)与丙溴磷阴离子的静电吸引造成;若pH<3.0,则H+与碱性基团NH2反应引起壳聚糖分解而导致其对丙溴磷吸附降低;而碱性增强,则造成壳聚糖和丙溴磷均带负电而使丙溴磷难以吸附。 而且,溶液碱性较强时,部分丙溴磷会分解。
与壳聚糖相比较,壳聚糖/浮石呈现出更有效吸附行为,这种吸附剂在pH值3.0~7.0范围对丙溴磷吸附率大于90%。 由XRD表征可知,浮石中存在7.469%的Al2O3,这种物质在溶液中会产生两性物质Al(OH)3,可能是壳聚糖/浮石在较大pH值范围对丙溴磷吸附率较高的原因。 这大大简化了实验操作,对于自然水中丙溴磷的吸附,可不需调节pH值。
2.2.2 吸附剂量的影响 吸附剂量对丙溴磷吸附的影响见图6。 由图6可知,丙溴磷的吸附率随吸附剂壳聚糖/浮石剂量的增加而增加。 当壳聚糖/浮石剂量为0.7 g/L时,丙溴磷的吸附率(93.3%)达到最大值,最大吸附量为53.4 mg/g;吸附剂量在0.3~0.7 g/L内增加时,该吸附率变化(84.0%~93.3%)不大。 这表明壳聚糖/浮石复合材料中虽然只含8.69%(质量百分比)的壳聚糖,但也有足够吸附活性点吸附丙溴磷。 由于自然界中含量丰富的浮石,因此含8.69%壳聚糖的复合吸附剂价格低廉,可广泛用于水中丙溴磷的去除。
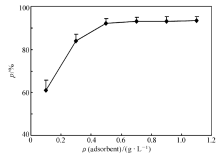 | 图6 吸附剂量对丙溴磷吸附影响Fig.6 Effect of adsorbent dosage on the adsorption of profenofos pH=7.0, ρ(profenofos)0=40 mg/L, V=200 mL, temperature=25 ℃, time=90 min |
2.2.3 吸附时间的影响 吸附时间2~110 min内对壳聚糖/浮石吸附丙溴磷的影响结果见图7。 由图7可知,壳聚糖/浮石对丙溴磷的吸附主要发生在反应前70 min;在吸附前10 min内,丙溴磷的吸附率已达63.0%,这说明壳聚糖/浮石能快速地吸附水中丙溴磷;之后,吸附率随反应时间增加而变缓慢,90 min时达到吸附平衡,此时吸附率为93.3%。 由此可认为吸附前10 min为快反应阶段,此阶段吸附剂活性点位数多,吸附点位周围聚集高浓度丙溴磷,所以反应速率快;此后,随反应的进行,溶液中丙溴磷浓度和壳聚糖/浮石吸附点位数均减少,从而导致丙溴磷吸附速率下降。
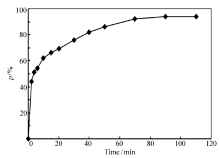 | 图7 时间对丙溴磷吸附影响Fig.7 Effect of reaction time on adsorption profenofos pH=7.0, ρ(profenofos)0=40 mg/L, adsorbent dosage=0.7 g/L, V=200 mL, temperature=25 ℃ |
2.2.4 溶液温度的影响 考察温度为25、50和75 ℃,吸附剂0.7 g/L,pH=7.0,200 mL浓度为40 mg/L丙溴磷溶液条件下,壳聚糖/浮石对丙溴磷的吸附。 结果表明,在25、50和75 ℃时,丙溴磷的吸附率分别为93.3%、91.2%和90.6%。 这说明随着温度的升高,丙溴磷吸附量有所下降,该吸附过程放热。 因此,壳聚糖/浮石对水中丙溴磷的吸附可在25 ℃下进行。
2.2.5 溶液离子强度的影响 在吸附时间90 min,壳聚糖/浮石剂量0.7 g/L,吸附温度25 ℃,水样pH=7.0条件下,用壳聚糖/浮石吸附200 mL浓度为40 mg/L丙溴磷溶液。 结果表明,水中丙溴磷的吸附率为93.3%。 而用NaCl溶液将溶液离子强度分别调到0.01、0.02、0.04和0.08 mol/L时,发现壳聚糖/浮石对丙溴磷的吸附率没有太大的变化。 说明离子强度对壳聚糖/浮石吸附丙溴磷的影响不大,这可能是丙溴磷在pH=7.0水中主要以中性分子存在的缘故。 这样,用壳聚糖/浮石吸附水中丙溴磷时,不需调节水的离子强度,大大简化操作过程。
综上可知,在最佳条件,即吸附时间90 min,壳聚糖/浮石剂量0.7 g/L,吸附温度25 ℃,水样pH=7.0下,壳聚糖/浮石对200 mL浓度为40 mg/L溶液中丙溴磷的饱和吸附量为53.4 mg/g,这数值可作为壳聚糖/浮石对丙溴磷的最大吸附量。 该吸附量与报道的不同吸附剂对农药的吸附比较见表2。 由表2可知,壳聚糖/浮石对丙溴磷吸附量较高,且操作条件简单。
| 表2 不同吸附剂对农药最大吸附量的比较 Table 2 Comparison of maximumadsorption capacities of pesticides by different adsorbents |
当吸附剂壳聚糖/浮石较长时间浸泡在废水中时,多种物质会附着在吸附剂表面及孔隙,导致吸附剂吸附活性下降。 为从吸附剂上除去这些物质以提高吸附剂活性,根据文献[32]所叙加以改进,得到如下4个再生步骤:1)用蒸馏水冲洗吸附了污染物的吸附剂壳聚糖/浮石,使弱吸附物脱离吸附剂表面;2)吸附剂曝气处理,使吸附在吸附剂空隙中的污染物脱离下来;3)将吸附剂浸泡在80%(体积比)甲醇水溶液中24 h,除去吸附剂前两个阶段没有除去的丙溴磷分子(丙溴磷可溶于甲醇),然后用大量超纯水冲洗吸附剂;4)将前处理的吸附剂在85 ℃下烘干,再在105 ℃烘箱中活化1 h;当温度降低至室温时,重复使用吸附剂。
将再生吸附剂在以下条件进行丙溴磷吸附实验:丙溴磷浓度40 mg/L、pH=7.0、25 ℃吸附剂量0.7 g/L和吸附时间90 min。 结果表明,每再生1次,丙溴磷吸附率约减少12%。 说明吸附剂再生后至少可循环使用3次,这大大节约了使用成本。
壳聚糖/浮石可在较大pH范围(pH 3.0~7.0)吸附去除水中丙溴磷,这种吸附作用受离子强度影响较小,随溶液温度升高而减小。 在溶液温度25 ℃、pH=7.0、丙溴磷浓度40 mg/L、壳聚糖/浮石投料量0.7 g/L,吸附时间90 min条件下,吸附剂对丙溴磷最大吸附率为93.3%(最大吸附量为53.4 mg/g)。 此吸附剂连续3次吸附/再生循环,每次循环对丙溴磷的吸附率下降了约12%。 这说明壳聚糖/浮石能有效地吸附去除水溶液中的丙溴磷。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|