以2,6-二甲基吡啶-3,5-二甲酸二乙酯为起始原料,经 N-溴代丁二酰亚胺(NBS)溴代、亲电取代反应合成了时间分辨荧光免疫分析双功能螯合剂2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯。 经差热分析仪(DTA)、傅里叶变换红外光谱仪(FTIR)、核磁共振波谱仪(1H NMR)、质谱仪(MS)等技术手段表征确认了化合物结构和性能。 对该化合物与铕离子形成螯合物的荧光性质研究表明:激发光谱波长范围较宽,激发峰值为322 nm;荧光发射峰为597 nm(5 D0-7 F1)、618 nm(5 D0-7 F2);荧光寿命为918 μs;量子产率 Φ=0.249。
A bifuntional cryptate chelate 2,6-{ N, N', N, N'-[bis(2,2'-bipyridine-6,6'-dimethyl)]bis(aminomethyl)}-pyridine-3,5-diethyl diester for homogeneous time-resolved fluorimmunoassay product was synthesized from the raw material diethyl 2,6-dimethylpyridine-3,5-dicarboxylate through N-bromobutanimide(NBS) bromination, electrophilic substitution. The structure and property were confirmed by differential thermal analysis(DTA) Fourier transform infrared spectroscopy(FTIR), proton nuclear magnetic resonance spectroscopy(1H NMR) and mass spectrometry(MS). Also, the spectral properties of the Eu(Ⅲ)-cryptate chelate, such as absorption spectra, emission spectra, and fluorescence lifetime, were discussed. The fluorescence spectroscopic properties of Eu(Ⅲ)-cryptate are as follows: the excitation peak is at 322 nm, the narrow emission spectrum peaks are at 597 nm(5 D0-7 F1) and 618 nm(5 D0-7 F2), respectively, the Stokes shift is 290 nm, the fluorescence lifetime is 918 μs, and the fluorescence quantum yield is Φ=0.249.
时间分辨荧光免疫分析技术(TRFIA,Time-Resolved Fluoroimmunoassay)作为一项新型非放射性免疫分析技术[1,2,3,4],利用稀土离子发射光谱窄、荧光寿命长、荧光强度高、斯道克斯位移大的特点,用稀土离子标记抗原和抗体等生物样品,采用时间分辨技术,克服了荧光免疫分析生物样品自身的大分子的散射等引起了高背景的缺点,极大地提高了分析灵敏度。
均相时间分辨荧光免疫分析(HTRF,Homogeneous Time-Resolved Fluoroimmunoassay)是对TRFIA技术的进一步发展,是TRFIA和荧光共振能量转移(FRET,Fluorescence Resonance Energy Transfer)的融合,提供了更高的灵敏度和稳定性[5,6,7,8,9]。 HTRF系统除用于临床快速检测外,还可用于药物筛查、DNA原位杂交分析、生物传感器、生物学领域的荧光探针、流式细胞仪、液相层析、电泳及组织化学研究等领域。 对分子生物学、基础医学研究和临床诊断、生物制药、食品检验等行业发展具有重要价值。 HTRF技术的实验方法更灵活可靠,极大地拓展了TRFIA的应用领域。
HTRF最重要的核心技术是制备高效、高荧光强度的稀土双功能螯合剂的稀土配合物。 用于免疫分析的稀土配合物与常规的稀土配合物不同,它必须存在可与生物物质连接的官能团,它不但要求高稀土量子产率、发光强度和动力学稳定性,而且还要求其在水中有较好的溶解性,荧光淬灭尽可能小,在荧光标记蛋白质时,不能使被标记物的免疫活性降低。 因此,设计合成满足上述要求的稀土配合物,一直是在免疫分析领域具有挑战性的课题[10,11,12,13,14]。 而用于能量转移要求的HTRF系统,对稀土配合物提出了更高要求,因此探索一直在进行中。
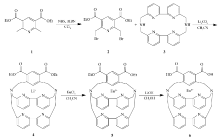
本研究在合成 N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二胺基础上,以2,6-二甲基吡啶-3,5-二甲酸二乙酯为原料经过甲基溴化、亲电取代等合成了化合物2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸乙酯。 通过差热分析(DTA)、红外光谱(FTIR)、核磁共振(1H NMR)、质谱(MS)等确认其结构。 对该化合物与铕离子结合水解后所形成的螯合物荧光性质进行了研究。 所设计螯合物的结构及合成路线如Scheme 1所示。
Unity-400M型核磁共振仪(美国Varian公司);Vertex 70型傅里叶变换红外光谱仪(德国BRUKER公司);7.0 T型超导磁体型傅里叶变换离子回旋共振质谱仪(美国IonSpec公司);DSC-7型差热分析仪(美国PerkinElmer公司);FLSP-920型研究级光谱仪(英国爱丁堡仪器公司);C10027型光子多通道分析仪(日本HAMAMATSU公司);Hitachi F-7000型荧光光谱仪(日本HAMAMATSU公司);荧光寿命测量仪(课题组自主研制)。
三氯甲烷、三氟乙酸、甲醇、四氯化碳、正己烷、环己烷、叔丁醇、二甲基甲酰胺、二甲亚砜、乙腈、碳酸锂、碳酸氢钠、氢氧化锂、无水硫酸钠、 N-溴代丁二酰亚胺、偶氮二异丁腈均为市售分析纯试剂;柱层析硅胶(粒径50~75 μm)、中性氧化铝(粒径75~100 μm)购于国药试剂;C18反相硅胶购于济南博纳生物技术有限公司;2,6-二甲基吡啶-3,5-二甲酸二乙酯购于上海迈瑞尔化学技术有限公司。 N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二胺(本课题组自制),氧化铕(本单位制备)。 实验用水为蒸馏水。
1.2.1 2,6-二(溴甲基)吡啶-3,5-二甲酸二乙酯(化合物2)的合成 将2,6-二甲基吡啶-3,5-二甲酸二乙酯(1.00 g,4.0 mmol)、 N-溴代丁二酰亚胺(1.78 g,10.0 mmol)和8 mg偶氮二异丁腈加入50 mL四氯化碳中回流40 min。 将反应物过滤,滤液倒入碳酸氢钠饱和溶液中,用三氯甲烷(60 mL×3)萃取后水洗,无水硫酸镁干燥过夜。 滤液浓缩干燥,经 V(环己烷): V(二氯甲烷)=8:2硅胶柱层析,得到产物0.50 g,产率30.7%,熔点68.83 ℃。
1.2.2 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯(化合物4)的合成 将 N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二胺(118 mg,0.3 mmol)和碳酸锂(222 mg,3.0 mmol)加入250 mL乙腈溶液中,N2气保护下回流40 min,然后于2 h内滴加2,6-二(溴甲基)吡啶-3,5-二甲酸二乙酯的乙腈溶液(0.61 g/L)200 mL,继续回流22 h。 将反应物过滤,滤液浓缩干燥,经 V(二氯甲烷): V(甲醇)=9:1硅胶柱层析,得到60 mg 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯-Li+ ,产率31%。
1.3.1 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯-Eu3+(化合物5)的合成 将2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯-Li+(50 mg)加入到30 mL的乙腈中,N2气保护下加入EuCl3·6H2O (40 mg),回流48 h。 混合物冷却过滤,滤液浓缩后得到Eu3+螯合物53 mg(bpy·bpy·py(CO2Et)2EuCl3),产率86%。
1.3.2 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸-Eu3+(化合物6)的合成 将2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸二乙酯-Eu3+(20 mg)溶于3 mL甲醇中,加入氢氧化锂水溶液(1 mol/L)0.15 mL,室温下搅拌3.5 h,蒸干溶剂。 反相硅胶柱色谱分离粗产物,以粒径50 μm C18反相硅胶为固定相, V(乙腈): V(1%三氟乙酸水溶液)=7:3为淋洗剂,得到8 mg 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸-Eu3+(bpy·bpy·py(CO2H)2EuCl3),产率45%。
取0.4 mg 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸-Eu3+于烧杯中,加入0.1 mL二甲基甲酰胺溶解,再将此溶液移至5 mL容量瓶中,二次蒸馏水定容,得到浓度为1.7×10-4 mol/L的螯合物水溶液。
穴状化合物[6,7,10]是将稀土离子包含在配体构成的分子空穴中。 吡啶-二联吡啶的穴状结构作为吸光和能量传递基团,可吸收紫外光,并以非辐射能量的方式进行传递。 穴状结构中的多个N原子与稀土离子形成高度配位,可以减小阳离子的协同作用,降低稀土离子自身因浓度效应而产生的荧光猝灭,减少了O—H的振动而引起的能量损失,从而保持了稀土荧光配合物的光物理、光化学的活性。 因此,具有吡啶共轭结构的空穴状稀土配合物可以很好地保护空穴中的稀土离子,具有一般螯合物不能比拟的动力学和热力学稳定性。
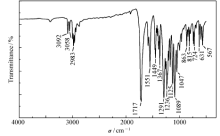
如图1 A所示为化合物2的1H NMR谱: δ 1.453处的三重峰对应酯中2个甲基的6个氢, δ 4.469处的四重峰对应酯中2个亚甲基的4个氢, δ 5.009处的单峰对应2个溴甲基的4个氢, δ 8.795处的单峰对应吡啶环4位的单个氢。1H NMR谱图的各组峰的化学位移、氢原子积分数与化合物2分子结构吻合。图1 B所示为化合物2的质谱图,MS(70 eV) m/z[M+H]+=410.1, [M+Na]+=432.0,与其相对分子质量理论值相符。 其IR谱(图2)出现了1717 cm-1酯基特征峰、631~567 cm-1 C—Br键的伸缩振动峰,证明甲基已被溴化。
 | 图1 2,6-二(溴甲基)吡啶-3,5-二甲酸二乙酯(2)的1H NMR谱图( A)和质谱谱图( B)Fig.1 1H NMR spectrum( A) and mass spectrum( B) of 2,6-bis(bromomethyl)-pyridine-3,5-diethyl diester(2) |
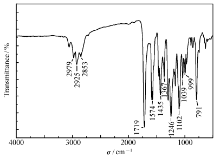
图3 A所示为化合物4的1H NMR谱:1.429处的三重峰对应2个羧酸乙酯中甲基的6个氢,3.902~4.063处的峰对应酯基中2个亚甲基的4个氢和吡啶环2,2'位上亚甲基的4个氢,4.436处的单峰对应2个联吡啶环2,2'位上亚甲基的8个氢;7.387~7.402和7.892处的峰对应2个联吡啶环上的12个氢,8.617处的单峰对应吡啶环4位的氢。1H NMR谱图的各组峰的化学位移、氢原子积分数与化合物4分子结构吻合。图3 B为化合物4的质谱图MS(70 eV) m/z:[M+Na]+=664.3,与理论值相符。 其IR谱(图4)中,631~567 cm-1处C—Br键的特征峰消失,1719 cm-1处酯基的特征峰仍然存在,另外,1574、1435 cm-1处吡啶环C=N、C=C的特征峰增强,说明化合物2与化合物3发生了亲电取代反应,生成了化合物4。
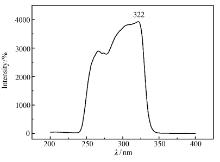
图5为螯合物溶液在荧光光谱仪测得的激发光谱谱图,最大激发位于322 nm处。 其激发波长范围250~340 nm。
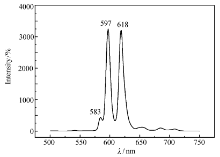
图6为螯合物6在氙灯激发下的荧光发射谱图(固定激发光波长322 nm)。 三组发射峰分别归属于5 D0-7 F0(583 nm)、5 D0-7 F1(597 nm)、5 D0-7 F2(618 nm)跃迁,其中最强发射波长为597和618 nm。 Eu3+离子发射光谱不同峰的相对强弱与其所处的环境有关。 根据Judd-Ofelt理论,当Eu3+占据对称中心时,将以5 D0→7 F1允许的磁偶极跃迁为主。 我们推测,由于本文合成的化合物分子对称性较好,所以螯合物6的发射光谱中5 D0-7 F1(597 nm)的发射峰相对增强了,表现为5 D0-7 F1(597 nm)和5 D0-7 F2(618 nm)两个发射峰的强度基本一样。 从图6还能看出,螯合物6的荧光发射强度高,发射峰尖锐。 结合图5和图6可以看出,该稀土离子螯合物的斯托克斯位移大,荧光激发和发射最大波长之间相距290 nm。
图7为螯合物6在322 nm波长光激发下的荧光衰减曲线,通过单指数拟合测得其荧光寿命为918 μs。
量子产率 Φ是表达所有处于激发态的Eu3+-荧光化合物中经过辐射跃迁(荧光)返回基态的分子个数与其总数的比值,这个比值越大物质的荧光发射强度越强,通常其介于0.1~1荧光之间。 化合物6(Eu3+浓度为1.7×10-4 mol/L)的样品在322 nm波长氙灯激发下的荧光量子产率为0.249。
本实验在合成 N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二胺基础上,以2,6-二甲基吡啶-3,5-二甲酸二乙酯为初始原料,经 N-溴代丁二酰亚胺自由基溴化、亲电取代、稀土离子螯合、酯基水解等反应过程合成了螯合物2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸-Eu3+,并对产物结构进行了确认。 2,6-{ N, N', N, N'-[二(2,2'-联吡啶-6,6'-二甲基)]二(氨甲基)}-吡啶-3,5-二羧酸-Eu3+的激发光谱谱带宽,最强激发峰波长在322 nm;发射光谱主要特征峰为597 nm(5 D0-7 F1)、618 nm(5 D0-7 F2);荧光寿命918 μs;较高的量子产率 Φ=0.249。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|