发展了一种苯甲酰胺自由基自由基环化制备 α-官能化叔烷基取代的异喹啉二酮的新反应。 此环化反应以偶氮试剂为 α-取代叔烷基自由基源物质,利用碘化亚铜/空气体系催化 N-烷基- N-甲基丙烯酰基苯甲酰胺发生环化,经过串联自由基加成/环化/碳-碳键形成过程,一步构建了三重碳-碳键,以41%~71%的产率合成了一系列异喹啉二酮及其衍生物。 特别值得提出得是,此研究发展了一种新型 α-官能叔烷基自由基源物质,发现了一种同时引入两个 α-官能叔烷基片段的串联新反应。 反应底物适应范围广,反应高效,催化体系廉价实用,为具有潜在药用价值的含 α-取代季碳中心的异喹啉二酮及衍生物的合成提供了一条廉价、简单、快捷的新途径。
A radical cyclization reaction of benzamides toward isoquinolinedione bearing α-substituted quaternary carbon was developed. Using alkyl azo compounds as tertiary radical sources, N-alkyl- N-methacryloylbenzamides underwent cascade radical addition/cyclization/C—C bond formation in the presence of Cu catalyst and air, and constructed triple-fold carbon-carbon bonds in a single step, leading to a series of isoquinolinediones in 41% to 71% yield. Notably, this work discovered a new type of radical precursor to α-functional tertiary radical and a protocol to incorporate two α-functional tertiary alkyl moieties. The broad substrate scope and high efficiency allow this method a cheap, simple and rapid catalytic synthetic entry to pharmaceutically interesting isoquinolindiones.
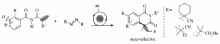
发展廉价、条件温和的碳碳键构建新方法仍然是当今研究的一个热门领域[1,2]。 近些年,廉价金属(如铜铁等)催化的烯烃串联自由基双官能团化“一步”构筑双重碳碳键的方法受到众多的关注。 目前,烯烃自由基双官能团化反应中常用的自由基前体包括,有机羧酸及其衍生物[3]、三氟甲基类试剂(如Togni试剂[4])等。 需要强调的是烷基偶氮试剂[如1,1-偶氮双(环己烷甲腈)]及其衍生物是一类易得、低毒的化合物,它们能在较温和的温度条件下,分解并释放出氮气而生成 α-取代叔烷基自由基,进而可以介导烯烃进行双官能团化反应。 但是,关于偶氮试剂参与的烯烃自由基双官能团化的报道仍然较少[5,6]。 本文发展了一类以1,1-偶氮双(环己烷甲腈)参与的 N-甲基丙烯酰基- N-丁基苯甲酰胺有氧环化合成7-叔烷基异喹啉二酮的反应。
异喹啉二酮及其衍生物广泛分布在自然界中,是许多具有潜在生理活性化合物的重要构建骨架(图 1)[7,8]。 目前一些研究组利用烯烃的双官能团化反应已经实现了含氟基团取代的异喹啉-1,3-二酮骨架的构筑[9,10,11,12,13,14],例如,2013年,Nevado等[12]利用Togni试剂/ n-Bu4NI反应体系,实现了 N-丙烯酰基- N-烷基苯甲酰胺串联环化合成了三氟甲基化异喹啉-1,3-二酮衍生物。 最近,我们课题组[14]发展了一条简单、绿色、便捷的通过可见光诱导实现烯烃双官能化方法,合成了一系列多氟取代的异喹啉-1,3-二酮类化合物。 在此基础上,我们发展了一种铜催化1,1-偶氮双(环己烷甲腈)与烯烃发生串联自由加成/环化/碳碳键形成反应,实现了一系列7-位 α-取代叔烷基化异喹啉二酮衍生物的快速合成(Scheme 1)。
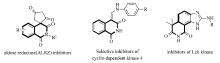 | 图1 几种具有生理活性的异喹啉二酮衍生物Fig.1 Selected examples of biologically active isoquinoline-1,3-dione derivatives |
AVANCE 400(或500) MHz型超导傅里叶数字化核磁共振仪(瑞士Bruker公司);GC-MS-QP2010型质谱仪(日本岛津公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);XT5A型显微熔点仪(北京市科仪电光学仪器厂)。
所用的芳基酰氯、草酰氯、烷基胺和偶氮试剂购自阿拉丁试剂公司或百灵威试剂公司,其它试剂除标明外均为分析纯。 实验中所需的原料 N-丙烯酰基- N-丁基苯甲酰胺(1a~1i)参照相关文献[12,13]报道方法合成得到。
以产物3a合成为例,在封管中依次加入 N-丙烯酰基- N-丁基苯甲酰胺(1a)(0.3 mmol)、1,1-偶氮双(环己烷甲腈)(2a)(1.2 mmol)、碘化亚铜(0.06 mmol)、K3PO4(0.6 mmol)和 N, N-二甲基甲酰胺DMF(2.0 mL)作为溶剂,在90 ℃的油浴锅中反应。 反应结束后(通常10 h),加入乙酸乙酯,然后利用食盐水洗,水相再用乙酸乙酯萃取。 收集有机相,干燥,浓缩,利用柱层析法分离,石油醚/乙酸乙酯(体积比7:1)梯度洗脱,得无色液体产物3a。
产物3a:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.34(d, J=2.2 Hz,1H),7.85(dd, J=8.3,2.2 Hz,1H),7.54(d, J=8.3 Hz,1H),4.06~3.98(m,2H),2.73(d, J=14.6 Hz,1H),2.32(d, J=14.6 Hz,1H),1.99~1.72(m,10H),1.72~1.48(m,5H),1.49~1.28(m,6H),1.30~1.00(m,6H),0.96(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:175.3,163.4,141.8,140.9,131.6,127.5,125.9,125.2,122.2,121.4,49.7,45.6,
44.1,40.7,38.2,37.4,36.9,35.8,33.7,30.9,29.6,24.8,24.7,23.5,23.1,
22.7,22.5,20.3,13.8;HRMS(ESI)计算值C29H38N3O2[M+H]+:460.2959,实测值:460.2961。
产物3b:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.32(s,1H),7.57(s,1H),
4.08~3.88(m,2H),2.72(d, J=14.7 Hz,1H),2.26(d, J=14.7 Hz,1H),2.00~1.83(m,7H),1.68~1.56(m,15H),1.45~1.33(m,5H),0.96(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:174.7,162.8,142.1,139.8,137.9,130.2,128.1,123.7,121.3,120.5,
49.6,45.5,41.9,40.8,38.3,36.9,35.9,35.2,34.8,33.5,29.5,24.9,24.7,
23.1,23.0,22.6,22.5,20.3,13.8;HRMS(ESI)计算值C29H37ClN3O2[M+H]+:494.2569,实测值:494.2573。
产物3c:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.33(d, J=2.2 Hz,1H),7.86(dd, J=8.3,2.3 Hz,1H),7.53(d, J=8.3 Hz,1H),3.41(s,3H),2.73(d, J=14.6 Hz,1H),2.28(d, J=14.5 Hz,1H),1.98~1.77(m,10H),1.62(s,3H),1
.53~1.31(m,6H),1.21(dd, J=9.2,4.9 Hz,2H),1.09~0.99(m,2H);13C NMR(101 MHz,CDCl3), δ:175.5,163.7,141.8,141.1,131.6,127.4,125.9,125.2,122.2,
121.3,50.5,45.6,44.1,38.0,37.4,37.1,36.9,36.2,33.2,27.5,24.8,24.7,
23.5,22.8,22.5;HRMS(ESI)计算值C26H32N3O2[M+H]+:418.2490,实测值:418.2489。
产物3d:无色固体,mp 128~129 ℃;1H NMR(400 MHz,CDCl3), δ:8.36(s,1H),7.85(dd, J=8.3,2.2 Hz,1H),7.56~7.44(m,3H),7.35~7.20(m,3H),5.32(d, J=13.7 Hz,1H),5.11(d, J=13.7 Hz,1H),2.66(d, J=14.6 Hz,1H),2.32(d, J=14.6 Hz,1H),2.25~2.14(m,2H),1.94~1.17(m,21H);13C NMR(101 MHz,CDCl3), δ:175.2,163.5,141.9,140.8,136.5,131.8,129.4,128.4,127.6,126.1,125.0,
122.2,121.4,50.1,45.6,44.1,44.0,38.2,37.5,36.9,35.2,33.5,29.5,25.6,
24.8,24.6,23.5,22.5,22.4;HRMS(ESI)计算值C32H36N3O2[M+H]+:494.2803,实测值:494.2805。
产物3h:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.30(dd, J=21.1,2.2 Hz,1H),7.80~7.74(m,1H),7.59~7.46(m,1H),4.07~3.94(m,2H),2.84(d, J=14.6 Hz,0.6H),2.66(d, J=14.7 Hz,0.4H),2.42(d, J=14.7 Hz,0.4H),2.22(d, J=14.5 Hz,0.6H),2.11~1.97(m,2H),1.77(d, J=13.8 Hz,3H),1.63~1.55(m,5H),1.46~1.37(m,2H),1.22~1.10(m,2H),1.02~0.92(m,12H);13C NMR(101 MHz,CDCl3), δ:175.5,175.0,163.3,163.3,140.9,140.7,140.5,140.3,131.6,131.3,
128.5,127.7,127.3,126.8,126.1,125.7,125.6,125.2,122.4,122.2,
48.6,47.7,45.8,45.6,43.1,43.0,40.8,40.7,39.8,35.5,35.3,35.0,33.7,33.6,
31.7,29.69,29.5,27.4,27.0,26.0,23.4,20.3,20.3,13.8,13.7,9.8,9.7,9.0,8.9;HRMS(ESI)计算值C25H34N3O2[M+H]+:408.2646,实测值:408.2644。
产物3i:黄色油状物,d.r.=1:1;1H NMR(400 MHz,CDCl3), δ:8.49(d, J=8.1 Hz,0.5 H),8.41(d, J=8.1 Hz,0.5 H),7.25(d, J=3.5 Hz,0.5H),7.22(d, J=3.4 Hz,0.5H),4.08~3.89(m,2H),2.64(d, J=8.1 Hz,1H),2.32(d, J=14.7 Hz,1H),2.27~1.97(m,2H),1.82(s,1.5H),1.80(s,1.5H),1.64~1.53(m,5H),1.46~1.34(m,4H),1.05~0.93(m,12H);13C NMR(101 MHz,CDCl3), δ:175.0,163.9(d, J=260.3 Hz),162.4,143.4(dd, J=17.6,7.9 Hz),130.4(dd, J=40.9,5.6 Hz),128.1(dd, J=25.9,12.1 Hz),122.3,122.0(d, J=14.7 Hz),121.3,115.4(dd, J=25.1,11.7 Hz),48.0,47.9,45.6,40.8,35.6,35.3,33.5,33.4,
29.5,25.5,24.4,23.2,20.3,13.8,9.9,9.7,8.9;HRMS(ESI)计算值C25H33FN3O2[M+H]+:426.2552,实测值:426.2550。
产物3j.无色油状物,d.r.=1:1;1H NMR(400 MHz,CDCl3), δ:8.34~8.31(m,1H),7.89~7.78(m,1H),7.63~7.54(m,1H),4.88(d, J=16.8 Hz,0.5H),4.86(d, J=16.8 Hz,0.5H),4.70(d, J=16.8 Hz,0.5H),4.68(d, J=16.8 Hz,0.5H),4.26~4.20(m,2H),2.83(d, J=14.6 Hz,0.5H),2.68(d, J=14.8 Hz,0.5H),2.47(d, J=14.8 Hz,0.5H),2.25(d, J=14.6 Hz,0.5H),2.08~1.95(m,2H),1.80~1.72(m,3H),1.67(s,1.5H),1.66(s,1.5H),1.33~1.24(m,5H),1.08(s,1.5H),1.02~0.94(m,7.5H);13C NMR(101 MHz,CDCl3), δ:175.3,174.7,167.9,167.7,162.9,141.0,140.9,140.7,140.3,132.1,
131.9,128.7,127.9,127.4,127.1,126.3,126.0,125.0,124.6,122.6,122.3,61.7,
61.6,48.5,47.3,46.0,45.9,43.2,43.1,41.7,41.6,35.6,35.5,35.3,35.0,33.8,
33.7,33.4,27.4,27.0,25.8,23.5,14.2,9.8,9.7,9.0,8.9;HRMS(ESI)计算值C25H32N3O4[M+H]+:438.2388,实测值:438.2392。
产物3k:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.23(d, J=2.2 Hz,1H),7.55(dd, J=8.3,2.3 Hz,1H),7.33(d, J=8.4 Hz,1H),3.66(s,3H),3.38(s,3H),3.12(s,3H),2.64(d, J=14.5 Hz,1H),2.55(d, J=14.5 Hz,1H),1.62(s,6H),1.56(s,3H),1.00(s,3H),0.89(s,3H);13C NMR(101 MHz,CDCl3), δ:176.9,176.6,176.3,164.2,144.1,140.2,131.1,127.0,125.7,124.6,52.3,
51.5,51.2,46.4,45.7,41.6,33.3,28.9,27.3,26.4,23.3;HRMS(ESI)计算值C22H30NO6[M+H]+:404.2068,实测值:404.2071。
产物3l:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.25(d, J=2.0 Hz,1H),7.53(dd, J=8.3,2.1 Hz,1H),7.46(d, J=7.2 Hz,2H),7.34~7.19(m,4H),5.25(d, J=13.7 Hz,1H),5.13(d, J=13.7 Hz,1H),3.64(s,3H),3.11(s,3H),2.64(d, J=14.4 Hz,1H),2.59(d, J=14.4 Hz,1H),1.61(s,6H),1.53(s,3H),1.00(s,3H),0.72(s,3H);13C NMR(101 MHz,CDCl3), δ:177.0,176.5,176.0,163.9,144.1,140.2,136.8,131.3,129.2,128.3,
127.1,125.9,124.6,52.4,51.4,50.6,46.4,46.0,43.9,41.6,33.7,29.2,
26.4,26.3,23.1;HRMS(ESI)计算值C28H34NO6[M+H]+:480.2381,实测值: 480.2384。
产物3m:无色油状物;1H NMR(400 MHz,CDCl3), δ:8.23(d, J=2.1 Hz,1H),7.57(dd, J=8.3,2.2 Hz,1H),7.34(d, J=8.4 Hz,1H),4.86(d, J=16.6 Hz,1H),4.63(d, J=16.6 Hz,1H),4.2~4.1(m,2H),3.66(s,3H),3.15(s,3H),2.69(d, J=14.6 Hz,1H),2.63(d, J=14.6 Hz,1H),1.62(s,6H),1.58(s,3H),1.28(t, J=7.6 Hz,3H),1.04(s,3H),0.92(s,3H);13C NMR(101 MHz,CDCl3), δ:177.1,176.5,175.8,167.9,163.5,144.2,140.4,131.5,127.1,126.0,124.1,
61.5,52.4,51.5,50.0,46.4,46.0,41.6,41.5,33.8,29.0,
26.4,26.3,23.5,14.1;HRMS(ESI)计算值C25H34NO8[M+H]+:476.2279,实测值:476.2283。
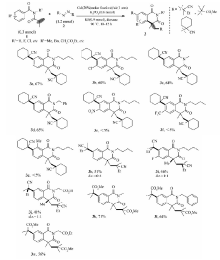
以 N-丙烯酰基- N-丁基苯甲酰胺(1a)与1,1-偶氮双(环己烷甲腈)(2a)的加成环化反应为模型反应来探索最佳反应条件(表1)。 首先考察了本课题组前期报道的碘化亚铜/二叔丁基过氧化物(DTBP)催化剂组合[5],结果仅有痕量的目标产物3a被检测到,同时还发现有少量副产物4a生成(Entry 1)[16]。 接着考察氧化剂过氧叔丁醇(TBHP)及K2S2O4,与DTBP相比它们得到更低的产率(Entries 2,3)。 使用空气作为氧化剂替代DTBP对反应更有利(Entrys 4~7)。 依据我们合成异喹啉二酮的研究经验以及相关文献报道,使用碱有利于促进 N-丙烯酰基- N-丁基苯甲酰胺串联环化成异喹啉二酮[12]。 使用无机碱K3PO4为添加剂,不同溶剂对反应存在较大的影响:1,4-二氧六环作为溶剂时目标产物3a的产率提高到51%(Entries 4~7)。 将氧化剂由空气替换为O2反应得到了相近的结果(Entry 8)。 然而如果撤掉O2或者空气,产物3a的产率降低至20%(Entry 9)。 另外,实验发现使用KF对产物3a的形成有促进作用,其产率达到68%(Entry 10)。 但是,如NaF和CsF等其它氟化盐对反应并没有积极的作用(Entries 11,12)。 接着,对其它碱,如K2CO3、K2HPO4和Cs2CO3,进行了进一步的筛选并发现K3PO4的效果最佳(Entries 13~15)。 另外,通过对偶氮试剂用量考察发现,降低1,1-偶氮双(环己烷甲腈)的用量不利于反应进行(Entry 16)。
综上所述,最佳反应条件为: N-丙烯酰基- N-丁基苯甲酰胺1a(0.3 mmol)、1,1-偶氮双(环己烷甲腈)(1.2 mmol)、K3PO4(0.6 mmol)、KF(0.6 mmol)和CuI(摩尔分数20%)为催化剂,二氧六环(2 mL)为溶剂,温度为90 ℃,在空气环境中反应10 h。
表1 优化反应条件摸索 Table 1 Screening of optimal reaction conditions a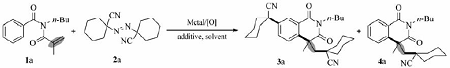 |
得到最佳反应条件后,我们考察了其底物的适用范围(Scheme 2)。 反应结果表明, N-丙烯酰基- N-烷基苯甲酰胺的各种取代基团在反应中表现有较好的兼容性,例如,N原子上连接 n-Bu、Me、Ph、CH2CO2Et对优化的反应条件的兼容性较好,分别以中等产率得到产物3a、3c、3d和3j。 另外,考察底物苯环上各种取代基对反应条件的兼容性表明这些取代基团(4-Cl、4-F等)对该条件均表现较好的兼容性,分别以中等以上的产率得到产物3b、3i。 但是,我们发现苯环上连有一些强拉电子取代基团(如CF3、4-NO2)时反应效果较差,可能是由于其较强的吸电子效应而降低了其反应活性(产物3e、3f)。此反应对取代基的位阻效应很敏感,例如,邻位甲基取代的底物反应后只检测到痕量目标产物3g。 其它偶氮试剂,如偶氮二异戊腈和偶氮二异丁酸二甲酯作为叔烷基自由基源时,反应同样保持较高的活性,分别以中等以上的产率得到产物3h~3m。
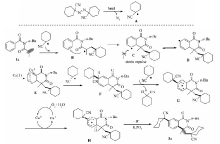
为了揭示反应机理,我们进行了对比试验(Scheme 3)。 结果显示,加入过量自由基清除剂2,2,6,6-四甲基哌啶氮氧化物(TEMPO)时,此环化反应几乎不能发生,此现象表明此反应可能经历了一个自由基历程。
基于上述实验结果和相关的文献报道[9,10,11,12,13,14],我们提出以下可能的反应机理过程(Scheme 4):1,1-偶氮双(环己烷甲腈)在高温下分解为自由基A,接着自由基A加成到底物1a的碳碳双键上生成自由基中间体B,接着中间体B发生分子内环化得到中间体C,然后自由基中间体C发生电子重排得到其共振异构体D,然后Cu(Ⅰ)进入自由基中间体D反应形成Cu(Ⅱ)中间体E[15],然后中间体E将另一自由基A捕获,形成环己-1,4-二烯衍生物F,接着,自由基A夺去中间体F烯丙基氢以产生自由基中间体G。接着,中间体G被Cu(Ⅱ)络合物氧化,形成环己二烯基阳离子H。 值得指出的是,在空气的存在下,这样的Cu(Ⅰ)被氧化成再生Cu(Ⅱ)。 最后,中间体G中的一个质子被无机碱K3PO4脱去进而得到目标产物3a。
本文开发了一种利用廉价的铜/空气催化体系的活泼烯烃与偶氮试剂自由基串联环化合成异喹啉二酮的反应方法。 以烷基偶氮试剂产生的季烷基自由基为偶联物种,实现了苯甲酰胺类化合物串联Heck类型插烯/环化/碳(叔)碳键形成反应,成功构筑了两重 α-官能化碳(叔)碳键,间位选择性地合成了一系列具有潜在生理活性的异喹啉-1,3-(2 H,4 H)二酮。 此工作为合成具有潜在药用价值的氰基取代的异喹啉二酮提供了一条高效、条件温和、简单的新途径。 此反应方法具有底物适应范围广、反应操作简单、原料易得等优点,其也将为合成叔烷基异喹啉二酮提供了一条高效、简单、环境友好的新途径。
辅助材料(Supporting Information)[目标产物的1H NMR、13C NMR表征图]可以免费从本刊网站(
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|