首次设计并合成了16个新型1,2,4-三唑与1,3,4-噻二唑双杂环修饰的酰胺硫醚衍生物,并对其进行了结构表征。 分别评价了目标分子对蛋白酪氨酸磷酸酶1B(PTP1B)和细胞分裂周期25磷酸酶B(Cdc25B)抑制活性,结果发现:16个目标分子对PTP1B具有良好的抑制活性,其中8-C-d和8-D-c的抑制作用最佳,半抑制浓度(IC50值)分别为(1.19±0.22) mg/L和(1.08±0.09) mg/L,优于阳性参照物齐墩果酸(IC50=(1.27±0.19) mg/L),有望作为抗糖尿病药物先导物;对Cdc25B抑制活性测试中,11个目标分子表现出良好的活性,其中8-A-d、8-C-d和8-D-c抑制活性的IC50值分别为(0.97±0.05)、(1.06±0.03)和(0.94±0.11) mg/L,低于阳性参照物Na3VO4(IC50=(1.25±0.14) mg/L),有望作为抗肿瘤药物先导物。
Sixteen novel double-heterocyclic modified amide sulfide derivatives containing 1,2,4-triazole and 1,3,4-thiadiazole were designed and synthesized, and their structures were characterized. The inhibitory activities of synthesized molecules against cell division cycle 25B(Cdc25B) of protein tyrosine phosphatase 1B(PTP1B) were evaluated. The results show that all target molecules exhibit good inhibitory activity against PTP1B. Compounds 8-C-d and 8-D-c have the optimal inhibition. Their half maximal inhibitory concentration(IC50) values are (1.19±0.22) mg/L and (1.08±0.09) mg/L, respectively, which are lower than that of positive reference oleanolic acid(IC50=(1.27±0.19) mg/L). They are expected to be anti-diabetic drug leading compounds. The target molecules also exhibit good inhibitory activities against Cdc25B. The IC50 values of compounds 8-A-d, 8-C-d and 8-D-c are higher than that of positive reference Na3VO4(IC50=(1.25±0.14) mg/L), which are expected to be anticancer drug leading compounds.
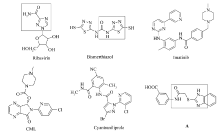
1,2,4-三唑和1,3,4-噻二唑作为两类重要的五元含氮杂环因其广泛的药理活性及其在合成化学、材料科学及生物学领域中的应用,引起了广泛的关注[1,2,3,4,5,6,7,8,9,10]。 许多含有1,2,4-三唑和1,3,4-噻二唑核心骨架的衍生物已成为临床药物:如含有1,2,4-三唑药效基团的广谱强效的抗病毒药物[11]利巴韦林(Ribavirin,如图1),含有1,3,4-噻二唑药效基团,用来防治植物细菌性病害[12],对水稻白叶枯病,细菌性条斑病和柑桔溃疡病有较好的防治效果的叶枯唑(Bismerthiazol,如图1),目前已广泛应用于病毒性疾病的防治。
特别值得关注的是,当杂环通过酰胺键和硫醚键拼合时,能有效发挥活性叠加的作用。 已有研究发现,骨髓中干细胞DNA异常会产生异常蛋白质,从而干扰骨髓中白细胞正常生成,最终导致白细胞数目的剧增,引起造血干细胞疾病。临床用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤的药物伊马替尼(Imatinib,见图1)即为含有酰胺键的杂环药物分子,其治疗的有效率在50%左右[13];临床用于治疗因多种原因引起失眠症的佐匹克隆(CML,见图1)[14],即通过酰胺键将吡啶等杂环对接。 由杜邦公司开发的第二代鱼尼丁受体抑制剂类杀虫剂溴氰虫酰胺[15](Cyantraniliprole,见图1),也是通过酰胺键将吡唑等杂环拼合,其适用作物广泛。近年研究成果还显示,通过酰胺键和硫醚键组合并与杂环对接,得到了活性更高药物分子A(见图1)[16],使类似结构的研究成为学科领域的前沿和热点。
蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,缩写PTP1B)是一种催化酪氨酸磷酸化的酶,它可控制细胞生长、增值和分化。 研究表明,PTP1B可调节胰岛素和瘦素二者信号传导的途径,达到调节体重和葡萄糖的动态平衡,因此针对糖尿病和肥胖等疾病的治疗,研究PTP1B抑制剂无疑具有重要意义。 细胞分裂周期25磷酸酶B(cell division cycle 25B,Cdc25B)是细胞周期蛋白依赖激酶的一个子类,它在细胞周期调节中发挥关键作用[17]。 人体各系统肿瘤均有Cdc25B的过度表达,因此Cdc25B成为癌症治疗的重要靶点。
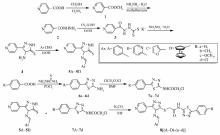
为筛选活性优良的PTP1B和Cdc25B抑制剂,在本课题组前期研究工作的基础上,本文将已发现的活性优良的二茂铁、吡啶和呋喃等结构基元[18]设计在目标分子中,通过酰胺键和硫醚键的组合,将活性药效基团1,2,4-三唑和1,3,4-噻二唑拼合,设计了迄今未见报道的新型结构目标分子,以期通过评价其生物活性,探究分子的构效关系,筛选出活性优良的药物先导物。 目标产物的合成方法如Scheme 1。
AVANCE 500 MHz NMR型核磁共振波谱仪(瑞士Bruker公司);Agilent 6224型高分辨质谱仪(美国Agilent公司);TENSOR 27型傅里叶变换红外光谱仪(德国Bruker AXS公司);X-5型数字显微熔点测定仪(北京泰克仪器有限公司),温度计未经校正;WFH-203B 型三用紫外分析仪(上海精科实业有限公司)。 所用的试剂均为市售的分析纯,两个测试蛋白PTP1B和Cdc25B均由国家新药筛选中心实验室利用大肠杆菌表达并纯化得到的,纯度在90%以上。
1.2 3-吡啶基-1,2,4-三唑衍生物(5A~5D)的合成通法
以4-吡啶甲酸为起始原料,经酯化、成酰肼、制硫钾盐和合环4步反应合成4-氨基-3-(吡啶-4-基)-1 H-1,2,4-三唑-5(4 H)-硫酮(4),收率76%,mp 251.3~253.0 ℃,与文献值相符[19]。 将10 mmol化合物4和12 mmol芳香醛溶于10 mL无水乙醇,于78 ℃下搅拌加热4 h,冷却至室温,过滤,所得粗产物经硅胶柱层析[洗脱剂: V(石油醚): V(乙酸乙酯)=2:1]分离,得到化合物5A~5D。
3-(吡啶-4-基)-4-苯烯基氨基-1 H-1,2,4-三唑-5(4 H)-硫酮(5A):白色固体,收率89%,mp 187.4~188.9 ℃,IR(KBr), σ/cm-1:3109, 2968,2568,1640,1565,1065,752;1H NMR(500 MHz,DMSO-d6), δ:11.10(s,1H,S—H),9.99(s,1H,N=C—H),8.75(d, J=4.4 Hz,2H,PyH),8.11~8.05(m,2H,PyH),7.86~7.73(m,5H,Ph)。
3-(吡啶-4-基)-4-(吡啶-2-基甲烯基氨基)-1 H-1,2,4-三唑-5(4 H)-硫酮(5B):淡黄色固体,收率86%,mp 193.7~198.5 ℃,IR(KBr), σ/cm-1:3120,2985,2549,1700,1611,1074,744;1H NMR(500 MHz,DMSO-d6), δ:11.09(s,1H,S—H),9.97(s,1H, N=C—H),8.77~8.75(m,2H,PyH),8.07(d, J=7.9 Hz,1H,PyH),7.85~7.80(m,2H,PyH),7.50~7.38(m,3H,PyH)。
3-(吡啶-4-基)-4-(呋喃-2-基甲烯基氨基)-1 H-1,2,4-三唑-5(4 H)- 硫酮(5C):淡灰色固体,收率85%,mp 188.6~190.5 ℃,IR(KBr), σ/cm-1:3103,2956,2580,1650,1600,1077,756;1H NMR(500 MHz,DMSO-d6), δ:11.08(s,1H,S—H),9.78(s,1H, N=C—H),8.70(d, J=5.8 Hz,2H,PyH),8.05(d, J=5.8 Hz,2H,PyH),7.43(d, J=1.8 Hz,1H,furan—H),7.12(d, J=1.8 Hz,1H,furan—H),6.7 5(d, J=1.8 Hz,1H,furan—H)。
3-(吡啶-4-基)-4-二茂铁基甲烯基氨基-1 H-1,2,4-三唑-5(4 H)-硫酮(5D):橘黄色固体,收率81%,mp 180.54~181.7 ℃,IR(KBr), σ/cm-1:3108,2957,2567,1668,1580,1405,1072,766,451;1H NMR(500 MHz,DMSO-d6), δ:11.15(s,1H,S—H),10.12(s,1H, N=C—H),8.32(d, J=4.7 Hz,2H,PyH),8.15(d, J=7.8 Hz,2H,PyH),4.78(t, J=1.8 Hz,2H,FcH),4.56(t, J=1.8 Hz,2H,FcH),4.35(s,5H,PyH)。
分别以4种芳香酸为起始原料,采用经典的方法[20]合成2-氨基-5-取代1,3,4-噻二唑(6a~6d)(其中6a收率91%,mp 209.5~210.8 ℃;6b收率90%,mp 210.3~211.9 ℃;6c收率93%,mp 192.4~194.1 ℃;6d收率77%,mp 214.8~215.2 ℃,所得结果与文献之相符)。 将化合物6的氨基利用ClCH2COCl进行氨基保护[21]制得2-氯- N-(5-(芳香基)-1,3,4-噻二唑-2-基)乙酰胺(7a~7d))制备(其中7a收率80%,mp 127.5~126.8℃;7b收率81%,mp 133.4~135.2 ℃;7c收率81%,mp 112.3~114.1 ℃;7d收率78%,mp 130.2~131.7℃,所得结果与文献相符)。 然后分别将1 mmol中间体(5A~5D)、10 mL丙酮及1.2 mmol的K2CO3置于100 mL反应瓶中,室温搅拌5 min,然后分别缓慢滴入15 mL中间体7a~7d的丙酮溶液(1 mmol化合物7a~7d溶于15 mL丙酮中)。 回流搅拌,薄层液相色谱(TLC)监测反应完成后,将反应液倾入冷水中,过滤,所得粗产品经硅胶柱层析(洗脱剂: V(石油醚): V(乙酸乙酯)=3:1)分离,得到目标化合物8[(A~D)-(a~d)]。
N-(5-苯基-1,3,4-噻二唑-2-基)-2-((4-苯基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基))硫基)乙酰胺(8-A-a):白色固体,收率73%,mp 235.3~236.5 ℃,IR(KBr), σ/cm-1:3514,3060,2931,1665,1611,1107,783,685;1H NMR(500 MHz,DMSO-d6), δ:11.29(s,1H,N—H),10.39(s,1H, N=C—H),8.76(d, J=4.4 Hz,2H,PyH),8.09~8.04(m,2H,PyH),7.93(t, J=8.6 Hz,8H,Ph),7.66~7.43(m,2H,Ph),4.50(s,2H,CH2);HRMS(ESI)计算值C24H18N8OS2[M+1]+:498.1045,实测值:498.1033。
N-(5-(对甲苯基)-1,3,4-噻二唑-2-基)-2-((4-苯基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-A-b):白色固体,收率70%,mp 237.5~238.9 ℃,IR(KBr), σ/cm-1:3608,3030 ,2982,1680,1610,1124,775,664;1H NMR(500 MHz,DMSO-d6), δ:11.34(s,1H,N—H),10.06(s,1H,N=C—H),8.78~8.77(m,2H,PyH),8.09(d, J=8.6 Hz,2H,PyH),7.84~7.83(m,3H,Ph),7.43~7.26(m,4H,Ph),4.45(s,2H,CH2),2.72(s,3H,CH3);HRMS(ESI)计算值C25H20N8OS2[M+1]+:512.1201,实测值:512.1218。
N-(5-(4-甲氧苯基)-1,3,4-噻二唑-2-基)-2-((4-苯基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-A-c):白色固体,收率75%,mp 241.2~244.1 ℃,IR(KBr), σ/cm-1:3564,3030,2975,1675,1632,1110,764,673;1H NMR(500 MHz,DMSO-d6), δ:11.60(s,1H,N—H),10.12(s,1H, N=C—H),8.32(d, J=4.7 Hz,2H,PyH),8.18(d, J=7.8 Hz,2H,PyH),8.06~8.04(m,2H,Ph),7.65~7.63(m,3H,Ph),7.55~7.47(m,2H,Ph),4.36(s,2H,CH2),3.88(s,3H,OCH3);HRMS(ESI)计算值C25H20N8O2S2[M+1]+:528.1151,实测值:528.1165。
N-(5-(4-氯苯基)-1,3,4-噻二唑-2-基)-2-((4-苯基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-A-d):白色固体,收率62%,mp 213.7~215.4 ℃,IR(KBr), σ/cm-1:3582,3040,2968,1660,1609,1108,756,680;1H NMR(500 MHz,DMSO-d6), δ:11.38(s,1H,N—H),10.67(s,1H, N=C—H),8.32(d, J=4.7 Hz,2H,PyH),8.18(d, J=7.8 Hz,2H,PyH),8.06~8.04(m,4H,Ph),7.65~7.63(m,4H,Ph),7.55~7.47(m,1H,Ph),4.40(s,2H,CH2);HRMS(ESI)计算值C24H17ClN8O2S2[M+1]+:532.0655,实测值:532.0646。
N-(5-苯基-1,3,4-噻二唑-2-基)-2-((4-(吡啶-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-B-a):淡黄色固体,收率74%,mp 243.7~245.1 ℃,IR(KBr), σ/cm-1:3614,3030,2975,1673,1613,1107,773,656;1H NMR(500 MHz,DMSO-d6), δ:11.09(s,1H,N—H),10.53(s,1H, N=C—H),8.78~8.77(m,3H,PyH),8.09(d, J=7.9 Hz,3H,PyH),7.84~7.81(m,2H,PyH),7.43~7.26(m,5H,Ph),4.65(s,2H,CH2);HRMS(ESI)计算值C23H17N9OS2[M+1]+:499.0997,实测值:499.0991。
N-(5-(对甲苯基)-1,3,4-噻二唑-2-基)-2-((4-(吡啶-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-B-b):淡黄色固体,收率72%,mp 246.4~248.1 ℃,IR(KBr), σ/cm-1:3562 ,3039,2981,1675,1616,1132,739,670;1H NMR(500 MHz,DMSO-d6), δ:11.26(s,1H,N—H),10.06(s,1H, N=C—H),8.73(d, J=5.8 Hz,2H,PyH),8.14~8.13(m,1H,PyH),7.86(t, J=7.0 Hz,3H,PyH),7.09(t, J=1.8 Hz,4H,Ph),4.27(s,2H,CH2),2.71(s,3H,CH3);HRMS(ESI)计算值C24H19N9OS2[M+1]+:513.1154,实测值:513.1160。
N-(5-(4-甲氧苯基)-1,3,4-噻二唑-2-基)-2-((4-(吡啶-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-B-c):淡黄色固体,收率70%,mp 250.3~251.6 ℃,IR(KBr), σ/cm-1:3587,3030,2968,1660,1606,1109,768,658;1H NMR(500 MHz,DMSO-d6), δ:11.48(s,1H,N—H),10.66(s,1H, N=C—H),8.74~8.73(m,3H,PyH),8.08(d, J=7.9 Hz,3H,PyH),7.82~7.79(m,2H,PyH),7.41~7.26(m,4H,Ph),4.64(s,2H,CH2),3.84(s,3H,OCH3);HRMS(ESI)计算值C24H19N9O2S2[M+1]+:529.1103,实测值:529.1112。
N-(5-(4-氯苯基)-1,3,4-噻二唑-2-基)-2-((4-(吡啶-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-B-d): 淡黄色固体,收率75%,mp 228.8~229.2 ℃,IR(KBr), σ/cm-1:3547 ,3030,2983,1670,1616,1087,758,682;1H NMR(500 MHz,DMSO-d6), δ:11.54(s,1H,N—H),10.64(s,1H, N=C—H),8.78~8.77(m,3H,PyH),8.09(d, J=7.9 Hz,3H,PyH),8.84~8.81(m,2H,PyH),7.43~7.26(m,4H,Ph),4.64(s,2H,CH2);HRMS(ESI)计算值C23H16ClN9OS2[M+1]+:533.0608,实测值:533.0613。
N-(5-苯基-1,3,4-噻二唑-2-基)-2-((4-(呋喃-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-C-a):淡灰色固体,收率80%,mp 231.6~233.2 ℃,IR(KBr), σ/cm-1:3564,3030,2981,1682,1609,1166,1092,774,676;1H NMR(500 MHz,DMSO-d6), δ:11.20(s,1H,N—H),9.54(s,1H, N=C—H),8.73(d, J=5.8 Hz,2H,PyH),8.02((d, J=5.8 Hz,2H,PyH),7.69~7.52(m,5H,Ph),7.43(d, J=8.5 Hz,1H,furan—H),7.12(d, J=8.6 Hz,1H,furan—H),6.75~6.74(m,1H,furan—H),4.30(s,2H,CH2);HRMS(ESI)计算值C22H16N8O2S2[M+1]+:488.0838,实测值:488.0831。
N-(5-(对甲苯基)-1,3,4-噻二唑-2-基)-2-((4-(呋喃-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-C-b):淡灰色固体,收率82%,mp 237.3~239.0 ℃,IR(KBr), σ/cm-1:3575 ,3030,2979,1668,1604,1158,1083,763,662;1H NMR(500 MHz,DMSO-d6), δ:11.32(s,1H,N—H),9.59(s,1H, N=C—H),8.11(d, J=1.4 Hz,2H,PyH),7.87~7.81(m,2H,PyH),7.78~7.75(m,4H,Ph),7.45(d, J=3.5 Hz,1H,furan—H),7.13(d, J=3.5 Hz,1H,furan—H),6.75~6.73(m,1H,furan—H),4.32(s,2H,CH2),2.77(s,3H,CH3);HRMS(ESI)计算值C23H18N8O2S2[M+1]+:502.0994,实测值:502.0986。
N-(5-(4-甲氧苯基)-1,3,4-噻二唑-2-基)-2-((4-(呋喃-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-C-c):淡灰色固体,收率76%,mp 237.4~239.1 ℃,IR(KBr), σ/cm-1:3614,3043,2975,1670,1612,1158,1078,767,682;1H NMR(500 MHz,DMSO-d6), δ:11.26(s,1H,N—H),10.34(s,1H, N=C—H),8.32(d, J=4.7 Hz,2H,PyH),8.18(d, J=7.8 Hz,2H,PyH),8.05~8.04(m,4H,Ph),7.65~7.63(m,1H,furan—H),7.55~7.47(m,1H,furan—H),6.75~6.74(m,1H,furan—H),4.44(s,2H,CH2),3.88(s,3H,OCH3);HRMS(ESI)计算值C23H18N8O3S2[M+1]+:518.0943,实测值:518.0951。
N-(5-(4-氯苯基)-1,3,4-噻二唑-2-基)-2-((4-(呋喃-2-基甲烯基氨基)-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-C-d):淡灰色固体,收率77%,mp 220.6~222.3 ℃,IR(KBr), σ/cm-1:3577,3030,2988,1675,1610,1160,1084,759,669;1H NMR(500 MHz,DMSO-d6), δ:11.26(s,1H,N—H),10.66(s,1H, N=C—H),8.74(d, J=4.8 Hz,2H,PyH),8.08~8.06(m,2H,PyH),7.82~7.80(m,4H,PyH),7.41~7.38(m,1H,furan—H),7.26(d, J=3.5 Hz,1H,furan—H),6.75~6.73(m,1H,furan—H),4.32(s,2H,CH2);HRMS(ESI)计算值C22H15ClN8O2S2[M+1]+:522.0448,实测值:522.0453。
N-(5-苯基-1,3,4-噻二唑-2-基)-2-((4-二茂铁基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-D-a):橘黄色固体,收率70%,mp 267.4~268.6 ℃,IR(KBr), σ/cm-1:3548,3030,2982,1668,1608,1409,1107,798,657,483;1H NMR(500 MHz,DMSO-d6), δ:11.43(s,1H,N—H),9.70(s,1H, N=C—H),8.32(d, J=4.7 Hz,2H,PyH),8.18(d, J=7.8 Hz,2H,PyH),8.06~8.04(m,2H,Ph),7.65~7.63(m,2H,Ph),7.55~7.47(m,1H,Ph),4.79(t, J=1.8 Hz,2H,FcH),4.56(t, J=1.8 Hz,2H,FcH),4.32(s,5H,PyH),4.25(s,2H,CH2);HRMS(ESI)计算值C28H22FeN8OS2[M+1]+:606.0707,实测值:606.0715。
N-(5-(对甲苯基)-1,3,4-噻二唑-2-基)-2-((4-二茂铁基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-D-b):橘黄色固体,收率71%,mp 268.9~270.2 ℃,IR(KBr), σ/cm-1:3566,3040,2983,1676,1612,1410,1110,754,681,490;1H NMR(500 MHz,DMSO-d6), δ:11.41(s,1H,N—H),10.06(s,1H, N=C—H),8.82~8.77(m,2H,PyH),8.09(d, J=7.9 Hz,2H,PyH),7.84~7.81(m,2H,Ph),7.43~7.40(m,2H,Ph),4.79(t, J=1.8 Hz,2H,FcH),4.56(t, J=1.8 Hz,2H,FcH),4.35(s,5H,PyH),4.22(s,2H,CH2),2.71(s,3H,CH3);HRMS(ESI)计算值C29H24FeN8OS2[M+1]+:620.0864,实测值:620.0832。
N-(5-(4-甲氧苯基)-1,3,4-噻二唑-2-基)-2-((4-二茂铁基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-D-c):橘黄色固体,收率71%,mp 273.6~275.0 ℃,IR(KBr), σ/cm-1:3561,3030,2980,1681,1609,1421,1121,781,680,475;1H NMR(500 MHz,DMSO-d6), δ:11.40(s,1H,N—H),9.74(s,1H, N=C—H),8.78~8.77(m,2H,PyH),8.09(d, J=7.9 Hz,2H,PyH),7.84~7.81(m,2H,Ph),7.43~7.26(m,2H,Ph),4.74(t, J=1.8 Hz,2H,FcH),4.56(t, J=1.8 Hz,2H,FcH),4.35(s,5H,PyH),4.20(s,2H,CH2),3.84(s,3H,OCH3);HRMS(ESI)计算值C29H24FeN8O2S2[M+1]+:636.0813,实测值:636.0825。
N-(5-(4-氯苯基)-1,3,4-噻二唑-2-基)-2-((4-二茂铁基-2-甲烯基氨基-5-(吡啶-4-基)-4 H-1,2,4-三唑-3-基)硫基)乙酰胺(8-D-d):橘黄色固体,收率70%,mp 250.6~251.8 ℃,IR(KBr), σ/cm-1:3621,3030,2979,1675,1610,1410,1120,767,687,490;1H NMR(500 MHz,DMSO-d6), δ:11.40(s,1H,N—H),9.70(s,1H, N=C—H),8.78~8.77(m,2H,PyH),8.09~8.06(m,2H,PyH),7.84~7.81(m,2H,Ph),7.43~7.26(m,2H,Ph),4.76(t, J=1.8 Hz,2H,FcH),4.56(t, J=1.8 Hz,2H,FcH),4.35(s,5H,PyH),4.20(s,2H,CH2);HRMS(ESI)计算值C28H21ClFeN8OS2[M+1]+:640.0318,实测值:640.0304。
PTP1B是从大肠杆菌中表达并纯化的谷胱甘肽巯基转移酶(GST)融合蛋白,采用紫外底物间硝基苯磷酸盐(pNPP)考察用不同化合物对这种融合蛋白的活性抑制;Cdc25B蛋白是以GST融合蛋白形式存在于上清液中,细胞裂解后经GSH-亲和柱纯化得到。 采用荧光底物邻甲基荧光磷酸酯(OMFP)考察不同化合物对Cdc25B蛋白活性抑制情况,针对化合物的药用效果进行初步评价。 选择抑制率>50%的目标分子进行复筛,测试样品浓度为5 mg/L时的抑制活性,得出抑制活性剂量依赖关系,即IC50值。 IC50值通过样品活性对样品浓度进行非线性拟合得到。 筛选实验参照文献[22,23,24]方法进行。 其中Na3VO4是酪氨酸磷酸酯酶广谱的抑制剂,可作为Cdc25B抑制活性的对照药物,齐墩果酸(Oleanolic acid)是通过PTP1B靶点筛选出来的阳性抑制剂,可作为PTP1B的抑制活性的对照药物。 本实验由国家新药中心协助完成,结果如表1所示。
| 表1 目标化合物对Cdc25B和PTP1B的抑制率 Table 1 Inhibition rate of the target compounds for Cdc25B and PTP1B |
在PTP1B抑制活性的测定中发现,所有目标分子均表现出了良好的抑制活性,表明通过酰胺硫醚键将1,2,4-三唑与1,3,4-噻二唑拼合能够产生良好的PTP1B抑制活性,其中8-C-d和8-D-c的抑制作用最明显,IC50值分别为(1.19±0.22)和(1.08±0.09) mg/L,优于对照物齐墩果酸(IC50=(1.27±0.19) mg/L)。 在Cdc25B抑制活性测试中,11个目标分子表现出良好的活性,其中8-A-d、8-C-d和8-D-c的IC50值分别为(0.97±0.05)、(1.06±0.03)和(0.94±0.11) mg/L,低于对比参照物Na3VO4(IC50=(1.25±0.14) mg/L),说明其抑制效果优良。
根据药物化学原理,药物活性分子与受体的分子识别和相互作用是引发药理活性的基础,并具有很高的特异性。 一方面1,2,4-三唑和1,3,4-噻二唑骨架结构是优良的药效基团,多杂原子的存在增加了与生物体内大分子的相似性,通过酰胺硫醚键将其拼合,能形成可旋转的空间结构,从而在与受体分子作用时产生较好的空间排布,增加其相互的作用。 另一方面由于结构特异性药物也依赖于药物分子内的化学基团,它们因影响的分子的极性、电性、大小以及空间结构等因素而导致其活性发生变化。 目标分子中具有芳香性和生物活性的吡啶、呋喃和二茂铁基等因与杂环发生共轭效应,改变了目标分子的极性和电性,成为必要的活性基团,发挥了活性叠加作用;氯原子和甲氧基的存在一方面改变了分子的电子密度,另一方面也增加了分子的脂溶性,使目标分子与受体间的分子间作用力增大;酰胺键和硫醚键的存在,使目标分子与受体之间更易产生氢键,达到对受体分子的识别和相互作用,从而表达出目标分子优异的生物活性。
目标分子8-C-d对PTP1B抑制活性较为明显,可能是苯环上的氯原子和呋喃环的氧原子同时与生物大分子发生辅助作用的结果。化合物8-D-c对PTP1B的抑制作用明显,可能是分子结构同时引入斥电子基甲氧基和二茂铁基团。 其中二茂铁的芳香结构中两个茂环可以是重叠的,也可以是错位的,这种独特的空间构型使其具有优良的生物活性。
在Cdc25B抑制活性测试结果中,11个目标分子的抑制作用良好。 除了呋喃和二茂铁基团,苯基和吡啶基团也显现出较好的生物活性,原因是吡啶与苯结构相似,芳香环上下电子外露,极可能改变了分子的电性,增强了目标分子的生物活性。
设计合成了16个新型1,2,4-三唑与1,3,4-噻二唑双杂环修饰的酰胺硫醚衍生物。 所有目标化合物均表现出良好PTP1B的抑制活性,其中8-C-d和8-D-c的抑制效果最佳,IC50均优于阳性参照物齐墩果酸(IC50 =(1.27±0.19) mg/L),表明当引入呋喃、甲氧基和二茂铁基团时,PTP1B抑制作用明显,有望作为抗糖尿病药物先导物;11个目标分子表现出良好的Cdc25B抑制活性,其中8-A-d、8-C-d和8-D-c的IC50值低于阳性参照物Na3VO4(IC50=(1.25±0.14) mg/L),表明当引入苯基和吡啶时,Cdc25B具有较好的抑制效果,有望作为抗肿瘤药物先导物。
致谢 PTP1B和Cdc25B抑制活性筛选试验由国家新药筛选中心协助测定,在此对他们的帮助表示诚挚的谢意。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|