锌广泛存在于人体内,具有重要生理功能。 因此,对游离锌离子的选择性识别和有效检测具有重要意义。 荧光探针因其设计简单、易于操作、灵敏度高、可细胞成像等诸多优点而广泛应用于锌离子的识别研究。 锌离子荧光探针常见的识别机理包括光致电子转移、分子内电荷转移、荧光共振能量转移、聚集诱导荧光增强、螯合荧光增强等。 其中,基于螯合荧光增强机理的锌离子探针,其荧光团通常可同时作为识别基团,因此,相比于其它探针,具有设计较为简单、合成较为便捷的优点。 本文综述了近年来文献中报道的基于以上各种识别机理的锌离子荧光探针,并着重介绍了螯合荧光增强机理在锌离子识别中的应用。
It is of great importance to selectively detect and effectively monitor zinc ion because of its wide distribution in human cells and vital roles in human metabolism. Fluorescent probes have been extensively applied in zinc sensing because of the advantages of simple-design, easy-operation, high sensitivity and cell imaging capability. Fluorescent zinc probes are generally constructed based on the mechanisms of photo-induced electron transfer, intra-molecular charge transfer, fluorescence resonance energy transfer, aggregation-induced emission and chelation-enhanced fluorescence. Among these mechanisms, zinc probes constructed on chelation-enhanced fluorescence have the advantages of easy design and synthesis because its fluorophore can simultaneously act as the receptor. In this review, fluorescent zinc probes based on the aforementioned mechanisms, especially, chelation-enhanced fluorescence, reported in recent years are briefly summarized.
锌在人体内的含量仅次于铁,是第二多过渡金属元素;其广泛存在于人体细胞内,在细胞新陈代谢、基因表达、机体免疫和神经传输等活动中起着重要作用[1,2,3,4,5]。 锌浓度的变化往往预示着某些疾病的发生,如锌浓度过高或过低可能导致酶活性失调、基因表达错误、细胞凋亡、神经传递受阻等生理紊乱现象[6,7]。 因此,锌的有效检测和监控对相关疾病的诊断和治疗具有重要意义。 在诸多检测方法中,荧光探针具有廉价易得、操作简单、灵敏度高、可实时监测等诸多优点[8,9,10,11,12,13,14,15,16,17],已广泛应用于锌离子的选择性识别和检测。 依据荧光信号的变化,锌离子荧光探针可分为3大类:荧光猝灭型、荧光增强型和比率型。 荧光猝灭型探针,即探针分子自身荧光较强,与锌离子反应之后,荧光发生猝灭,通过荧光从有到无的过程,检测锌离子的存在。 由于造成荧光猝灭的因素很多,尤其在生物环境中,荧光信号受到的影响更为复杂,锌离子的存在并非荧光猝灭的唯一因素,因此荧光猝灭型探针的特异性与实用性较差[18]。 比率型锌离子荧光探针以两个不同波长处荧光强度的比值作为响应信号以确定锌离子含量,具有自校正的特点,可消除光源强度及仪器灵敏度的影响,有较高的准确性和灵敏度,因此越来越受到人们的关注[19]。 荧光增强型锌离子探针,探针分子自身不发出荧光或自身荧光较弱,与锌离子结合之后,荧光显著增强,通过荧光强度与锌离子浓度的线性关系实现对其定性、定量检测,该类型探针具有较好的特异性与灵敏度,应用较为广泛[20,21,22,23]。
典型的荧光探针通常由3部分组成,即识别基团 (作用基团)、连接基团和荧光团 (信号基团)。其中,识别基团实现探针与检测对象的选择性作用,连接基团将识别基团和荧光团相连接,而信号基团则产生可观察的荧光信号。 目前,文献中已报道多种不同类型的锌离子荧光探针,这些探针对锌离子的识别机理主要包括:光致电子转移(photo-induced electron transfer,PET)、分子内电荷转移(intra-molecular charge transfer,ICT)、荧光共振能量转移(fluorescence resonance energy transfer,FRET)、聚集诱导荧光增强(aggregation-induced emission,AIE)和螯合荧光增强(chelation-enhanced fluorescence,CHEF) 等[24,25,26,27,28]。 其中,相对于其它机理构建的探针,基于螯合荧光增强机理的锌离子探针的识别基团往往可以同时作为信号基团,因此,该类型探针通常具有设计较为简单、合成较为简便的优势[29,30]。 王作辉等[31]已于2013年发表了一篇同名综述,其重点介绍了基于喹啉、荧光素和腙合成的锌离子荧光探针的结构和设计原理,与之不同的是,本文将以文献报道的锌离子为例,介绍基于各类识别机理的锌离子荧光探针及其设计思路,并着重介绍螯合荧光增强机理在发展锌离子探针中的应用。
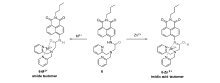
1986年,北爱尔兰女王大学的de Silva教授首次报道了基于冠醚和蒽的PET型荧光探针[32]。 PET作用是设计、构建锌离子探针最常用的识别机理之一,其识别原理为:探针分子与锌离子作用前,其荧光团与识别基团的轨道能级处于匹配状态,当荧光团基态电子受光激发跃迁到激发态时,识别基团上N原子等的孤对电子会转移至荧光团的HOMO轨道,使得荧光团处于激发态的电子无法通过辐射光子的途径回到基态,从而淬灭其荧光;与锌等金属离子作用后,识别基团的轨道能级发生改变,上述电子转移过程无法发生,即PET作用被阻断,从而恢复探针分子荧光。 根据该设计原理,美国麻省理工学院的Lippard教授课题组以二吡啶甲基胺(DPA)为识别基团,荧光素为荧光团,构建了一系列性能优异的PET型锌离子探针[33,34,35,36,37,38,39,40,41]。 这些探针分子具有类似的结构特点,即均以二吡啶甲基胺及其衍生物为识别基团,通过亚甲基将该类基团非共轭地连接在荧光素等荧光团上。 与锌离子作用前,二吡啶甲基胺N原子的孤对电子通过PET作用淬灭探针分子荧光;与锌离子作用后,二吡啶甲基胺与锌离子配位造成其轨道能级升高,PET 作用被阻断,从而产生强的荧光素荧光,从而实现锌离子的选择性识别作用。
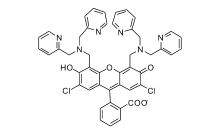
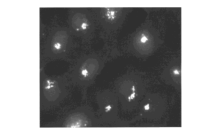
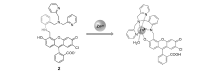
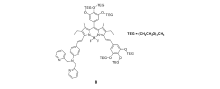
Lippard等[42]首次报道基于荧光素的荧光增强型锌离子荧光探针1(图1)。 由于二吡啶甲基胺到荧光素的PET作用,探针分子本身只有较弱的荧光,与锌离子作用后,PET作用被阻断,探针在530 nm处呈现出明显的荧光增强响应。 同时,它可以成功穿过细胞膜,应用于Cos-7细胞内对锌离子成像(图2)。 此后,为进一步减弱1的背景荧光,同时弥补其易受pH值影响的缺陷,Lippard等[43]设计、合成了探针2(图3)。 相比于探针1,其分子结构主要进行了以下改进:首先,在探针1的识别基团(DPA)和荧光团(荧光素)之间引入苯胺基团,将探针分子的PET电子给体由脂肪胺改变为芳香胺,从而有效降低其pH值敏感性;其次,将探针1的识别基团由2个减少为1个,避免探针对锌离子的识别过程中多步金属配位作用可能造成的分析困难。
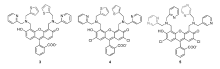
为了进一步改善锌离子识别性能,Lippard等将DPA基团的吡啶分别替换为噻吩和吡嗪,构建了探针3、4[44]和5[34,45](图4)。 相比于探针1和2,含噻吩的探针3、4具有更弱的背景荧光、更大的结合常数、更快的响应速度以及更高的灵敏度等优点。 而含吡嗪的探针5与锌离子以摩尔比1:2形式配位,可通过与锌离子结合后荧光强度的变化定量检测锌离子浓度。 此后,他们又报道了一系列以DPA为识别基团,性能更为优异的PET型锌离子探针[35,36,37,38,39,40,41],不在此一一赘述。
Yoon等[46]报道了以萘酰亚胺为荧光团,酰胺-DPA 为识别基团的 PET 型锌离子荧光探针6(图5)。 该探针分子具有互变异构体,与锌离子及其它金属离子作用后,可以分别得到不同配位形式的产物。 与锌离子作用可得到亚胺配合物,且具有很强的结合能力( Kd=5.7 nmol/L)。 与此相对应,探针溶液的荧光波长从483 nm红移到514 nm;而与其它绝大部分金属离子作用后,则得到酰胺配合物,探针溶液的荧光波长则从483 nm蓝移到446 nm,这样就可以通过配位模式和荧光波长的不同,很好地区分锌离子与其它金属离子。 值得一提的是,二价镉离子具有与锌离子类似的外层电子排布,通常与锌离子具有相似的响应结果,往往对锌离子的识别造成一定干扰[47,48],然而,探针6与二价镉离子作用生成不同于锌的酰胺配合物。 基于该结果,探针6可以很好地实现对锌离子选择性识别。 此外,该探针也可以成功应用于细胞内锌离子的荧光成像(图6)。
 | 图6 探针6在A549细胞中的离子荧光成像照片[46]Fig.6 Fluorescence images of A549 cells incubated with probe 6(5 mol/L) and ions[46]Cells treated with probe 6 (a)in the absence and (b)presence of 1 mol/L external zinc ions. Cells treated with (c)25 μmol/L TPEN after treatment with 6 and 1 μmol/L ZnCl2. (d)Cells treated with 6 and 5 μmol/L CdCl2 and cells treated with 1 μmol/L ZnCl2. (e)after treatment with 6 and 5 μmol/L CdCl2. (f)Cells treated with 6 and 5 μmol/L Fe(ClO4)2 and (g)cells treated with 1 μmol/L ZnCl2 after treatment with 6 and 5 μmol/L Fe(ClO4)2. TPEN, N, N, N', N'-tetrakis(2-pyridylmethyl)ethylenediamine; Scale bar=50 μm |
当共轭分子体系的一端含有吸电子基团如硝基,而另一端含有给电子基团如甲氧基时,分子内的电荷就会因为分子内存在的推拉电子作用而重新分布,这就是分子内电荷转移(ICT)现象,这种现象常见于具有推拉电子效应的有机化合物。 基于ICT机理构建的探针具有易于设计、便于调控等优点。 而且通常情况下,识别前后探针的荧光强度没有明显变化,只是荧光波长发生显著改变,即在不同波长处荧光强度的比率发生显著改变。 这类比率型的荧光变化可以避免测试仪器、激发光强度、探针浓度等外界因素对测试的影响,具有更高的可靠性和准确度。
Jiang等[49]以二甲氨基苯基-呋喃并喹啉为荧光团,DPA为识别基团构建了ICT型锌离子荧光探针7(图7)。 与锌离子作用前,探针分子没有明显的ICT作用,其本身在545 nm处具有明显的荧光;与锌离子作用后,喹啉N原子与锌离子配位,探针分子从二甲氨基苯到呋喃并喹啉具有明显的ICT作用,荧光波长显著红移至620 nm。 探针7也可用于细胞内锌离子的检测。
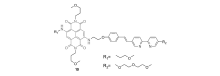
除了基于单一识别机理进行锌离子识别的探针外,还有一些将两种机理相结合的探针。 Akkaya等[50]以BODIPY为荧光团,以DPA为识别基团构建了ICT型锌离子荧光探针8(图8)。 通过在BODIPY母体上引入两个共轭的苯乙烯基,可以显著延长探针的荧光发射波长;再引入多条TEG链,以改善探针的水溶性。 探针分子具有较大的共轭体系,存在从苯乙烯到BODIPY的ICT作用。 同时,DPA识别基团的PET作用从一定程度上淬灭了探针分子自身的荧光。 在EtOH/HEPES缓冲溶液的混合溶剂中,探针分子在730 nm呈现出微弱荧光;与锌离子作用后,探针的PET作用受到抑制,同时其ICT作用减弱,伴随荧光强度的增强。 同时,其发射波长由730 nm蓝移至680 nm,实现探针对锌离子的比率型识别。 这种具有长波长荧光发射,并且识别作用前后波长变化明显的探针在生物体系中有很好的应用前景。
Tian等[51]以萘四酰亚胺为荧光团设计、合成了一种近红外荧光锌离子探针9(图9),其锌离子识别过程结合了ICT和PET作用。 由于PET作用的存在,探针分子9自身几乎没有荧光,与锌离子结合后,PET作用被阻断。 同时,分子中的N1原子与锌离子配位,ICT作用减弱,荧光显著增强,且吸收及荧光光谱均发生蓝移,由此可实现锌离子的识别。
荧光共振能量转移(FRET)即能量从一个荧光团以非辐射的形式转移到另一个荧光团,使其释放出荧光。 其中给出能量的荧光团称为能量给体,接受能量的荧光团称为能量受体。 影响上述能量转移的因素主要包括:能量给体发射光谱和能量受体吸收光谱的重合程度、能量给体与能量受体之间的间隔距离以及能量给体发射偶极矩和能量受体吸收偶极矩的匹配度。 运用FRET机理,可通过以下途径构建锌离子荧光探针:1)利用螯合配位作用延长能量给体的荧光发射波长,使能量给体与受体之间具有良好的光谱匹配度;2)借助探针与锌离子的配位作用,使原本被淬灭荧光的能量给体恢复荧光。 下面将结合文献报道的具体实例加以详细介绍。
Zhu等[52]将萘四酰亚胺和苯乙烯基联吡啶非共轭相连,构建了FRET型锌离子荧光探针10(图10)。 其联吡啶的吸收和荧光发射峰分别位于345和428 nm,萘四酰亚胺的吸收和荧光发射峰分别位于607和638 nm,能量给体联吡啶的荧光发射峰和能量受体萘四酰亚胺的吸收峰之间无明显重叠,无法发生有效的FRET作用。 联吡啶和锌离子作用后,其吸收峰红移至400 nm左右,荧光发射峰则红移至528 nm,与萘四酰亚胺的吸收峰具有一定重叠,满足荧光共振能量转移的要求。 因此,在探针溶液中不断滴加锌离子,并在400 nm处激发,即以能量给体联吡啶锌离子配合物的吸收峰激发时,探针10在630 nm(能量受体萘四酰亚胺的特征荧光发射峰)处的荧光显著增强,最高可达12倍;而在600 nm处激发,即以萘四酰亚胺的吸收峰激发时,随着锌离子浓度的增加,并没有明显的荧光增强变化。 这说明,锌离子的加入可以使能量由联吡啶锌配合物转移至萘四酰亚胺。
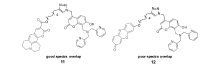
Nam等[53]设计、合成了FRET型锌离子探针11和12(图11)。 两探针均以 4-(二(2-吡啶甲基)胺甲基)羟基香豆素为能量给体,分别以光谱匹配良好的香豆素(coumarin)343和光谱匹配很差的异酚恶唑酮为能量受体。 作者通过二维荧光谱图对探针与锌离子作用前后能量传递与荧光强度进行了详细研究。 对于探针11,锌离子作用前,以香豆素的吸收峰为激发波长(310~380 nm)激发,由于DPA的PET荧光淬灭作用,香豆素没有明显荧光,而coumarin343无法吸收香豆素发射的荧光能量,也不呈现明显荧光;与锌离子作用后,DPA的PET作用被抑制,此时,以310~380 nm波长范围的光激发时,香豆素产生明显荧光,coumarin343的荧光也显著增强。 而对于探针12来说,由于能量给体香豆素和能量受体异酚恶唑酮的光谱匹配很差,加入锌离子前后,以310~380 nm波长范围的光激发,异酚恶唑酮都无法产生明显荧光。
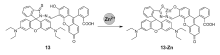
Zhang等[54]以荧光素为能量给体,罗丹明B为能量受体合成了一种基于FRET机理的比率型锌离子荧光探针13。 该探针在与锌离子反应之前,荧光图谱中仅显示出能量供体荧光素的特征发射峰(518 nm),即探针分子自身不发生FRET作用。 而在锌离子作用下,荧光素的螺环结构发生开环,结构转变导致分子内FRET作用的产生,供体荧光减弱,能量受体罗丹明B的荧光发射(590 nm)增强。 该探针分子与锌离子作用前后荧光最大发射波长发生100 nm左右的红移,变化范围较大,可有效降低激发光散射等问题导致的误差。 且探针13对锌离子有较好的选择性,线性范围较宽,为2.0×10-7~2.0×10-5 mol/L,检测限达4.0×10-8 mol/L,且该探针分子成功应用于细胞内锌离子的识别。
唐本忠等提出的AIE机理[55]大大拓展了有机染料在水溶液中的应用空间。 由于具有某些特定结构的有机染料在水中易聚集,并伴随显著的荧光增强效应,使得原本疏水的有机染料同样可以很好地应用于含水溶剂体系。 AIE机理已广泛应用于锌离子荧光探针的构建。
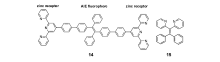
为设计、构建AIE型锌离子探针,最简单的方法是将锌离子识别基团连接到具有AIE特性的荧光团上。 唐本忠等[56]将两个锌离子识别基团三联吡啶通过苯环共轭连接到AIE“明星分子”四苯基乙烯两端,构建了具有AIE性质的锌离子荧光探针14(图13)。 该探针分子在THF溶液中没有明显荧光,而在THF/H2O的混合溶剂体系中则呈现出荧光,并且随着水含量的增加而不断增强,说明该探针具有明显的AIE性质。其溶液与不同金属离子作用时,只有加入锌离子,才会诱使探针分子聚集,荧光显著增强并且红移,因此可用于锌离子的选择性识别。
Pigge等[57]则将四苯基乙烯的两个苯环替换为吡啶,构建了具有AIE性质的锌离子荧光探针15(图13)。 该探针在CH3CN/H2O混合溶剂中的荧光强度随着水含量的增加而不断增强,该结果表明探针分子具有明显的AIE特性。 该探针与锌离子或其它金属离子作用时,只有锌离子可以促使探针产生明显的聚集诱导荧光,由此实现锌离子的选择性识别。
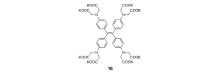
Zhang等[58]则运用四苯基乙烯设计了一种将AIE与PET两种作用相相结合的锌离子荧光探针,他们在四苯基乙烯中4个苯基的对位连接4个 —N(CH2COO—)2 基团作为识别基团,合成锌离子探针16(图14)。 该探针与锌离子以两种方式发生配位,当锌离子浓度较低时,两个—N(CH2COO—)2 基团与锌离子进行分子内配位,分子内旋转被抑制,荧光增强;而当锌离子浓度较高时,邻近的探针分子中的—N(CH2COO—)2基团与锌离子进行分子间配位,形成低聚物或聚合物,并进一步发生聚集,从而荧光显著增强(图15)。
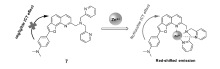
螯合荧光增强(CHEF),自1990年由Czarnik等[59]提出后,便受到人们的广泛关注,大量基于此类作用的锌离子荧光探针相继报道。 基于上述几种机理构建的锌离子探针通常具有荧光探针的典型结构特征,即同时含有识别基团、连接基团和荧光团。 而基于CHEF机理的探针,其识别基团往往可以同时作为荧光团,因此,CHEF型锌离子探针通常具有结构简单,设计、合成简便等优点[60]。 本课题组以吡咯为基本单元,构建了一系列基于CHEF识别机理的荧光增强型锌离子探针。
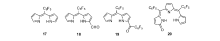
我们课题组[61]报道了基于次甲基二吡咯、三吡咯的CHEF型锌离子探针17~20(图16)。 由于这些探针分子平面性、刚性较差,它们均只有微弱的荧光,与锌离子作用后,由于螯合配位作用,其平面性和刚性得到改善,荧光显著增强。 其中,探针20的荧光增强最为明显,可达72倍。 此外,通过探针分子结构的改变,还可以实现从517 nm到637 nm的荧光响应。 而且探针20成功应用于细胞内锌离子的荧光成像(图17)。
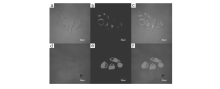 | 图17 KB细胞的共聚焦荧光及亮场照片[61]Fig.17 Confocal fluorescence and bright field images of KB cells[61](a)~(c) cells incubated with 20(10 mmol/L) for 0.5 h at 37 ℃. (d)~(f)Cells pretreated with Zn(AcO)2(20 mmol/L) for 0.5 h then incubated with 20(10 mmol/L) for 0.5 h. (a) and (d):bright field; (b) and (e):fluorescence; (c) and (f):overlay |
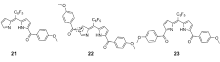
为了进一步提升次甲基二吡咯类探针对锌离子的识别性能,基于上述工作,我们[62]以对甲氧基苯甲酰氯为酰化试剂,进行五氟苯基二吡咯甲烷的酰化反应。 有趣的是,在得到正常的 α-单酰化、 α, α'-双酰化产物的同时,也高产率地得到了 α, β'-双酰化产物。 这3种酰化产物经DDQ氧化后分别得到锌离子探针21、22和23(图18)。 单晶结构显示,3种探针均以2:1的形式与锌离子配位,且配位后均呈现出明显的荧光增强型响应。 值得强调的是, α, β'-双酰化探针23的检测限优于正常取代模式的 α-单酰化探针21和 α, α'-双酰化探针22,可达4.4×10-8 mol/L。 此外,由于取代模式的不同,三者可以实现对锌离子从绿色到红色的荧光响应。
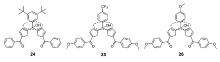
在次甲基二吡咯类锌离子探针研究过程中,我们[63]还意外发现并构建了结构新颖有趣的5位羟基取代的不共轭二吡咯甲烷类锌离子探针24~26(图19)。 由于这类探针分子具有非共轭的二吡咯甲烷结构,其本身没有荧光。 与锌离子作用后,螯合配位作用促使二吡咯甲烷氧化为相应的次甲基二吡咯,并生成摩尔比2:1型锌离子配合物,从而使荧光显著增强。 这样可以大大提高探针分子的信噪比,提升锌离子检测灵敏度。 该工作为构建非共轭、零背景荧光的荧光增强型探针提供了新的思路。
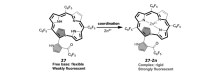
卟啉类化合物荧光波长可达近红外甚至红外区,其在细胞成像应用方面具有独特的优势。 然而,卟啉刚性、平面性好,与金属离子作用后,不易产生明显的荧光增强效应,很大程度上限制了其在锌离子探针领域的实际应用。 为解决这一难题,我们[64]构建了具有较好柔性、结构扭曲的异卟啉27,并将其应用于锌离子识别(图20)。 由于扭曲的构象和很好的柔性,该探针分子本身只有极微弱的荧光。 与锌离子作用后,其平面性和刚性明显改善,荧光显著增强,而且该探针分子的荧光响应波长可达736 nm。
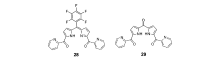
吡啶基团与锌离子具有很强的配位能力,很多性能优异的锌离子识别基团如 DPA、联吡啶、 N, N-二吡啶甲基乙二胺(DPEN)、 N, N, N', N'-四吡啶甲基乙二胺(TPEN) 等均含有吡啶配位单元[65,66,67,68]。 为进一步改善吡咯类探针的锌离子识别性能,我们[69]将吡啶引入次甲基二吡咯平台,构建了锌离子荧光探针28和29(图21)。 借助吡啶与锌离子的辅助配位作用,探针28和29具有很强的锌离子螯合配位作用,在乙腈溶液中,二者对锌离子的检测限可分别达到9.8×10-9和6.3×10-8 mol/L。 同时,通过对次甲基二吡咯5位取代基的改变,可显著调控探针的响应波长,二者分别在621和475 nm处对锌离子呈现出明显的荧光增强响应。 其中,探针28成功应用于细胞内锌离子荧光成像(图22)。
 | 图22 使用荧光共聚焦显微镜拍摄的Hela 活细胞内探针28的锌离子荧光成像照片[69]Fig.22 Confocal fluorescence and bright field images of Hela cells[69](a)~(c)cells incubated with 28(15 μmol/L) for 2 h at 37 ℃. (d)~(f)cells pretreated with Zn(OAc)2(30 μmol/L) for 1 h then incubated with 28(15 μmol/L) for 2 h. (a) and (d):bright field; (b) and (e):fluorescence; (c) and (f):overlay |
Wallace等[70]将两个芘单元分别以邻位和间位方式连接到苯环上,得到两种锌离子探针30和31(图23),探针30与锌离子反应后,荧光增强幅度较小,而探针31则对锌离子表现出较大幅度的荧光增强响应,当以325 nm波长激发时,400 nm处出现较强的荧光发射峰。 分子力学计算结果表明,探针分子30及31中均存在堆积相互作用,且两化合物的堆积作用有所不同,探针30中的一个芘单元插入堆积夹层形成一种三明治型相互作用,而探针31分子因两个芘单元距离较远,没有形成这种三明治型相互作用,所以表现出较强的荧光响应。 探针31中的两个O原子和两个N原子均与锌离子发生配位螯合作用,使荧光显著增强。
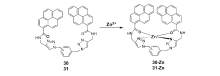 | 图23 探针30和31的化学结构(邻位:30;间位:31)[70]Fig.23 Chemical structures of probes 30 and 31( ortho-isomer:30; meta-isomer:31)[70] |
除了上述常见的几种锌离子识别机理外,基于激发态分子内质子转移(ESIPT)[71,72,73,74]、抑制C=N双键异构化[75,76],以及基于特异性化学反应[77]等不同识别机理的锌离子探针,也均在锌离子的选择性识别中具有广泛应用。 除此之外,还有一些针对特定细胞器中的锌离子进行靶向识别的锌离子探针[78],由于篇幅原因,不再一一详细介绍。
锌离子荧光探针具有价格低廉、设计简单、操作简便、灵敏度高、可实时监控等优点。 可基于光致电子转移(PET)、分子内电荷转移(ICT)、荧光共振能量转移(FRET)、聚集诱导荧光增强(AIE)和螯合荧光增强(CHEF)等多种不同机理设计、构建锌离子荧光探针,实现对锌离子高选择性、高灵敏度以及细胞内检测。 本文结合具体实例,按不同机理简单介绍了锌离子荧光探针的设计、构建与性能。 由于篇幅有限,很多性能优异的探针无法一一介绍。
虽然锌离子荧光探针的研究已取得很多突出的成果,但是还有很多方面需要进一步改进、提高。 例如,与Zn2+外层电子排布相似的Cd2+以及顺磁性的Cu2+对锌离子识别造成的干扰往往较为严重。 通过合理修饰探针分子结构,进一步改善其选择性是今后重要的努力方向。 此外,相当一部分锌离子探针的水溶性不足,或在含水体系中识别效果不佳。 可通过使用水溶性较好的荧光团,引入PEG链等亲水性基团,运用表面活性剂、胶束以及运用AIE机理等途径予以解决。 同时,如何充分运用酞菁、卟啉等长波长荧光团设计、构建具有近红外、红外荧光发射的锌离子探针,拓展其在生物体系中的应用也将是重要研究方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|