为了探讨碧螺春茶叶用于吸附灿烂绿的可能性,研究了碧螺春绿茶吸附灿烂绿的最佳吸附条件及解吸附条件。 研究结果表明,在吸附条件为当溶液起始pH值为4.1,茶叶与灿烂绿质量比为833:1,接触时间为45 min,室温(25±1) ℃时,茶叶对灿烂绿吸附率达80%,吸附量为0.96 mg/g。 对NaOH、CH3COOH和HCl 3种解吸附剂的研究表明,最佳解吸附剂是NaOH,解吸1.5 h解吸率最高达93.20%。 该吸附过程符合Langmuir等温吸附方程,属于单分子层吸附。 吸附过程热力学参数自由能变化Δ G<0,焓变Δ H=102.32 kJ/mol>0,熵变Δ S=0.33 kJ/(mol·K)>0,说明吸附过程是自发的吸热熵增过程。
In order to discuss the possibility of application of Biluochun tea to the adsorption of brilliant green(BG), the optimum adsorption of BG by Biluochun green tea was studied. When the initial solution pH is 4.1, the mass ratio of BG/tea is 833:1, contact time is 45 min and the temperature is (25±1) ℃, the adsorption rate of BG by the tea reaches 80%, and the adsorption capacity is 0.96 mg/g. Studies on three desorption agents, sodium hydorxide, acetic acid, and hydrochloric acid show that sodium hydroxide is the optimal desorption agent and the highest desorption rate reaches 93.20% in 1.5 h. The adsorption process fits the Langmuir isotherm adsorption equation in a single molecular layer adsorption mode. The thermodynamic parameters of adsorption process, free energe change Δ G<0, the enthalpy change Δ H=102.32 kJ/mol>0, the entropy change Δ S=0.33 kJ/(mol·K)>0, indicate that the adsorption process is a spontaneous endothermic process with increasing entropy.
近年来环境污染日益严重,其中纺织工业中含有大量有色染料污染物废水,这些污水可能被人类以饮用水及食物链等形式使用,严重影响到人类健康[1]。 某些染料及中间降解产物对水体生物具有“三致”(致癌、致畸、致突变)作用[2,3,4]。 染料具有分子结构稳定、难生化降解、抗氧化、抗光解、热稳定性强等特点,印染废水难以处理。 处理染料、印染废水方法主要有物理法、化学法、生物法以及此3种方法的组合[5,6,7,8,9,10]。 吸附法是目前国内外应用广泛的方法之一,具有去除水中污染物效率高、速度快、适应性强和易操作等优点。 对于染料、印染废水中的剧毒与难降解的污染物,通过吸附法可以有效地去除,且处理后水质稳定,无二次污染,因此,吸附法在废水处理中仍发挥着不可取代的作用[10]。 活性炭作为一种经典的吸附剂,但由于其价格因素及再生问题,而限制了其实际的应用[10,11]。
我国每年茶叶的产量达110万吨以上,但饮茶后的废茶叶确很少得到利用。 茶叶是一种具有多孔结构的生物质材料,比表面很大,内部多孔且具有复杂的网状结构,使茶叶能与被吸附物质充分接触,进而将其吸附到孔中。 茶叶处理工业废水中的重金属Pb2+ [12]和Ag+ [13]已有报道,但用于染料吸附特别是灿烂绿的吸附未见报道。 灿烂绿(Brilliant Green,BG,亮绿,碱性亮绿,盐基金沙绿)是多环芳烃类染料的一种,属于三苯甲烷类染料,可以用作丝绸、皮革和纸张的染料。 为了克服传统活性炭处理染料废水的缺陷,本文采用茶叶作为吸附材料,吸附碱性染料灿烂绿,研究确立了茶叶对染料BG吸附的最佳条件,确定了溶液酸度、BG溶液初始浓度、接触时间、吸附剂用量、温度等因素对吸附效果影响的最佳条件。 考察了解吸附酸度和解吸附时间对灿烂绿解吸附效果的影响,并研究了茶叶吸附灿烂绿热力学性质。
乙酸、硼酸、磷酸、氢氧化钠和盐酸购自北京化工厂,均为分析纯试剂。吸附物:灿烂绿,其化学结构式见Scheme 1,购自天津市光复精细化工研究所。 染料试剂直接用蒸馏水配制成相应的储备溶液100 mg/L,然后再按照一定比例稀释成所需要浓度的溶液。 吸附剂:市售绿茶,产地为福建省福鼎市知福碧螺春茶,研磨粉碎后通过0.25 mm的筛孔获得一定尺寸的茶末。 称取茶叶0.2000 g置于100 mL烧杯中,加入50 mL水,于100 ℃浸煮3 h,滤纸过滤,茶叶于105 ℃烘箱内烘干24 h,保存在干燥器中备用。
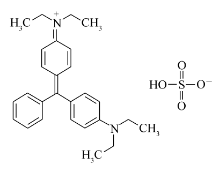 | Scheme 1 Chemical structure of Brilliant Green (relative molecular mass, 482.64; molecular formula, C27H34N2O4S) |
722S型分光光度计(上海棱光技术有限公司),配1 cm比色皿,用于吸光度测量。XL 30 ESEM FEG型扫描电子显微镜(美国FEI公司),样品为乙醇制样,将样品滴在载玻片上进行导电层处理,操作电压为20 kV。 傅里叶变换红外光谱(FT-IR)测量采用德国布鲁克公司生产的Vertex-70型光谱仪,采用KBr压片技术完成,分辨率为4 cm-1,扫描次数为32次,扫描波数范围400~4000 cm-1。 粉末X射线衍射(XRD)实验在D5005型X射线衍射仪(德国西门子公司)仪器上完成测定,Cu- Kα靶, λ=0.1540560 nm,操作电压(管电压)为50 kV,操作电流(管电流)为150 mA。 采用ASAP 2020型(美国Micromeritics Instrument公司)表面与多孔分析仪测定样品BET比表面积。
1.2.1 测定灿烂绿工作曲线的绘制 准确配制2、4、6、8、10、12和15 mg/L的灿烂绿溶液,以蒸馏水为参比,于分光光度计上在灿烂绿的最大吸收波长618 nm处测定显色溶液的吸光度。 以灿烂绿浓度为横坐标,吸光度为纵坐标,绘制出灿烂绿溶液的标准工作曲线。
1.2.2 茶叶对灿烂绿的吸附 称取0.05 g处理后的茶叶放入50 mL锥形瓶中,加入10 mL的6 mg/L浓度的染料灿烂绿溶液和10 mL的pH=4.10三酸(磷酸,硼酸,醋酸)-NaOH缓冲液,在室温(25±1) ℃下以200 r/min的搅拌速度搅拌吸附45 min,在离心机上转速为6000 r/min条件下离心10 min,然后在最大吸收波长618 nm处测定上清液中染料的吸光度,根据标准工作曲线计算吸附后染料的浓度。
染料灿烂绿的吸附量计算公式:
式中, ρ0和 ρt分别为吸附前和吸附后溶液中染料的浓度(mg/L), q为吸附量(mg/g), V为溶液体积(mL); m为载体质量(g)。
1.2.3 灿烂绿的解吸附 精确称取0.05 g处理过的茶叶置于10 mL浓度为6 mg/L的灿烂绿标准溶液中,加入10 mL缓冲溶液调节pH值为4.10,在室温下搅拌吸附45 min。 过滤,用去离子水洗涤过滤所得到的固体产物,于室温下自然干燥,制得的样品记为试样A。 取20 mL的0.1 mol/L NaOH或(HCl,CH3COOH)解吸附剂共6份,然后精确称取6份0.0500 g上述试样A,室温下分别放于上述解吸附剂中搅拌10 min、30 min、45 min、1 h、1.5 h和2 h。 过滤,保留滤液,用分光光度法测定其中的灿烂绿含量。
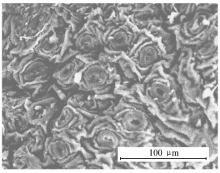
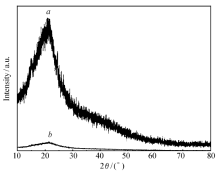
茶叶扫描电子显微镜照片(图1)清晰地反映出样品的形貌和尺寸。 可以看出,茶叶的表面粗糙、凹凸不平,有很多空穴,单个空穴的形状为面包圈状,其平均直径约为39 μm,这些空穴有利于茶叶吸附灿烂绿。 从样品的红外图(图2)可以看出,在沸水中煮不同时间后茶叶的红外吸收峰与未煮茶叶相比基本不变,说明沸水蒸煮后并未破坏茶叶的内部结构。 吸附染料之后茶叶骨架的振动频率基本不变,只是强度变弱,说明染料分子主要进入了茶叶内部孔道内。 吸附染料前后茶叶的XRD图衍射峰的位置未发生改变(图3),只是衍射峰强度有所下降,说明吸附染料后茶叶的骨架结构没有被破坏,但茶叶的结构排列有序度下降。茶叶吸附染料灿烂绿后,其比表面积由450.13 m2/g降低到431.31 m2/g。
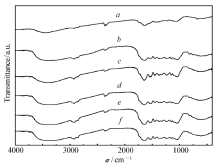 | 图2 经过处理的茶叶的红外谱图Fig.2 Infrared spectra of teas after BG adsorption( a), boiled in boiling water for 0( b), 30( c), 60( d), 120( e) and 180( f) minutes |
酸度影响实验在pH值1.0、3.0、3.3、4.1、4.6、5.0、6.1、7.0、9.0和10.4条件下进行,当pH值在3.3~4.6时吸附量较高;在pH值在4.1时吸附量最高。 pH值过低时茶叶中所含基团优先接受来自溶液中的H+生成正电活性中心,并且H+进一步与茶叶中C=O的O原子上的孤对电子形成络合,阻碍了带有正电荷的染料阳离子与其配位和络合,所以此时对染料分子的吸附量降低。 pH值较高时,溶液中OH-浓度较大,与带有正电荷的染料阳离子结合,阻碍与茶叶的吸附。 接触时间对吸附量的影响结果说明在0~45 min内,茶叶吸附量随接触时间的增加而增大,45~55 min内,吸附量基本不变,说明吸附达到了平衡状态。 茶叶用量对吸附效果的影响结果说明茶叶用量在0~0.05 g时,随着茶叶投加量的增加,吸附量逐渐增大,茶叶用量在0.05~0.30 g范围内,随着茶叶投加量的增加,吸附量逐渐降低。 这可能是因为溶液中的染料分子浓度一定,茶叶用量为0.05 g时吸附已经达到饱和,继续投加吸附剂也没有染料分子再被吸附。 灿烂绿浓度影响实验结果说明,随着灿烂绿初始浓度的增加,茶叶对灿烂绿的吸附量逐渐增加。 当初始浓度大于3 mg/L时,茶叶的吸附容量基本保持不变,说明达到了吸附饱和。 考察了4、25、35和45 ℃实验温度对灿烂绿吸附效果的影响,结果说明,随温度的升高,茶叶吸附量逐渐增加,可能是由于加热导致茶叶内部纤维发生溶涨作用,而且温度升高使吸附反应速度加快,说明该吸附过程为吸热过程。为了节省能耗,实验采用室温(25±1) ℃。
由以上得出最佳溶液pH值为4.1,当吸附剂用量为2.5 g/L, m(茶叶): m(灿烂绿)=833:1,吸附时间45 min,室温(25±1) ℃下,吸附达到饱和。 在上述最佳条件下,计算可得茶叶对灿烂绿的最大吸附量为0.96 mg/g,灿烂绿染料的去除率达80%。 生物吸附是生物材料和其它物质发生的一系列非发酵关联的吸附过程[14],其主要作用包括物理、化学吸附、静电作用、离子交换、络合、螯合和微量沉淀等过程,茶叶吸附灿烂绿的过程是以上共同作用的结果。
分别研究了3种解吸附剂NaOH、HCl、CH3COOH对茶叶吸附灿烂绿复合材料的解吸附影响,结果说明,用NaOH溶液作为解吸附剂时,解吸附率随解吸时间增加而增加,在90 min可达到最大值93.20%,而CH3COOH溶液和HCl溶液作解吸附剂时解附率较低,在90 min解吸附达到平衡时,解吸附率分别为51.1%和41.8%。
在不同温度条件下,考察不同初始浓度时茶叶对灿烂绿染料的平衡吸附量,并将实验数据进行Langmuir和Freundlich等温吸附方程拟合。
Langmuir等温吸附方程如下[15]:
式中, ρ为吸附平衡质量浓度(mg/L); q为平衡吸附量(mg/g); qm为最大饱和吸附量(mg/g); k为吸附平衡常数。 通过 ρ/q对 ρ作图,进行数据拟合处理,拟合结果见图4所示。
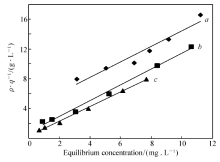 | 图4 Langmuir吸附等温方程拟合Fig.4 Langmuir adsorption isotherm equation fitting a.298.15 K; b.308.15 K; c.318.15 K |
Freundlich等温吸附方程如下[16]:
式中, q为平衡吸附量(mg/g); k和 n均为等温方程常数。 lg q对lg ρ作图进行数据拟合处理,拟合结果见图5所示。
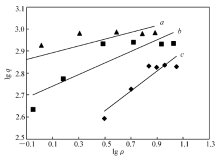 | 图5 Freundlieh吸附等温方程拟合Fig.5 Freundlieh adsorption isotherm equation fitting a.298.15 K; b.308.15 K; c.318.15 K |
由图4和图5可见,Langmuir吸附等温方程拟合效果较好,线性拟合方程的相应参数见表1。 由表1
| 表1 不同温度的吸附等温方程拟合参数 Table 1 Adsorption isotherm equation fitting parameters of different temperatures |
可见,通过Langmuir和Freundiich等温吸附方程线性拟合结果,Langmuir等温吸附方程拟合效果较好,拟合的线性相关系数 R均大于0.97,理论的最大饱和吸附量 qm与实验值 q相近,说明根据单分子层吸附模型建立Langmuir等温吸附方程能很好地表示该吸附过程,该吸附属于单分子层吸附。 随着温度的升高,单分子层饱和吸附量整体上逐渐增加,吸附平衡常数也随之增大,说明茶叶对灿烂绿吸附属吸热反应,提高温度有利于反应的进行。
吸附过程中的标准吉布斯自由能变化Δ G可以用以下公式计算:
式中, K为吸附平衡常数(Langmuir方程中的参数 K), T为热力学温度(K),吸附过程的标准焓变和标准熵变根据van't Hoff方程求出:
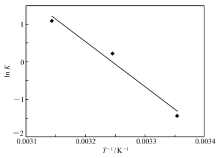
通过ln K对1 /T作图(图6),方法的线性回归方程为ln K=39.052-12037 T-1,回归系数为 R2=0.97,根据直线的斜率和截距计算出吸附过程的标准焓变Δ H和标准熵变Δ S,结果见表2。 由表2可知,吸附焓变Δ H为正值,表明吸附过程是吸热反应,这也证实了茶叶对灿烂绿的吸附随着温度的升高而增加,升高温度有利于吸附的进行,3种温度下的吉布斯自由能变化Δ G均小于零,而且温度越高,Δ G越小,表明茶叶对灿烂绿的吸附过程是一个自发的过程,且温度越高自发程度越大。其值的大小还反映吸附过程推动力的大小,Δ G的绝对值越大,吸附推动力越大,实验数据表明温度较高时,吸附推动力大。 Δ S为正值说明吸附质的自由度也增加了,吸附是熵驱动过程。 通常物理吸附的自由能在-20~0 kJ/mol之间,-20~-80 kJ/mol为物理化学吸附,而化学吸附的自由能在-400~80 kJ/mol之间[17],本研究中Δ G0在-36.97 kJ/mol到-30.69 kJ/mol间,因此,可认为茶叶吸附灿烂绿是受物理化学吸附驱动的。
| 表2 不同温度下吸附热力学参数 Table 2 Adsorption thermodynamic parameters of different temperatures |
本文以茶叶作为新的生物吸附剂,研究了茶叶对灿烂绿染料的最佳吸附及解吸附条件、吸附等温线方程及热力学性质。 吸附热力学研究表明,茶叶对灿烂绿的吸附符合Langmuir等温吸附方程,属于单分子吸附。 吸附过程是自发的吸热过程。 茶叶吸附灿烂绿是受物理化学吸附驱动的。 室温(25±1) ℃下,当吸附剂用量为2.5 g/L, m(茶叶): m(灿烂绿)=833:1,最佳溶液起始pH值为4.1,吸附时间45 min,吸附达到饱和。 在上述最佳条件下,茶叶对灿烂绿的最大吸附量为0.96 mg/g,吸附率达到80%。 对NaOH、CH3COOH和HCl 3种解吸附剂的研究表明,最佳解吸附剂是NaOH,解吸附1.5 h,解吸率达到了93.20%。茶叶在我国来源丰富,产量巨大,本研究对环境保护及开拓废茶叶的利用,具有广阔的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|