可控制备具有多样化结构和组分的功能微纤维材料对于其创制和应用具有重要意义。 本文主要介绍了利用微流控技术可控产生具有多样化结构的喷射液流作为模板,从而可控制备具有实心、中空、腔室以及螺旋型结构的功能微纤维材料的研究新进展,以期为新型功能微纤维材料的创新设计和可控制备提供科学指导。
Controllable fabrication of functional microfibers with diverse structures and compositions are important for their innovation and application. This review summarizes the recent progress on controllable fabrication of functional microfibers with solid, hollow, compartmental, and helical structures from diverse jet templates generated by microfluidics, and hopes to provide scientific guidelines for the design and controllable fabrication of novel functional microfibers.
功能微纤维材料在物质封装[1,2]、控制释放[3,4]、组织工程[2,5,6]、催化反应[7,8,9]、物质分离[10,11,12]、可穿戴设备[13,14]、传感检测[15,16,17]和仿生集水[18,19,20]等方面具有巨大的应用前景,已成为国际上多学科领域的研究热点。 可控制备具有多样化结构和组分的功能微纤维材料对于其创制和应用具有重要的意义。 相比于传统的制备方法,如静电纺丝法[21]、熔融纺丝法[22]、湿法纺丝法等[23],近年来快速兴起的微流控技术,由于其可精确操控微通道内微尺度液体的流动[24,25,26,27],因此可以可控地构建出多样化的液流模板,以用于制备具有多样化形态、结构、组成和功能的微纤维材料[28],展现出了其它技术所不具备的独特优越性。
利用微流控技术对于微尺度流体流动的精确调控特性以及微通道内流体的层流流动特性,通常可通过用一种液相在微通道内同轴聚焦剪切作用于另一种液相,以使之形成喷射液流模板。 一方面,通过在形成喷射液流模板的液相中溶解、分散不同的纤维基材和功能材料,可以进一步通过基于紫外光照的聚合反应[29,30]、基于界面传质的交联反应[20,31]以及基于溶剂交换的沉积固化[1,32]等化学物理过程,由喷射液流模板制备得到多样化的实心功能微纤维;另一方面,通过在微流控装置中设计和构建具有不同流通横截面形状的微通道,并结合快速反应固化过程,可以对喷射液流模板的横截面形状及所得到的功能微纤维的横截面形状进行精确控制,从而制备得到具有非圆形横截面结构的功能微纤维材料;此外,基于微流控装置优良的可升级特性,通过嵌套或并列组合多个微通道,可以在喷射液流模板中灵活引入具有多样化组分和结构的内部液滴或者液流,制备得到具有多样化结构的功能微纤维,从而极大地丰富拓展其结构和功能。 因此,微流控液流模板法为创新设计和可控制备具有多样化结构和功能的微纤维材料提供了一个优良的平台。
本文主要介绍了近年来通过微流控液流模板法设计和构建新型功能微纤维材料的研究新进展,着重介绍了利用微流控技术可控产生具有多样化结构的喷射液流作为模板,可控制备具有实心、中空、腔室、以及螺旋型结构的功能微纤维的研究进展,以期为新型功能微纤维材料的创新设计和可控制备提供科学指导。
通常,微流控技术制备实心功能微纤维主要是利用一种液相同轴聚焦剪切作用于另一种液相,使之形成具有圆形横截面结构的柱状喷射液流模板;随后,利用快速地聚合、交联或固化过程使得液流模板在微流控装置中“在线”转化为实心功能微纤维材料。 同时,通过在液流模板中溶解或者分散有机、无机功能材料,可以灵活地对微纤维进行多样化的功能修饰。 此外,微流控技术温和的剪切条件亦有利于在液流模板中封装敏感物质如蛋白质、细胞等,以实现其在微纤维中的有效封装。
Jeong等[29]通过将玻璃管结合到聚二甲基硅氧烷(PDMS)基材中形成同轴毛细管微流控通道,并以含有丙烯酸酯类单体和光引发剂的油相为内相,使其在外部水相的同轴聚焦剪切作用下形成柱状喷射液流模板;随后,由紫外光照引发微通道中流动的液流模板中的单体聚合,从而“在线”连续地产生丙烯酸酯类微纤维(如图1(a)所示)。 Zhang等[33]以含有海藻酸钠的水相为内相构建柱状喷射液流模板,并通过外部水相中的Ca2+扩散到液流模板中,使得海藻酸发生快速交联形成微纤维;同时,在柱状喷射液流模板中引入化学反应,从而在微纤维产生过程中生成纳米晶体颗粒,制得了装载有多样化组分纳米晶体颗粒的海藻酸钙微纤维(如图1(b)所示)。 相似地,Wu等[34]以含有四臂-聚乙二醇-马来酰亚胺(PEG-4Mal)预聚体和细胞的水溶液作为内相、含有二硫苏糖醇的水溶液作为外相构建柱状喷射液流模板,通过外部水相中的二硫苏糖醇扩散到液流模板中与PEG-4Mal发生快速交联,从而制得了包埋有细胞的实心柱状PEG-4Mal微纤维用于细胞培养。 类似地,Shin等[35]通过在含有海藻酸钠的水相中加入细胞,并以此为内相,构建出柱状喷射液流模板,制得了实心柱状海藻酸钙微纤维,用于细胞的封装和培养。 而Hwang等[2]以含有聚乳酸-羟基乙酸共聚物(PLGA)的二甲基亚砜溶液为内部油相构建柱状喷射液流模板,然后通过溶剂交换使二甲基亚砜扩散到外部水相中以使得PLGA快速沉积固化,从而制得了实心柱状PLGA微纤维用于蛋白质包埋和组织工程(如图1(c)所示)。 上述微纤维的直径大小均可以通过调节液流模板产生过程中的内、外相液体的流速进行精确调控。 此外,通过采用并列紧靠的两个或多个玻璃毛细管微通道用于注射内相溶液,可以制备得到具有不同组分的“ θ型”或“花瓣型”横截面的实心功能微纤维(如图1(d)所示)[36,37]。 而通过利用微通道中的气阀来控制内相溶液的流动与停止,再结合脉冲式的紫外光照聚合,还可以进一步地调控微纤维段的长度[38]。
 | 图1 微流控液流模板法可控制备实心功能微纤维。(a)同轴毛细管微流控装置制备海藻酸钙微纤维的示意图[29];(b)内含纳米晶体颗粒的海藻酸钙微纤维的荧光显微镜图像[33];(c)PLGA微纤维用于细胞生长的荧光显微镜图像[2];(d)具有不同组分横截面的海藻酸钙微纤维的荧光显微镜图像[37]。 (c)中标尺为50 μm,(d)中左图和右图标尺分别为50 μm和100μmFig.1 Controllable fabrication of solid functional microfibers from microfluidic jet templates. (a)Schematic diagram of co-flow microfluidic device for fabricating calcium alginate microfibers[29]. (b)Fluorescent microscope image of calcium alginate microfibers containing nanocrystals[33]. (c)Fluorescent microscope image ofPLGA microfibers for cell culture[2]. (d)Fluorescent microscope images ofcalcium alginate microfibers with cross-section of different compositions[37]. Scale bars are 50 μm in (c), and 50 μm and 100 μm respectively in the left and right images in (d) |
除了具有圆形横截面的柱状实心微纤维外,基于微流控技术对于层流液流流动的精确控制性能,通过设计调节微流控装置中供内部液相流动的微通道横截面形状,还可以制备具有多样化的非圆形横截面的实心功能微纤维[6,39,40]。 Kang等[6]通过利用具有锯齿状流通横截面的微通道,制备得到了具有多个并列沟槽结构的带状海藻酸钙微纤维用于细胞培养(如图2(a),2(b)所示),其并列沟槽结构具有良好的引导细胞定向生长的特性。 此外,通过调控三相液相之间的界面能量以调控其两两之间的浸润行为,亦可以制备得到具有非圆形横截面的实心微纤维。 Choi等[30]则利用互不相溶的三相在微通道中构建出由其中两液相组成的柱状喷射液流模板,通过调控三相之间的界面张力使得液流模板中两液相的浸润行为发生变化,从而可以由紫外光照“在线”制备得到了具有不同月牙形横截面的实心聚乙二醇二丙烯酸酯(PEG-DA)微纤维(如图2(c)所示)。
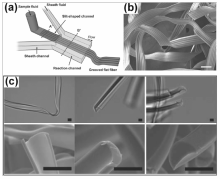 | 图2 微流控液流模板法可控制备具有非圆形横截面的实心功能微纤维。 (a,b)微流控装置制备具有沟槽结构的带状海藻酸钙微纤维的示意图(a)及微纤维的SEM照片(b)[6];(c)具有不同月牙形横截面的聚乙二醇二丙烯酸酯微纤维的光学显微镜图及对应的SEM照片[30]。 (b)中标尺为100 μm,(c)中标尺为50 μmFig.2 Controllable fabrication of solid functional microfibers with noncircular cross-sections from microfluidic jet templates. (a,b)Schematic diagram of microfluidic device for fabricating belt-like calcium alginate microfibers with grooves(a) and SEM image of the microfibers(b)[6]. (c)Optical micrographsand SEM images of PEG-DA microfibers with different crescent cross-sections[30]. Scale bars are 100 μm in (b) and 50 μm in (c) |
微流控技术制备中空型功能微纤维材料,主要是在柱状喷射液流的基础上,通过在喷射液流中引入第3种液相以构建一个内部柱状喷射液流,从而形成三相套管状喷射液流模板。 而通过将该套管状喷射液流模板中的中间液相聚合固化,则可以制备得到具有可控中空结构的功能微纤维。
Wen等[1]以含有熔融的相变材料石蜡作为内相、含有聚乙烯醇缩丁醛(PVB)的二甲基亚砜溶液作为中间相以及含有羧甲基纤维素钠的水溶液作为外相,制得了套管状喷射液流作为模板(如图3(a)所示)。 通过中间相中二甲基亚砜扩散到外部水相中使得PVB快速沉积固化,从而制得了封装有石蜡的PVB相变微纤维用于温度的调控(如图3(b),3(c)所示)。 Deng等[32]以含有聚醚砜的 N, N-二甲基乙酰胺溶液作为中间相构建套管状喷射液流模板,通过溶剂交换使得聚醚砜快速沉积固化,制得了中空聚醚砜微纤维。 类似地,Lan等[41,42]以含有聚丙烯腈、聚砜、聚醚砜和聚苯乙烯的 N, N-二甲基甲酰胺溶液作为中间相构建套管状喷射液流模板,通过溶剂交换法制得了具有中空结构的聚丙烯腈、聚砜、聚醚砜和聚苯乙烯微纤维,并将中空聚醚砜微纤维作为离子液体的载体用于二氧化碳和氮气分离[42]。 Jiang等[4]以含有PLGA和聚( N-异丙基丙烯酰胺-共聚-丙烯酰胺苯并15冠5)凝胶纳米颗粒的 N-甲基吡咯烷酮溶液作为中间相构建套管状喷射液流作为模板,由溶剂交换过程使PLGA快速沉积固化,制得了管壁包埋有凝胶纳米颗粒的中空PLGA微纤维(如图3(d),3(e)所示)。 其管壁中的聚( N-异丙基丙烯酰胺-共聚-丙烯酰胺苯并15冠5)凝胶纳米颗粒可以响应环境中K+的浓度变化而发生相应的体积溶胀/收缩,从而控制微纤维管壁的渗透性,实现对中空微纤维中封装物质的控制释放。 Meng等[43]利用全部为水溶液的四相套管状喷射液流作为模板,通过在含有海藻酸钠的中间水相和含有Ca2+的外部水相之间加入一层缓冲水相液层以控制Ca2+扩散到中间水相的速率,有效解决了微纤维制备过程中由于快速交联反应易引起微通道堵塞的问题,连续制备得到了中空海藻酸钙微纤维用于细胞培养。 上述中空功能微纤维的外直径、中空通道的直径、以及微纤维壁的厚度等均可以通过调节三相液体的流速进行精确调控。 例如,Jiang等[4]在制备中空PLGA微纤维的过程中,通过将中间相流速固定在200 μL/min,随着外相流速由250 μL/min升高至550 μL/min,中空通道的直径以及中空微纤维的外直径分别减少了13.3%和15.2%;而当外相流速固定在250 μL/min,随着中间相流速由100 μL/min升高至200 μL/min,中空通道的直径以及中空微纤维的外直径分别减少了6.1%和3.7%。 此外,由于中空微纤维壁的厚度通常可定义为中空微纤维外直径与中空通道直径之差的二分之一,因此,通过流速调节不但可以调控中空通道的直径以及中空微纤维的外直径,还可以调控微纤维壁的厚度。
 | 图3 微流控液流模板法可控制备中空功能微纤维。 (a~c)微流控装置产生套管状喷射液流以制备内含石蜡的中空聚乙烯醇缩丁醛微纤维的示意图(a)及微纤维的光学显微镜图(b)和SEM照片(c)[1];(d,e)管壁包埋有荧光标记的聚( N-异丙基丙烯酰胺-共聚-丙烯酰胺苯并15冠5)凝胶纳米颗粒的PLGA中空微纤维(d)及其断面(e)的荧光显微镜图[4]。 (c,e)中标尺为100 μm,(d)中标尺为200 μmFig.3 Controllable fabrication of hollow functional microfibers from microfluidic jet templates. (a~c)Schematic diagram of microfluidic generation of tube-in-tube jets for fabricating hollow PVB microfibers containing paraffin (a), and optical micrograph(b) and SEM image (c) of the microfibers[1]. (d,e)Fluorescent microscope images of hollow PLGA microfibers with walls containing fluorescent poly( N-isopropylacrylamide- co-acryloylamidobenzo-15-crown-5) nanogels(d) and the cross-section of the microfibers(e)[4]. Scale bars are 100 μm in (c,e) and 200 μm in (d) |
进一步,基于微流控装置良好的可升级特性,Yu等[44]通过在PDMS微流控装置中构建多个并列的微通道用于注射内相溶液,可控构建得到了柱状喷射液流模板中含有两个或多个柱状喷射液流的模板,从而制备得到了具有相应的中空通道数目的海藻酸钙微纤维(如图4(a)~4(c)所示)。相似地,Cheng等[36,45]通过采用并列的两个或多个玻璃毛细管微通道用于注射内相溶液,亦可控制备得到了具有相应的中空通道数目的海藻酸钙微纤维。 继而,当采用多个“微通道嵌套微通道”结构用于注射不同组分的中间液相时,还可以构建具有多层嵌套式柱状结构的多相喷射液流模板,并由此制备得到具有多层不同组分的“嵌套式”管壁的海藻酸钙中空微纤维(如图4(d)所示)[36]。 而通过在微流控装置中使用多个以环状形式并列排列的“微通道嵌套微通道”结构用于注射中间液相时,还可以制得具有多种不同组分的“花瓣式”管壁且具有单个或多个中空通道数目的海藻酸钙微纤维用于组织工程(如图4(e),4(f)所示)[36,44,45]。
 | 图4 微流控液流模板法可控制备具有多个中空通道的功能微纤维。(a~c)微流控装置制备内含一(a)、三(b)、五(c)个中空通道的海藻酸钙微纤维的光学显微镜图和荧光显微镜图[44];(d)具有多层不同组分管壁的海藻酸钙中空微纤维的示意图和荧光显微镜图[36];(e,f)具有多种不同组分“花瓣式”管壁、且具有单个(e)[36]或3个(f)中空通道的海藻酸钙微纤维的示意图和荧光显微镜图[45]。(a~c)中左图和右图标尺分别为500 μm和100 μm,(d~f)中标尺为200 μmFig.4 Controllable fabrication of functional microfibers containing multiple hollow channels from microfluidic jet templates. (a~c)Schematic diagram of microfluidic device for fabricatingcalcium alginate microfibers containing one(a), three(b), and five(c) hollow channels, and their fluorescent microscope images[44]. (d)Schematic diagram and fluorescent microscope image of hollow calcium alginate microfibers consisting of multilayered walls with different compositions[36]. (e,f)Schematic diagrams and fluorescent microscope imagesof calcium alginate microfibers containing one(e)[36] and three(f) hollow channels[45], and heterogeneous walls with three different compositions.Scale bars are 500 μm and 100 μm respectively in the left and right images in (a~c), and 200 μm in (d~f) |
微流控技术制备腔室型功能微纤维主要是通过在喷射柱状液流中引入互不相溶的液相,使其被剪切形成离散的液滴,从而构建内含分散液滴的柱状液流作为模板,以制备得到以离散液滴作为内部腔室的腔室型功能微纤维。
He等[31]利用玻璃毛细管微流控装置构建出内含单分散油滴的喷射液流模板,通过在喷射液流模板液相中加入壳聚糖,并由外部水相中的戊二醛扩散进入液流模板与壳聚糖发生快速交联,制备得到了内部有分隔的油滴腔室的腔室型壳聚糖微纤维(如图5(a)所示)。 基于该微纤维的亲水性壳聚糖水凝胶壳层和内部封装的亲油性油滴腔室,可以用于协同封装亲水性和疏水性的功能活性物质(如图5(b)所示)。 类似地,Sun等[46]利用PDMS微流控装置构建内含矿物油油滴的海藻酸钠水相喷射液流模板,制得了内含均匀油核的腔室型海藻酸钙微纤维(如图5(c)所示)。 进一步,Um等[47]通过在腔室型海藻酸钙微纤维的内部油核封装包埋有细胞的海藻酸钙微球,实现了对细胞的封装以用于细胞培养(如图5(d)所示)。 通过调控各相流速,可以对腔室型微纤维的直径、内含液滴的尺寸、液滴间的间隔距离等进行精确的调控。
 | 图5 微流控液流模板法可控制备腔室型功能微纤维。 (a,b)同轴微流控装置制备内含油核的壳聚糖微纤维的示意图(a)及该微纤维用于亲水药物和疏水药物协同封装的光学显微镜图(b)[31];(c)腔室型海藻酸钙微纤维的光学显微镜图[46];(d)内部油核封装包埋有细胞的海藻酸钙微球的海藻酸钙微纤维用于细胞培养的荧光显微镜图[47];(e)具有"竹节状"结构的腔室型海藻酸钙微纤维的荧光显微镜图[48];(f~h)具有磁性纺锤体状节点的仿蜘蛛丝海藻酸钙微纤维在外加磁场作用下组装为网状结构的示意图(f)及该微纤维在水分收集前(g)、后(h)的光学显微镜图[20]。 (b)中标尺为500 μm,(c,g,h)中标尺为1 mm,(d,e)中标尺为100 μmFig.5 Controllable fabrication of compartmental functional microfibers from microfluidic jet templates. (a,b)Schematic diagram of co-flow microfluidic devicefor fabricating chitosan microfibers containing oil cores(a) and fluorescent microscope imageof the microfibers for synergistic encapsulation of hydrophilic and hydrophobic drugs(b)[31]. (c)Optical micrograph of compartmental calcium alginate microfibers[46]. (d)Fluorescent microscope imageofcalcium alginate microfibers containing oil cores encapsulated with cell-loaded calcium alginate microspheres for cell culture[47]. (e)Fluorescent microscope imageofbamboo-like compartmental calcium alginate microfibers[48]. (f~h)Schematic diagram of magnetic assembly of spider-silk-like calcium alginate microfibers with magnetic spindle-knots(f), and optical micrographs of the assembled microfibers before(g) and after(h) water collection[20]. Scale bars are 500 μm(b), 1 mm in (c,g,h), and 100 μm in (d,e) |
此外,通过固化腔室型微纤维内部的油核并干燥微纤维的水凝胶网络结构,还可以进一步构建具有独特结构如“蜘蛛丝状”或“竹节状”结构的腔室型功能微纤维。 Yu等[48]通过在腔室型海藻酸钙微纤维内含的碳酸二甲酯油滴内加入PLGA,由碳酸二甲酯溶剂挥发得到PLGA固体微球,再经过海藻酸钙微纤维干燥,得到了具有“竹节状”结构的腔室型海藻酸钙微纤维(如图5(e)所示)。 进一步,通过利用微通道中结合的气阀的“开-关”频率和顺序控制两个微通道中不同组分液滴的产生频率和顺序,还可以精确控制海藻酸钙微纤维中不同组分液滴的排列顺序,以调控其内部结构用于编码等用途。 He等[20]通过在腔室型海藻酸钙微纤维内含的乙酸正丁酯油滴内加入磁性纳米颗粒和聚苯乙烯,由乙酸正丁酯挥发使得磁性纳米颗粒和聚苯乙烯沉积形成磁性固体颗粒,再经过海藻酸钙微纤维进一步脱水干燥后,得到了磁性仿蜘蛛丝海藻酸钙微纤维。 该微纤维内部周期性分布的磁性固体颗粒形成了磁性的纺锤体状节点,当外加磁场作用于磁性纺锤体状节点时,微纤维可以组装为仿蜘蛛网结构,并从水雾中收集水分(如图5(f)~5(h)所示)。
微流控技术制备螺旋型功能微纤维主要是通过调控喷射液流模板和外部液相之间的流速和粘度差、以及微通道的结构尺寸等条件,从而使得液流发生弯曲螺旋缠绕,并以得到的螺旋型液流作为模板制备相应的螺旋型功能微纤维。 通过利用具有不同内部结构的液流构建螺旋型液流模板,还可以对所得到的螺旋型功能微纤维的内部结构和功能进行灵活设计和修饰。
Tottori等[49]在微流控装置中利用含有海藻酸钠和柠檬酸钠的水溶液作为内相,含有聚乙二醇和Ca2+的水溶液作为外相,通过调控两液相粘度、流速、微通道结构尺寸等条件,构建了具有螺旋结构的液流模板,并由快速交联反应进而制备得到了螺旋型的海藻酸钙功能微纤维(如图6(a)所示)。 而Zhu等[50]利用含有经甲基丙烯酸缩水甘油酯修饰的葡聚糖(GMA-dex)的水溶液作为内相、含聚乙二醇400的水溶液作为外相,构建了具有螺旋结构的液流模板,并由此制得了螺旋型的GMA-dex功能微纤维(如图6(b),6(c)所示)。 研究发现,通过调控两液相的流速、黏度、以及微通道的结构尺寸,可以对螺旋型微纤维的结构如螺距、微纤维直径以及其折叠缠绕的程度等进行精确的调控。 进一步,Yu等[15]通过使用并列紧靠的2个或3个微通道用于注射不同组分的内相溶液,制备了具有不同组分的“ θ型”和“花瓣形”横截面结构的螺旋型海藻酸钙微纤维(如图6(d),6(e)所示);而通过采用分开的两个并列微通道用于注射不同组分的内相溶液,可以制备得到具有类似DNA双螺旋结构的螺旋缠绕型海藻酸钙微纤维(如图6(f)所示)。 此外,其通过采用“微通道嵌套微通道”结构在海藻酸钠内相液流内部注射另一种液相,还进一步制备得到了具有中空结构(如图6(f)所示)和核壳型结构(如图6(g)所示)的螺旋型海藻酸钙微纤维。 通过将该螺旋型微纤维一端固定,而另一端连接到附着有心肌细胞的薄膜上,其可作为类似于微弹簧的机械传感器用于感应心肌细胞的跳动[15]。
 | 图6 微流控液流模板法可控制备螺旋型功能微纤维。 (a)同轴微流控装置制备螺旋型海藻酸钙微纤维的示意图[49];(b,c)螺旋型GMA-dex功能微纤维的荧光显微镜图(b)和光学显微镜图(c)[50];(d,e)横截面具有两种(d)和3种(e)不同组分的螺旋形海藻酸钙微纤维的示意图和荧光显微镜图[15];(f)双螺旋型海藻酸钙微纤维的示意图和荧光显微镜图[15];(g,h)具有中空结构(g)和核壳型结构(h)的螺旋型海藻酸钙微纤维示意图和荧光显微镜图[15]。 (b,c)中标尺为200 μm, (d~h)中标尺为100 μmFig.6 Controllable fabrication of helical functional microfibers from microfluidic jet templates. (a)Schematic diagrams of co-flow microfluidic device for fabricating helical calcium alginate microfibers[49]. (b,c)Fluorescent microscope image(b) and optical micrograph(c) of helical GMA-dex microfibers[50]. (d,e)Schematic diagrams andfluorescent microscope images of helical calcium alginate microfibers with cross-sections showing two(d) and three(e) different compositions[15]. (f)Schematic diagram andfluorescent microscope image of double-helical calcium alginate microfibers[15]. (g,h)Schematic diagrams andfluorescent microscope images of helical calcium alginate microfibers with hollow(g) and core-shell(h) structures[15]. Scale bars are 200 μm(b,c) and 100 μm in (d~h) |
综上所述,通过微流控技术可控构建多样化的液流模板,可以制备得到具有实心、中空、腔室、以及螺旋型等多样化结构、组成和功能的微纤维材料。 利用微流控液流模板法制备功能微纤维,不仅可对微纤维的尺寸、横截面形状、以及其内部的结构和组分等进行精确调控,还可通过巧妙耦合微纤维的结构和功能组分以使其获得更加丰富的整体协同功能,从而为新型功能微纤维材料的创新设计和可控制备提供新的思路和指导。 为了进一步促进微流控液流模板法在微纤维制备方面的应用和创新,今后还需系统深入地研究微尺度多相液流相关的界面科学、并探索微流控装置的多样化升级模式、及其规模化生产微纤维的技术等等,例如,深入研究微尺度多相液流的稳定、可控构建过程中的界面科学,并耦合界面传质与反应过程,使其适用于更加多样化的微纤维材料的模板合成;开发易于规模化、适用性更强的微流控纺丝设备,以实现基于微流控技术的微纤维工业化生产。 上述研究有利于更加有效地构建多样化的液流模板用于功能微纤维的可控制备。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|



