L-组氨酸对生物有机体有着良好的亲和能力,通过修饰其化学结构以期寻找药理活性和生物利用度高的衍生物。 本文将 L-组氨酸分别与反式肉桂酸和对甲氧基肉桂酸反应,合成了两种组氨酸酰胺类衍生物,利用傅里叶变换红外光谱、质谱、氢谱/碳谱核磁共振谱进行了结构表征。 采用分子操作环境(MOE)软件分子对接技术、荧光光谱法、同步荧光光谱法(SFS)、紫外-可见光谱法(UV-Vis),共同研究了两种衍生物分别和人血清白蛋白(HSA)相结合的机理。 MOE对接结果显示,这两种衍生物与HSA的模拟结合能分别为-13.82和-16.25 kcal/mol,主要是通过范德华力和疏水作用结合在HSA亚结构域ⅡA(即site Ⅰ)的疏水腔内。 荧光猝灭数据表明,衍生物与HSA相互作用并形成了新的基态配合物,荧光猝灭过程为静态猝灭;不同温度(300、305和310 K)下衍生物与HSA相互作用的结合常数分别为1.773×104、6.354×103、1.260×103和5.314×104、4.614×103、1.420×103;由热力学参数得到衍生物与HSA的结合过程是由范德华力驱动;SFS表明,衍生物使得HSA的二级结构发生了变化。 结合UV-Vis的结果可以确定,在体外生理条件下,组氨酸酰胺类衍生物均可以通过范德华力与HSA结合,并对HSA内源荧光产生静态猝灭及构象影响,这与分子对接结果一致,从而为组氨酸酰胺类衍生物药物的进一步开发提供了参考。
L-Histidine has excellent affinity for biological organism. Its derivatives by structural modification may possess high pharmacological activity and bio-availability. In this work, two L-histidineamide derivatives were designed and synthesized by the reaction of L-histidine with trans-cinnamic acid and p-methoxycinnamic acid. Their structures were characterized by infrared, mass spectrometry, and nuclear magnetic resonance. The interaction mechanism of derivatives and human serum albumin(HSA) was investigated by molecular operating environment(MOE) molecular docking, fluorescence spectroscopy, synchronous fluorescence spectroscopy(SFS) and ultraviolet-visible(UV-Vis) absorption spectroscopy. The results of MOE molecular docking shows that the two derivatives exist in the hydrophobic pocket of subdomain ⅡA(site Ⅰ) of HSA under the action of van der Waals force and hydrophobic effect, with the simulation binding energy are -13.82 and -16.25 kcal/mol, respectively. The fluorescence quenching results show that the derivatives can interact with HSA and form new ground-state complexes and the fluorescence quenching process is a static quenching procedure. The binding of HSA to derivatives driven by van der Waals force was found from the thermodynamic parameters, and the binding equilibrium constants at different temperatures(300 K, 305 K, and 310 K) are 1.773×104, 6.354×103, 1.260×103, 5.314×104, 4.614×103, 1.420×103, respectively. The SFS characterization shows that the secondary structure of HSA has been changed by derivatives. Combining the results of UV-Vis spectra, it is obviously that under physiological conditions in vitro, the interaction between derivatives with HSA produces static quenching and conformational effects to the internal fluorescence of HSA through van der Waals force, which is consistent with the prediction of molecular docking, thus providing a reference for the further development of histidine amide derivatives research.
人血清白蛋白(Human serum albumin,HSA)是血浆中最丰富的蛋白质,能够与类别广泛的内源及外源性小分子结合,起着重要的储存和运输作用。 因此,药物进入血液后将会不同程度地与血清白蛋白结合。 其结合程度极大地影响了药物在体内的药效、代谢、作用持续时间和消除速度以及毒性。 长期以来,人血清白蛋白一直是作为研究药物与蛋白相互作用机理的模型蛋白[1,2]。 L-组氨酸( L-Histidine)是组成蛋白质的20多种氨基酸之一,广泛存在于生物有机体中。 组氨酸结构中含有一个咪唑基,故其在生理环境中既能接受质子又能释放质子,且它还能与蛋白质分子中的其它一些基团形成氢键[3]。 利用其对生物有机体有着良好的亲和能力,将其引入到药物分子中,对药物进行修饰,以期望得到具有更强活性的药物和增强药物的疗效[4]。
本文以组氨酸为起始原料,分别与反式肉桂酸和对甲氧基肉桂酸反应,设计合成了两种未见文献报道的组氨酸酰胺衍生物。 本文采用分子操作环境(Molecular Operating Environment,MOE)软件分子对接技术,结合荧光光谱、同步荧光光谱、紫外可见光谱法,在模拟生理条件下研究了这两种组氨酸酰胺衍生物与HSA的结合特性,求出了相关结合参数,并探讨了其对人血清白蛋白构象的影响。
Shimadzu LCMS-8040型液质联用仪(日本Shimadzu公司);Avance-600型核磁共振仪(600 MHz,德国Bruker公司);Cary Eclipse型荧光分光光度计(带恒温装置,美国Agilent Technologies公司);Agilent Cary 60 UV-Vis型紫外-可见分光光度计(带恒温装置,美国Agilent Technologies公司);Advantage A10型超纯水系统(美国Millipore公司);Boetius型显微熔点测定仪(德国Boetius公司);Is50 FT-IR型傅里叶变换红外光谱仪(美国Thermo Nicolet公司)。
人血清白蛋白(HSA,99%,美国Sigma公司),pH=7.4的PBS缓冲液(粉剂,美国Sigma公司),对甲氧基肉桂酸(珠海嘉信康医药科技有限公司,HPLC ≥95%),反式肉桂酸(珠海嘉信康医药科技有限公司,HPLC ≥95%),其余试剂均为国产分析纯,购自南宁蓝天实验设备有限公司,实验用水为Milli-Q超纯水。
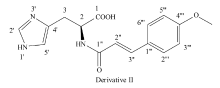
衍生物 L-组氨酸肉桂酰胺(Ⅰ)和( E)-{3-(4-甲氧苯基)丙烯酰}- L-组氨酸(Ⅱ)的合成路线如Scheme 1所示。
1.2.1 中间体肉桂酰氯的制备 肉桂酸(对甲氧基肉桂酸)20 mmol,加入15 mL二氯亚砜,在60 ℃油浴下搅拌回流反应6 h,减压旋蒸除去溶剂,即得肉桂酰氯粗产品,用6 mL四氢呋喃溶解后密封备用。
1.2.2 衍生物的制备 将3.1 g组氨酸(20 mmol)于常温下溶解在10 mL NaOH(2 mol/L)溶液中,在0~5 ℃下缓慢滴入上述酰氯溶液,控制滴加速度,10 min左右滴加完毕,反应温度由其自然升至室温。 薄层色谱TLC( V(甲醇): V(氯仿)=1:10)跟踪反应,反应3 h后停止反应,减压旋蒸除去溶剂,得到黄色粘稠状固体,将其用无水乙醇洗涤,过滤,除去组氨酸原料。 随后将粗产物用干法上样过硅胶柱层析(甲醇-氯仿)梯度洗脱。 用此方法分别得到目标产物衍生物Ⅰ和Ⅱ。
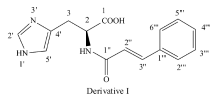
1.2.3 衍生物Ⅰ和Ⅱ的结构表征波谱数据 衍生物Ⅰ:黄色固体,产率为34.6%,mp 166~168 ℃,ESI-MS( m/z):284[M-H]-,IR(KBr), σ/cm-1:3263.25(O—H),3143.14(N—H),1657.38(C=O),1594.85,1448.87(aromatic ring and alkene C=C),978.37(alkene C—H),766.39,686.96(aromatic ring C—H);1H NMR(DMSO- d6,600 MHz), δ:8.33(s,—CONH—),7.93(s,1H,imidazole-H),7.34~7.47(m,2H+2H+1H,aromatic-H),7.14(s,1H,imidazole-H),6.55(d, J=15.60 Hz,1H,olefin-H),4.57(dd, J1=8.40 Hz, J2=4.80 Hz,1H,—CH—),3.09~3.23(m,2H,—CH2);13C NMR(DMSO- d6,150 MHz), δ:176.62,167.83,141.43,134.18,133.53,130.33,128.94,127.90,119.70,116.87,54.44,27.85。
衍生物Ⅱ:黄色固体,产率为43.2%,mp 164~166 ℃,ESI-MS( m/z):313[M-H]-,IR(KBr), σ/cm-1:3389.97(O—H),3271.05(N—H),2852.12(C—O—C),1662.61(C=O),1602.75,1513.51(benzene ring and alkene C=C),1386.34(C—H),1257.00,1230.38(C—O),978.37(alkene C—H),826.95(benzene ring C—H);1H NMR(DMSO-d6,600 MHz), δ:8.450(s,—CONH—),7.89(s,1H,imidazole-H),7.38(d, J= 8.40 Hz,2H,aromatic-H),7.29(d, J=15.60 Hz,1H,olefin-H),6.99(s,1H,imidazole-H),6.84(d, J=8.40 Hz,2H,aromatic-H),6.39(d, J=16.20 Hz,1H,olefin-H),4.55(dd, J1=8.40 Hz, J2=4.80 Hz,1H,—CH—),3.73(s,3H,—OCH3),3.04~3.17(m,2H,—CH2);13C NMR(101 MHz,DMSO-d6), δ:177.54,168.09,160.34,140.87,134.87,132.08,129.63,127.28,117.57,117.41,114.26,55.32,54.99,28.80。
从Protein Data Bank数据库下载HSA-warfarin复合物晶体结构(PDB编码:1H9Z[5])。 将配体(衍生物Ⅰ~Ⅱ)用ChemBio3D Ultra(version 12.0)画出三维结构,另存为mol文件导入至MOE中,并用MM94力场对其结构进行能量最小化优化。 对接前将受体1H9Z进行质子化,清除非结合水等预处理,配合Site Finder找出活性口袋,剔除活性口袋外的配体。 通过MOE分别将衍生物Ⅰ~Ⅱ对接到HSA的活性口袋,进行计算,最终得到10种对接模型,结合能最负的为最佳。 打分函数为MOE自带函数ASE[6,7]。
1.4.1 溶液配制 用pH=7. 4的磷酸盐缓冲液(PBS)配制浓度为1.0×10-4 mol/L人血清白蛋白。 用生理盐水配制浓度为1.0×10-3 mol/L的衍生物Ⅰ或Ⅱ)储备液,均在4 ℃下保存备用。
扫描溶液的配制:取10支10 mL的比色管,用移液枪加入1.0 mL的人血清白蛋白溶液,再依次加入0、100、200、300、400、500、600、700、800和900 μL的衍生物Ⅰ或Ⅱ储备液,用PBS定容至10 mL,摇匀。 分别在300、305和310 K下恒温静置60 min后扫描荧光光谱和紫外吸收光谱。
1.4.2 荧光光谱的测定 参数设置:激发波长280 nm,激发、发射狭缝宽度分别为5和2.5 nm,扫描速度为中速,荧光发射光谱波长范围300~500 nm。 同时测定Δ λ=15 nm和Δ λ=60 nm时的同步荧光光谱。
1.4.3 紫外吸收光谱的测定 以PBS缓冲液为参比,测定在300~500 nm波长范围的紫外可见吸收光谱。
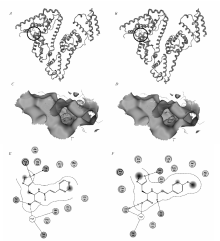
衍生物Ⅰ和Ⅱ与HSA相互作用的最佳构象及模拟结合模式见图1。
根据结合能最低及构象合理原则,选取了衍生物Ⅰ和Ⅱ与HSA的最佳结合模式。 由图1中可以看出,其主要结合位点均为Site Ⅰ位点,且各衍生物构象均能较好地嵌入靶标蛋白的活性口袋中,且伸展方向与疏水腔的方向基本保持一致,表现出较好的结合。 同时可以看出,不同衍生物与HSA之间的相互作用力主要是疏水作用力和静电引力,并且不同衍生物的引入改变了残基周围微环境的疏水性,因此可以推断它们之间的作用力主要为范德华力[8]。 其对接计算得到的结合能如表1所示。
| 表1 衍生物Ⅰ和Ⅱ与HSA的模拟结合能 Table 1 Simulation binding energy of derivatives Ⅰ and Ⅱ |
在激发波长为280 nm时,HSA最大荧光发射峰在350 nm附近。 衍生物Ⅰ和Ⅱ在此条件下并无荧光发射,但在 λex、 λem处均有一定吸收,这样获得的结合常数等数据存在一定的误差,需根据式(1)予以校正[9,10]。
式中, F0和 Fc分别表示测试和校正后的荧光发射峰强度, Aex、 Aem分别是体系在 λex、 λem处的吸收值。
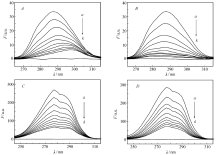
根据式(1)分别绘制了衍生物Ⅰ和Ⅱ与HSA相互作用的荧光猝灭光谱,如图2所示。 从图2可以看出,HSA的最大荧光发射峰为348 nm,随着体系中的衍生物浓度的不断增加,HSA在348 nm附近的荧光峰强度呈现出有规律的降低,且最大荧光发射峰有轻微的红移(Ⅰ-HSA:由348 nm移动至352 nm;Ⅱ-HSA:由347 nm移动至355 nm)。 这可能是由于衍生物Ⅰ、Ⅱ均与HSA结合,进入了蛋白质的疏水腔内,导致了发荧光的芳香族氨基酸周围微环境极性变大,疏水性变小,从而引起了HSA空间构象的改变[11]。
荧光猝灭大体上可分为静态猝灭和动态猝灭。 无论是静态猝灭还是动态猝灭,荧光分子与猝灭剂之间的猝灭效率都遵循Stern-Volmer方程[12]:
根据式(2)分别绘制300、305和310 K温度下衍生物Ⅰ/Ⅱ-HSA体系的 F0/ F-[Q]关系图(见图3),计算得出猝灭常数( KSV)和猝灭速率常数 kq(见表2),数据具有良好的线性关系。 依据猝灭常数随温度的不同变化,可以大体区分猝灭是属于动态还是静态, KSV随着温度的升高而增大,为动态猝灭;静态猝灭与之相反,温度升高可能降低基态配合物的稳定性,从而减小荧光猝灭的程度[13]。 由图3和表2可见,猝灭常数 KSV随着温度的升高而降低,且衍生物Ⅰ/Ⅱ-HSA体系的 kq值均远大于小分子猝灭剂对蛋白质大分子的最大碰撞猝灭速率2.0×1010 L/(mol·s)[14,15],由此可以推断荧光猝灭过程为生成稳定基态配合物的静态猝灭。
 | 图3 不同温度下Ⅰ-HSA 体系( A)及Ⅱ-HSA体系( B)的荧光猝灭Stern-Volmer图Fig.3 Stern-Volmer plots of fluorescence quenching of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) at different temperatures |
| 表2 不同温度下Ⅰ-HSA 体系( A)及Ⅱ-HSA体系( B)的猝灭参数 Table 2 Quenching constants of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) at different temperatures |
衍生物Ⅰ/Ⅱ-HSA体系溶液的吸收光谱如图4所示。 由图4可知,衍生物Ⅰ/Ⅱ-HSA体系的最大吸收峰强度随着衍生物Ⅰ、Ⅱ浓度的递增而明显减弱,说明衍生物Ⅰ(Ⅱ)的加入均使HSA分子构象发生了变化[16]。 此外,紫外吸收光谱显示衍生物Ⅰ/Ⅱ-HSA体系和游离Ⅰ(Ⅱ)的差谱与HSA的紫外吸收曲线并不重合(见图4中插图)。 进一步说明了衍生物Ⅰ、Ⅱ均分别与HSA基态分子形成了基态配合物,其猝灭即自为静态猝灭[17]。
假设衍生物与HSA有多个结合位点,静态猝灭可以用张勇[18]等提出的一个求取结合位点数( n)及结合常数( KA)的线性回归式(3)来描述:
以lg [( F0 -F) /F]对lg [Q]作图,分别绘制了衍生物Ⅰ/Ⅱ-HSA体系的关系图,如图5所示,根据其斜率和直线截距可得到不同温度下的 KA和 n值(见表3)。 由表3可知,结合常数 KA均随着温度升高而降低,说明衍生物Ⅰ(Ⅱ)与HSA结合形成基态配合物且其稳定性随着温度的增加而降低,更进一步证明两种体系的猝灭过程为静态猝灭[19]。 此外,在不同温度下 n值均接近1,表明HSA与衍生物Ⅰ、Ⅱ的结合均只存在1个结合位点。
 | 图5 不同温度下Ⅰ-HSA 体系( A)及Ⅱ-HSA体系( B)的荧光猝灭双对数图Fig.5 Double logarithmic plots of fluorescence quenching of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) at different temperatures |
| 表3 不同温度下Ⅰ-HSA 体系( A)及Ⅱ-HSA 体系( B)的结合参数 Table 3 Binding parameters of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) at different temperatures |
根据非辐射能量转移理论[20,21],分别绘制HSA荧光光谱与衍生物紫外吸收光谱的重叠图,见图6。 计算到供体的荧光光谱与受体的吸收光谱的重叠积分 J、能量转移效率 E、结合距离 r值列于表4。 r均大于临界能量转移距离 R0,说明静态猝灭的概率大于非辐射能量转移引起的猝灭,衍生物与HSA发生作用的猝灭方式主要为形成复合物导致的静态猝灭[22,23]。
 | 图6 Ⅰ-HSA 体系( A)及Ⅱ-HSA体系( B)的荧光发射光谱( a)与衍生物( b)的紫外吸收光谱重叠图Fig.6 Overlap of fluorescence emission spectrum of HSA( a) and absorption spectra of derivatives( b) of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) |
| 表4 Ⅰ-HSA 体系( A)及Ⅱ-HSA体系( B)的结合距离参数 Table 4 Distance parameters of Ⅰ-HSA systems( A) and Ⅱ-HSA systems( B) |
小分子配体与蛋白质之间的作用力包括氢键、疏水作用、静电力和范德华力等非共价作用力。 根据反应的热力学参数Δ H、Δ S在反应前后的变化可大致确定作用力类型[22]。 根据van't Hoff定律,可获得两物质间相互作用的热力学参数(见表5):
表中显示不同温度下Δ G<0,表明衍生物Ⅰ、Ⅱ与HSA结合的作用过程是一个Gibbs自由能降低的自发过程;Δ H<0,Δ S<0,表明其结合过程是焓驱动,主要的相互作用力为范德华力[23]。 此结果与分子模拟的结果一致。
| 表5 不同温度下衍生物-HSA 体系的热力学参数 Table 5 Thermodynamic parameters of derivative-HSA systems at different temperatures |
利用同步荧光光谱可以了解药物分子对蛋白质构象的影响。 当Δ λ=15 nm时,同步荧光光谱只显示酪氨酸残基(Tyr)的光谱特征;而当Δ λ=60 nm时,仅表现色氨酸残基(Trp)的荧光[24]。
图7为300 K时不同浓度衍生物Ⅰ(Ⅱ)存在下HSA的同步荧光光谱。 由图7可以看出,HSA荧光随衍生物Ⅰ(Ⅱ)浓度的升高而呈显著下降趋势。 在Ⅰ-HSA体系中,酪氨酸残基的最大荧光发射峰所在波长明显红移,由288 nm红移至298 nm,说明衍生物Ⅰ加入后使得HSA酪氨酸残基附近的微环境极性增加。 而在Ⅱ-HSA体系中,酪氨酸残基的最大荧光发射峰所在波长轻微蓝移,由288 nm蓝移至285 nm,说明衍生物Ⅱ加入后HSA酪氨酸残基附近的微环境疏水性有得到增加。 而色氨酸残基的最大荧光发射峰所在的波长没有明显的变化,这可能表明衍生物Ⅰ(Ⅱ)与HSA的结合靠近酪氨酸。
分子对接结果显示衍生物 L-组氨酸肉桂酰胺(Ⅰ)或( E)-{3-(4-甲氧苯基)丙烯酰}- L-组氨酸(Ⅱ)主要通过范德华力和疏水作用结合在HSA亚结构域ⅡA(即site Ⅰ)的疏水腔内,荧光猝灭数据和紫外-可见光谱结果表明,在体外生理条件下,衍生物Ⅰ(Ⅱ)均可以与HSA结合形成基态配合物,静态猝灭是引起HSA内源荧光产生显著猝灭的主要原因,其主要的结合力为范德华力,这种结合作用引起了酪氨酸残基附近的微环境变化,并最终导致了HSA构象的改变,且结合能力衍生物Ⅱ>衍生物Ⅰ。 这些结果为实现组氨酸酰胺类衍生物在生物体内的药代动力学进一步研究发展提供了有益探索,为药物的设计、改良提供了一些有价值的理论参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|