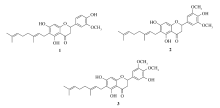
3种香叶基黄烷酮是从毛泡桐( Paulownia tomentosa)水果中分离出的3种具有相似结构的黄酮类化合物。 我们以廉价的2,4,6-三羟基苯乙酮,羟基苯甲醛为原料经过取代、氯甲基甲基醚保护、羟醛缩合、分子内的麦克加成反应以及脱甲基甲基醚合成了3个香叶基取代黄烷酮。 其结构经过核磁共振氢谱及碳谱(1H NMR,13C NMR )和高分辨质谱(HRMS)等技术手段进行了表征,并采用四氮唑蓝(MTT)法测试了合成化合物对肺癌细胞A459的体外抗肿瘤活性。 结果表明,所合成的化合物均具有一定的抗肺癌细胞活性,其中化合物2抗肺癌活性明显优于化合物1和3,其半数抑制浓度为25.6 μmol/L,为临床疾病的治疗和药物的研发提供了参考。
Three geranylated flavanones isolated from the bark of Paulownia tomentosa were synthesized from phloroacetophenone and substituted hydroxybenzaldehydes via substitution, protection of phenolic hydroxyl group, aldol condensation, cyclization and deprotection reactions. Their structures were confirmed by proton and carbon(1H and13C) nuclear magnetic resonance(NMR) and high resolution mass spectrometry(HRMS). The inhibition assay of these flavanones against A459 cell by methyl thiazolyl tetrazolium(MTT) protocol, indicates that compound 2 exihibits the highest activity with an half maximal inhibitory concentration(IC50) value at 25.6 μmol/L. This study provides a suggestion for drug development based on geranylated flavanone scaffold.
黄烷酮类化合物广泛存在于自然界中,是多种药用植物的有效成分之一,黄烷酮类化合物不仅结构多样,而且不同黄酮类化合物的植物表现出了不同的生物活性和功能,其中香叶基类黄烷酮化合物(Geranylflavanoids)是20世纪70年代以后,随着人们对黄酮化合物的深入研究和波谱技术在天然产物结构鉴定中的普遍应用所发现的一类天然产物。 近年来,已报道了许多有关该类化合物的一些性质[1,2,3,4,5]。 如具有消炎、降压、抗菌、抗癌等多种生物活性。 因此,香叶基类黄烷酮成为了目前天然产物化学领域研究的热点。
香叶基黄酮类化合物在植物中的分布非常广泛,黄初升等[6]总结了已发现的香叶基黄烷酮类化合物,该类化合物主要分布在桑科( Moroideae)的桑属( Morus),豆科( Legunosae)的槐属( Sophora)、蚂蝗属( Desmodiem)和千斤拨属( Hemingia)等植物的根、根皮、叶和种子中,桑属和槐属植物普遍含有该类化合物。
本研究所要合成的3个香叶基是从毛泡桐( Paulownia tomentosa)水果中分离出的3个具有相似结构的黄酮类化合物[7]。 它已经被用于民间医药治疗一些疾病,如呼吸道感染和其它细菌感染,并且这3种化合物具有一定的细胞活性。 但这3个香叶基黄烷酮的合成还未见文献报道。 因此。对它的合成不仅存在理论研究意义,而且具有潜在的药用价值。
基于本课题组在这一领域的研究[8,9,10,11,12,13,14],本文报道了香叶基黄烷酮1~3的合成(图1)。
AVANCE-400型核磁共振仪(TMS为内标,德国Bruker公司);Q-Excative型质谱仪(美国Thermo Fisher公司);MULTISKAN MK3型酶标仪(美国Thermo Fisher公司)。
细胞株 A549(中国科学院典型培养物保藏委员会细胞库),实验室自行传代培养。 48~75 μm及GF254硅胶(青岛海洋化工厂生产);所用试剂均为市售分析纯,购自天津化学福晨化学试剂厂。
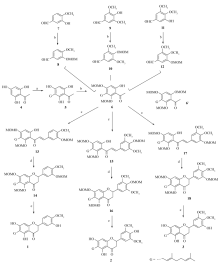
由2,4,6-三羟基苯乙酮、4-羟基-3,5-二甲氧基苯甲醛、4-羟基-5-甲氧基苯甲醛、3 -羟基-4,5-二甲氧基苯甲醛为起始原料经过取代,氯甲基甲基醚保护,羟醛缩合,分子内的麦克加成反应以及脱甲基甲基醚得到目标化合物1~3。
1.3.1 香叶基溴的合成 将香叶基醇(4.62 g,30 mmol)溶于无水乙醚(60 mL),滴加吡啶(0.15 mL),冷却到0 ℃,剧烈搅拌下缓慢滴加三溴化磷(3.09 mL,33 mmol),继续反应1 h,然后倒入冰水中,乙醚萃取,有机相合并后,依次用水洗,饱和食盐水洗,无水MgSO4干燥,常压蒸去机溶剂得淡黄色液体,避光低温储存备用。
1.3.2 3-香叶基-2,4,6-三羟基苯乙酮(5)的合成 将2,4,6-三羟基苯乙酮(5.04 g,30 mmol),无水K2CO3(4.15 g,30 mmol)和香叶基溴(6.52 g,30 mmol)溶于干燥的丙酮(200 mL)中,加热回流10 h,然后冷却到室温 。 减压蒸去溶剂,加入10 mL的3 mmol/mL的HCl,20 mL乙酸乙酯萃取,有机相合并后,依次用水洗,饱和食盐水洗,无水Na2SO4干燥,过滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=8:1),得淡黄色固体5(4.8 g,15.8 mmol),产率52%。1H NMR(CDCl3,400 MHz), δ:1.58,1.66,1.79(s,9H,3CH3),2.04~2.13(m,4H,4'-2H and 5'-2H),2.66(s,3H,COCH3),3.35(d, J=7.2 Hz,2H,1'-2H),5.05(t, J=11.2 Hz,1H, =CH),5.25(t, J=13.2 Hz,1H, =CH ),5.90(s,1H,ArH),7.09(s,1H,OH),9.55(s,1H,OH),11.67(s,1H,OH);13C NMR(CDCl3,100 MHz), δ:203.80,161.42,139.78,132.18,123.72,121.60,105.59,105.23,68.28,76.78,53.52,39.76,32.90,
26.36,21.58,17.79,16.28;HRMS(ESI)计算值C18H24O4Na [M+Na]+:327.1567,实测值:327.1561。
1.3.3 2-羟基-4,6-二甲氧基甲氧基-5-香叶基苯乙酮(6)的合成 将化合物5(1.82 g,6 mmol) 溶于干燥的丙酮(120 mL)中,剧烈搅拌下加入无水碳酸钾(5.80 g,42 mmol),滴加氯甲基甲基醚(1.2 g,15 mmol),回流1.5 h,冷却至室温,抽滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=10:1)得淡黄色油状液体6(1.42 g,3.6 mmol),产率60%。1H NMR (CDCl3,400 MHz), δ:1.56,1.64,1.77(s,9H,3CH3),1.92~2.05(m,4H,4'-2H and 5'-2H),2.65(s,3H,COCH3),3.31(d, J=7.2 Hz,2H,1'-2H),3.48,3.51(s,6H,2OCH3),5.06~5.25(m,4H,2OCH2O,2'-H and 6'-H),6.38(s,1H,ArH),13.82(s,1H,OH);13C NMR(CDCl3,100 MHz), δ:203.49,163.55,160.80,158.80,134.84,131.16,124.50,122.46,
111.64,106.92,94.60,93.91,91.28,56.68,56.32,
39.86,33.19,26.78,25.69,21.54,17.67,16.12;HRMS(ESI)计算值C22H32O6Na[M+Na]+:415.2091,实测值:415.2086。
1.3.4 3-甲氧基-4-甲氧基甲氧基苯甲醛(8)的合成 将化合物7(1.17 g,7.7 mmol)溶于干燥的丙酮(75 mL)中,剧烈搅拌下加入无水碳酸钾(1.27 g,9.2 mmol),滴加氯甲基甲基醚(750 mg,9.2 mmol),回流1.5 h,冷却至室温,抽滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=6:1)得无色油状物8(1.37 g,6.9 mmol),产率91%。1H NMR(CDCl3,400 MHz), δ:9.86(s,1H,CHO),7.43(s,1H,ArH),7.41(d, J=2 Hz,1H,ArH),7.27(d, J=8.4 Hz,1H,ArH),5.32(s,2H,CHO2),3.94(s,3H,OCH3),3.51(s,3H ,OCH3);13C NMR(CDCl3,100 MHz), δ:191.11,152.12,150.20,131.21,126.55,114.81,109.63,95.13,56.64,56.16;HRMS(ESI)计算值C10H12O4Na [M+Na]+:219.0628,实测值:219.0624。
1.3.5 2'-羟基-4',6'-二甲氧基甲氧基-4-甲氧基-5'-香叶基查尔酮(13)的合成 将化合物6(392 mg,1 mmol)和化合物8(235 mg,1.2 mmol)溶于3 mL乙醇(EtOH)中,冰水浴冷却,缓慢滴加KOH(2.8 g,50 mmol)-H2O-EtOH(6.7 mL, V(H2O): V(EtOH)=2:3)溶液,N2气保护下0 ℃反应1 h后自然升至室温,继续反应24 h,将反应物倒入冰水中,用3 mol/L的盐酸调节至pH值为3~4,乙酸乙酯萃取,有机相合并后依次水洗、饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=8:1)得黄色粘稠液体13(320 mg,0.56 mmol),产率56%。1H NMR(CDCl3,400 MHz), δ:13.84(s,1H,OH),7.84(d, J=16 Hz,1H, CH=),7.74(d, J=16 Hz,1H, CH=),7.18(s,2H,ArH),7.15(s,1H,ArH),6.37(s,1H,ArH),5.28(s,2H,OCH2O),5.27(s,2H,OCH2O),5.24(s,2H,OCH2O),5.24~5.17(m,1H, CH=),5.06(t, J=8 Hz,1H, CH=),3.95(s,1H,OCH3),3.92(s,3H,OCH3),3.52(s,6H,2OCH3),3.48(s,3H,OCH3),3.34(d, J=8 Hz,2H,CH2),2.02~2.06(m,2H,CH2),1.94~1.98(m,2H,CH2),1.79(s,3H,CH3),1.64(s,3H,CH3),1.57(s,3H,CH3);13C NMR(CDCl3,100 MHz), δ:193.15,163.95,160.88,158.20,153.63,153.23,142.34,136.50,135.15,131.65,131.38,127.27,124.55,
122.41,112.24,107.86,
106.45,98.34,95.71,93.98,92.30,57.40,57.16,56.45,56.32,56.13,39.95,26.87,25.83,21.76,17.80,16.27;HRMS(ESI)计算值C32H42O9Na [M+H]+:571.2902,实测值:571.2896。
1.3.6 5,7-二甲氧基甲氧基-3'-甲氧基-4'-甲氧基甲氧基-6-香叶基黄烷酮(14)的合成 向化合物13(102 mg,0.18 mmol)的乙醇(3.5 mL)溶液中加入无水醋酸钠(353 mg,4.3 mmol)和一滴水,加热回流 24 h,冷却至室温后加水(5 mL),乙醚(10 mL×3)萃取,有机相合并后依次用水洗,饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=2:1)得到白色固体黄烷酮13(58 mg,0.10 mmol),产率56%。1H NMR(CDCl3,400 MHz), δ:7.17(d, J=8.4 Hz,1H,ArH),7.03(d, J=2.0 Hz,1H,ArH),6.96(dd, J=8.3,1.8 Hz,1H,ArH),6.57(s,1H,ArH),5.35(dd, J=12.8,2.8 Hz,1H,CH),5.30~5.23(m,6H,2OCH3),5.22~5.16(m,1H, CH=),5.03~5.06(m,1H, CH=),3.90(s,3H,OCH3),3.53(d, J=2.6 Hz,6H,2OCH3),3.47(s,3H,OCH3),3.32(d, J=7.2 Hz,CH2,),2.98(dd, J=16.5,13.0 Hz,1H,CH),2.80(dd, J=16.5,3.0 Hz,1H,CH),2.00~2.03(m,2H,CH2),1.97~1.86(m,2H,CH2),1.64(d, J=7.1 Hz,6H,2CH3),1.55(s,3H,CH3);13C NMR(101 MHz,CDCl3), δ:190.06,161.12,160.74,157.71,149.89,146.58,135.21,133.55,131.47,124.36,122.29,118.57,116.21,112.68,
109.60,107.68,
96.14,95.55 ,94.16 ,78.67,56.71 ,56.45,56.02,46.10,39.96,39.51,37.54,26.82,25.82,22.23,17.80,16.22;HRMS(ESI)计算值C32H42O9Na [M+Na]+:593.2721,实测值:593.2714。
1.3.7 5,7-二羟基-3'-甲氧基-4'-羟基-6-香叶基黄烷酮(1)的合成 向化合物7(57 mg,0.1 mmol)的甲醇(5 mL)溶液中缓慢滴加盐酸(1 mL,3 mol/L),回流25 min,冷却后加入5 mL水,乙酸乙酯(15 mL×3)萃取,有机相合并后依次水洗,饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(二氯甲烷): V(甲醇)=256:1)得到白色固体1(27 mg,0.061 mmol),产率61%。1H NMR(400 MHz,CDCl3), δ:12.00(s,1H,OH),6.95~7.00(m ,3H,3ArH),6.03(s,1H,OH),5.69(s,1H,OH),5.33(dd, J=13.0,2.9 Hz,1H,CH),5.22(t, J=6.5 Hz,2H , CH=),5.03(t, J=6.4 Hz,1H, CH=),3.92(s,3H,3 OCH3),3.33(d, J=7.1 Hz,1H,CH),3.06(dd, J=17.1,13.0 Hz,1H,CH),2.80(dd, J=17.1,3.0 Hz,1H,CH),2.05(t, J=7.9 Hz,4H,2CH2),1.72(s,3H,CH3),1.66(s,3H,CH3),1.58(s,6H,CH3);13C NMR(CDCl3,100 MHz), δ: 196.54,164.07,163.41,146.80,146.15,139.13,130.74,123.78,121.56,119.56,114.61,108.73,
106.15,103.28,97.28,76.84,56.12,
43.54,39.86,29.85,26.47,25.83,21.90,17.86,16.30;HRMS(ESI)计算值C26H30O6Na [M+H]+:439.2115,实测值:439.2110。
1.3.8 3,5-二甲氧基-4-甲氧基甲氧基苯甲醛(10)的合成 将化合物9(910 mg,5 mmol) 溶于干燥的丙酮(50 mL)中,剧烈搅拌下加入无水碳酸钾(828 mg,6 mmol),滴加氯甲基甲基醚(483 mg,6 mmol),回流1.5 h,冷却至室温,抽滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=4:1)得淡黄色油状物10(112 mg,0.50 mmol),产率10%。
将化合物9(910 mg,5 mmol)溶于干燥的CH2Cl2(40 mL)中,加入三乙胺(7.5 mmol,757.5 mg),4-二甲氨基吡啶DMAP(0.5 mmol,61 mg),最后加入氯甲基甲基醚(6 mmol,483 mg)室温下搅拌反应8 h,加入水猝灭反应,二氯甲烷萃取,合并有机相,依次用水洗,饱和食盐水洗,无水Na2SO4干燥,过滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=4:1),得淡黄色油状物10(872 mg,3.86 mmol),产率77.2%。1H NMR(400 MHz,CDCl3), δ:9.75(s,1H,CHO),7.02(s,2H,2ArH),5.11(s,2H,OCH2O),3.81(s,6H,2OCH3),3.48(s,3H,OCH3);13C NMR(CDCl3,100 MHz), δ:191.02,153.78,153.72 ,132.16,106.54,106.48,98.13,57.24,57.16,56.17,56.10;HRMS(ESI)计算值C11H14O5Na [M+Na]+:249.0733,实测值:249.0729。
1.3.9 2-羟基-4,6-二甲氧基甲氧基-3',5'-二甲氧基--4'-甲氧基甲氧基-5-香叶基查尔酮(15)的合成 将化合物6(503 mg,1.32 mmol)和化合物10(356 mg,1.59 mmol)溶于乙醇(4 mL)中,冰水浴冷却,缓慢滴加KOH(2.8 g,50 mmol)-H2O-EtOH(6.7mL, V: V=2:3) 溶液,N2气保护下0 ℃反应 1 h后自然升至室温,继续反应24 h,将反应物倒入冰水中(5 mL),用3 mol/L的盐酸调节至pH值为3~4,二氯甲烷(5 mL×3)萃取,有机相合并后依次水洗、饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=6:1)得淡黄色粘稠液体15(482 mg,0.80 mmol),产率61%。1H NMR (400 MHz,CDCl3), δ:13.84(s,1H,OH),7.84(d, J=16 Hz,1H, CH=),7.74(d, J=16 Hz,1H, CH=),7.18(s,2H,ArH),7.15(s,1H,ArH),6.37(s,1H,ArH),5.28(s,2H,OCH2O),5.27(s,2H,OCH2O),5.24(s,2H,OCH2O),5.24~5.17 (m,1H, CH=),5.06(t, J=8 Hz,1H, CH=),3.95(s,1H,OCH3),3.92(s,3H,OCH3),3.52(s,6H,2OCH3),3.48(s,3H,OCH3),3.34(d, J=8 Hz,2H,CH2),2.02~2.06(m,2H,CH2),1.94~1.98(m,2H,CH2),1.79(s,3H,CH3),1.64(s,3H,CH3),1.57(s,3H,CH3);13C NMR(CDCl3,100 MHz), δ:193.25,163.93,160.78,158.21,149.86,148.56,142.33,135.10,131.35,130.05 ,126.30 ,124.57 ,122.46,122.27,
115.98,112.24 ,111.07 ,107.90 ,95.67 ,95.32 ,94.00 ,92.36 ,57.09 ,56.50 ,56.44,55.96,39.95,26.87,25.82,21.77,
17.80,16.26;HRMS(ESI)计算值C33H44O10Na [M+Na]+:623.2827,实测值:623.2817。
1.3.10 5,7-二甲氧基甲氧基-3',5'-二甲氧基-4'-甲氧基甲氧基-6-香叶基黄烷酮(16)的合成 向化合物15(181 mg,0.3 mmol)的乙醇(3.5 mL)溶液中加入无水醋酸钠(492 mg,6 mmol)和一滴水,加热回流24 h,冷却至室温后加水(5 mL),乙醚(10 mL×3)萃取,有机相合并后依次用水洗,饱和食盐水洗,无水Na2SO4干燥,过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=2:1)得到白色固体黄烷酮16(112 mg,18.7 mmol),产率62%。1H NMR (CDCl3,400 MHz), δ:7.17(d, J=8.4 Hz,1H,ArH),7.03(d, J=2.0 Hz,1H,ArH),6.96(dd, J=8.3,1.8 Hz,1H,ArH),6.57(s,1H,ArH),5.35(dd, J=12.8,2.8 Hz,1H,CH),5.30~5.23(m,6H,2OCH3),5.22~5.16 (m,1H, CH=),5.03~5.06(m,1H, CH=),3.90(s,6H,2OCH3),3.53(d, J=2.6 Hz,6H,2OCH3),3.47(s,3H,OCH3),3.32(d, J=7.2 Hz,CH2),2.98(dd, J=16.5,13.0 Hz,1H,CH),2.80(dd, J=16.5,3.0 Hz,1H,CH),2.00~2.03(m,2H,CH2),1.97~1.86(m,2H,CH2),1.64(d, J=7.1 Hz,6H,2CH3),1.55(s,3H,CH3);13C NMR(400 MHz,CDCl3), δ:189.91,160.98,160.78,157.72,153.58,135.47,135.27,134.28,131.50 ,124.29,122.28,112.67,107.63,102.88,
98.27,96.18,
95.54,94.16,78.87,57.33,56.70,56.51,56.18,46.31,39.98,26.83,25.81,22.26,17.78,16.23;HRMS(ESI)计算值C33H44O10Na [M+Na]+:623.2827,实测值:623.2817。
1.3.11 5,7-二羟基-3',5'-甲氧基-4'- 羟基-6-香叶基黄烷酮(2)的合成 向化合物16(72 mg,0.12 mmol)的甲醇(5 mL)溶液中缓慢滴加盐酸(1 mL,3 mol/L),回流25 min,冷却后加入5 mL水,乙酸乙酯(15 mL×3) 萃取,有机相合并后依次水洗,饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(二氯甲烷): V(甲醇)=256:1)得到白色固体2(34 mg,0.07 mmol),产率60%。1H NMR(CDCl3,400 MHz), δ:12.00(s,1H,OH),6.95~7.00(m,3H,3ArH),6.03(s,1H,OH),5.69(s,1H,OH),5.33(dd, J=13.0,2.9 Hz,1H,CH),5.22(t, J=6.5 Hz,2H , CH=),5.03(t, J=6.4 Hz,1H, CH=),3.92(s,3H,OCH3),3.85(s,3H,OCH3),3.33(d, J=7.1 Hz,1H,CH),3.06(dd, J=17.1,13.0 Hz,1H,CH),2.80(dd, J=17.1,3.0 Hz,1H,CH),2.05(t, J=7.9 Hz,4H,2CH2),1.72(s,3H,CH3),1.66(s,3H,CH3),1.58(s,3H,CH3);13C NMR(100 MHz,CDCl3), δ:196.42,182.34,164.08,162.44,147.28,139.25,135.14,132.29,129.98,123.74,121.52,106.13,103.28,103.10,
97.24,79.24,
79.57,56.53,43.75,39.88,26.46,25.84,21.92,17.86,16.33;HRMS(ESI)计算值C27H32O7Na [M+Na]+:491.2040,实测值:491.2033。
1.3.12 3,4-二甲氧基-5-甲氧基甲氧基苯甲醛(12)的合成 将化合物11(910 mg,5 mmol)溶于干燥的丙酮(50 mL)中,剧烈搅拌下加入无水碳酸钾(828 mg,6 mmol),滴加氯甲基甲基醚(483 mg,6 mmol),回流1.5 h,冷却至室温,抽滤,减压蒸去溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=4:1)得淡黄色油状物12(840 mg,3.724 mmol),产率74%。1H NMR(CDCl3,400 MHz), δ:9.79(s,1H,CHO),7.27(d, J=2.0 Hz,1H,ArH),7.12(d, J=1.6Hz,1H,ArH),5.22(s,2H,CHO2),3.90(s,3H,OCH3),3.87(s,3H,OCH3),3.47(s,3H,OCH3);13C NMR(CDCl3,100 MHz), δ:190.95,153.92,150.98,144.50,131.83,112.31,105.99,95.31,77.48,77.16 ,76.85 ,61.02 ,56.34,56.16;HRMS(ESI)计算值C11H14O5Na [M+Na]+:249.0733,实测值:249.0730。
1.3.13 2-羟基-4,6-二甲氧基甲氧基-3',4'-二甲氧基-5'-甲氧基甲氧基-5-香叶基查尔酮(17)的合成 将化合物6(392 mg,1 mmol)和化合物12(149.6 mg,1.1 mmol)溶于乙醇(2 mL)中,冰水浴冷却,缓慢滴加KOH(2.8 g,50 mmol)-H2O-EtOH(6.7 mL, V: V=2:3) 溶液,N2气保护下0 ℃反应1 h后自然升至室温,继续反应24 h,将反应物倒入冰水中(5 mL),用3 mol/L的盐酸调节至pH值为3~4,萃取(5 mL×3),有机相合并后依次水洗、饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=6:1)得淡黄色粘稠液体17(343 mg,0.57 mmol),产率63%;1H NMR(CDCl3,400 MHz), δ:13.84(s,1H,OH),7.85(d, J=16 Hz,1H, CH=),7.69(d, J=16 Hz,1H, CH=),7.15(d, J=1.8 Hz,1H,ArH),6.85(d, J=1.8 Hz,1H,ArH),6.40(s,1H,ArH),5.28(s,2H,OCH2O),5.25(s,4H,2OCH2O),5.23~5.17(m,H, CH=),5.07(t, J=8 Hz,1H, CH=),3.91(s,3H,OCH3),3.90(s,3H,OCH3),3.52 (s,3H,OCH3),3.53(s,3H,OCH3),3.48(s,3H,OCH3),3.34(d, J=8 Hz,2H,CH2),2.02~2.06(m,2H,CH2),1.94~1.98(m,2H,CH2),1.79(s,3H,CH3),1.64(s,3H,CH3),1.67(s,3H,CH3);13C NMR(CDCl3,100 MHz), δ:193.15,164.01,160.89,158.32,153.65,151.27,142.12,140.93,135.10,131.34,127.40,124.57,122.45,
112.18,109.74,109.03,107.78,107.00,95.49,94.00,
92.22,61.24,57.02,56.43,56.39,56.18,39.95,26.87,25.82,21.75,17.79,
16.26;HRMS(ESI)计算值C33H44O10Na [M+Na]+ :623.2827,实测值:623.2819。
1.3.14 5,7-二甲氧基甲氧基-3',4'-二甲氧基-5'-甲氧基甲氧基-6-香叶基黄烷酮(18)的合成 向化合物17(181 mg,0.3 mmol)的乙醇(3.5 mL)溶液中加入无水醋酸钠(492 mg,6 mmol)和一滴水,加热回流24 h,冷却至室温后加水(5 mL),乙醚(10 mL×3)萃取,有机相合并后依次用水洗,饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(石油醚): V(乙酸乙酯)=2:1)得到白色固体黄烷酮18(108.4 mg,0.18 mmol),产率60%。1H NMR(CDCl3,400 MHz), δ:7.17(d, J=8.4 Hz,1H,ArH),7.03(d, J=2.0 Hz,1H,ArH),6.96(dd, J=8.3,1.8 Hz,1H,ArH),6.57(s,1H,ArH),5.35(dd, J=12.8,2.8 Hz,1H,CH),5.30~5.23(m,6H,2OCH3),5.22~5.16(m,1H, CH=),5.03~5.06(m,1H, CH=),3.90(s,6H,2OCH3),3.53(d, J=2.6 Hz,6H,2OCH3),3.47(s,3H,OCH3),3.32(d, J=7.2 Hz,CH2),2.98(dd, J=16.5,13.0 Hz,1H,CH),2.80(dd, J=16.5,3.0 Hz,1H,CH),2.00~2.03(m,2H,CH2),1.97~1.86(m,2H,CH2),1.64(d, J=7.1 Hz,6H,2CH3),1.55(s,3H,CH3);13C NMR(CDCl3,100 MHz), δ:189.86,160.96,160.72,157.67,153.67,151.03,138.94,135.20,135.15, 131.41,124.31,122.24,112.65,107.60,107.28,103.91,96.15,95.56,95.52,94.12,
78.73 ,61.09,56.66,56.47,56.37,56.16,46.19,
39.92,26.79,25.78,22.2,17.75,16.15;HRMS(ESI)计算值C33H44O10Na [M+Na]+ :623.2827,实测值:623.2820。
1.3.15 5,7-二羟基-3',5'-甲氧基-4'- 羟基-6-香叶基黄烷酮(3)的合成 向化合物7(72 mg,0.12 mmol)的甲醇(5 mL)溶液中缓慢滴加盐酸(1 mL,3 mol/L),回流25 min,冷却后加入5 mL水,乙酸乙酯(15 mL×3) 萃取,有机相合并后依次水洗,饱和食盐水洗,无水Na2SO4干燥。 过滤,减压蒸除溶剂,硅胶柱层析分离( V(二氯甲烷): V(甲醇)=256:1)得到白色固体3(36 mg,0.07 mmol),产率63%。1H NMR(CDCl3,400 MHz), δ:12.00(s,1H,OH),6.95~7.00 (m ,3H,3ArH),6.03(s,1H,OH),5.69(s,1H,OH),5.33(dd, J=13.0,2.9 Hz,1H,CH),5.22(t, J=6.5 Hz,2H , CH=),5.03(t, J=6.4 Hz,1H, CH=),3.92(s,3H,OCH3),3.85(s,3H,OCH3),3.33(d, J=7.1 Hz,1H,CH),3.06(dd, J=17.1,13.0 Hz,1H,CH),2.80(dd, J=17.1,3.0 Hz,1H,CH),2.05(t, J=7.9 Hz,4H,),1.72(s,3H),1.66(s,3H,CH3),1.58(s,6H,CH3);13C NMR(CDCl3,100 MHz), δ:196.34,164.20,162.37,159.60,152.66,149.62,139.18,135.62,134.98,132.23,123.81,121.53,106.27,106.04,
103.23,101.94,97.21,79.02,61.14,56.08,43.54,39.85,26.46,25.89,22.52,17.85,16.31;HRMS(ESI)计算值C27H32O7Na [M+Na]+:491.2040,实测值:491.2030。
1)取处于对数生长期,生长状态良好的肺癌A549细胞和正常人肺纤维细胞(human embryonic lung fibroblast,HELF),用DMEM(dulbecco's modified eagle medium)培养基调整细胞密度到3×105个/mL,接入96孔板,每孔100 μL细胞悬液,每组2个复孔,同时设空白组,二甲基亚砜(DMSO)组,阳性对照组,阴性对照组,37 ℃培养过夜(在细胞孔周围孔内加入100 μL无菌磷酸盐缓冲溶液PBS);2)根据不同分组和细胞处理设置分别处理细胞,37 ℃培养24 h;
①正常组:不做处理;DMSO组(加细胞培养基和DMSO);
②阳性对照组:加入星孢霉素(Staurosporine),使终浓度分别为16 nmol/L、80 nmol/L、400 nmol/L、2 μmol/L和10 μmol/L; 阴性对照组:只加细胞和培养基;
③化合物1组:向A549细胞和人肺纤维细胞HELF,分别加入化合物1,使终浓度分别为0.1、1、10、30和50 μmol/L;
④化合物2组:向A549细胞和人肺纤维细胞HELF,分别加入化合物2,使终浓度分别为0.1、1、10、30和50 μmol/L;
⑤化合物3组:向A549细胞和人肺纤维细胞HELF,分别加入化合物3,使终浓度分别为0.1、1、10、30和50 μmol/L;
3)每孔加入10 μL MTT,37 ℃培养4 h;
4)吸出培养基,加入150 μL DMSO震荡10 min;
5)酶标仪测定各孔在568 nm的吸光值OD。
我们由2,4,6-三羟基苯乙酮、4-羟基-3,5-二甲氧基苯甲醛、4-羟基-5-甲氧基苯甲醛和3 -羟基-4,5-二甲氧基苯甲醛为起始原料经过取代、氯甲基甲基醚保护、羟醛缩合、分子内的麦克加成反应以及脱甲基甲基醚得到目标化合物1~3。 我们完成了香叶基黄烷酮化合物1~3的全合成。 合成的关键是中间体2-羟基-4,6-二甲氧基甲氧基-5-香叶基苯乙酮(6)的选择性合成,羟基的保护,脱保护。
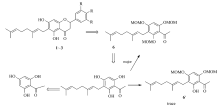
如Scheme 2所示,化合物1~3均是6-位取代的香叶基黄烷酮,合成的关键是中间体2-羟基-4,6-二甲氧基甲氧基-5-香叶基苯乙酮(6)的选择性合成,首先,将2,4,6-三羟基苯乙酮(4)与香叶基溴发生取代反应,得到了香叶基取代苯乙酮5其产率为52%,再将3-香叶基-2,4,6-三羟基苯乙酮(5),用氯甲基甲基醚进行保护,以60%的产率选择性目标化合物得到2-羟基-4,6-二甲氧基甲氧基-5-香叶基苯乙酮(6),反应选择性保护香叶基2侧羟基,副产物6,痕量,关于香叶基取代后保护选择性研究,我们在(±)-Cycloaltilisin 7和(±)-Poinsettifolin B的首次全合成已有详细分析。
其反应产率分别为:3-羟基-4-甲氧基苯甲醛(7)、4-羟基-3,5-二甲氧基苯甲醛(9)和3-羟基-4,5-二甲氧基苯甲醛(11)上的羟基,用氯甲基甲基醚进行保护,其反应产率分别为60%、91%、77.2%和74%。 将反应得到的化合物8、10和12分别与化合物6在N2气保护下发生羟醛缩合分别得到了化合物13、15和17,其产率分别为56%、61%和57%。 然后化合物13、15和17发生分子内的迈克加成反应,得到了化合物14、16和18,其产率分别为56%、62%和60%。 最后将化合物14、16和18在3 mol/L HCl甲醇中回流的条件下脱去保护基得到了最终的产物1、 2和3,其产率分别为61%、60%和63%。
在合成中间体3,5-二甲氧基-4-甲氧基甲氧基苯甲醛10时,开始将化合物9溶于干燥的丙酮中,剧烈搅拌下加入无水碳酸钾,滴加氯甲基甲基醚,回流1.5 h,经后处理后得到目标产物10的产率只有10%,我们认为由于空间位阻的影响,且无机碱在有机溶剂中的溶解度不大,所以得到目标产物的产率比较低,随后又尝试用化合物9溶于干燥的CH2Cl2中,加入三乙胺,DMAP,最后加入氯甲基甲基醚室温下搅拌反应8 h,反应结束后经后处理后得到目标产物10,产率为69%。
在对化合物14、16和18进行脱保护基时,控制脱保护基的时间是合成3个天然产物的关键。 若时间太长,会出现严重的拖尾现象且苯环上的香叶基会与羟基成环,不利于分离。 主要原因是黄烷酮侧链上的香叶基有双键,对酸比较敏感,脱保护时间太长,会有副反应发生,产率降低,产物难于分离。 而对于这3个化合物,我们发现反应时间控制在25 min,利用3 mol/L的HCl,且甲醇盐酸( V(MeOH): V(HCl)=5:1)时脱保护基的效果最佳。
采用MTT法测试了目标化合物1~3对人肺癌细胞和HELF细胞的体外细胞增殖抑制活性,实验结果如表1所示。
| 表1 化合物1~3对A459和HELF细胞的IC50 Table 1 IC50 values of compounds 1~3 on A459 and HELF cell line in vitro |
结果表明,DMSO溶剂对照组的抑制率只有1.7%,化合物1~3对A459肺癌细胞均有一定的抑制作用,化合物1和3的抑制效果不佳,但是化合物2对A459肺癌细胞抑制效果比较好,其样品浓度达到50 μmol/L时,增长率为17.86%,IC50值为25.6264,而低于阳性对照物星孢霉素的抑制率(9.9694 μmol/L),分析原因可能是星孢霉素对A459肺癌细胞具有很强的选择性,而上述3个化合物对A459肺癌细胞的选择性比较差。 上述3个化合物对正常的肺细胞也有一定的细胞毒性,其细胞毒性小于星孢霉素,因此其它香叶基黄烷酮对抗肿瘤活性的影响有待于进一步研究。
本文以2,4,6-三羟基苯乙酮、4-羟基-3,5-二甲氧基苯甲醛、4-羟基-5-甲氧基苯甲醛和3-羟基-4,5-二甲氧基苯甲醛为原料经过取代,氯甲基甲基醚保护,羟醛缩合,分子内的麦克加成反应以及脱甲基甲基醚得到目标化合物1~3,且均具有一定抗肺癌活性,其中化合物2对A459肺癌细胞抑制效果比较好,化合物1-3的波普数据与文献[7]报道的一致。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|