采用循环伏安法,研究了0.25 mol/L TaCl5在离子液体1-丁基-3-甲基咪唑六氟磷酸盐([Bmim]PF6)中的电化学行为。 实验结果表明,电沉积钽是受扩散控制、两步骤的不可逆电极反应过程,首先是Ta(Ⅴ)还原为Ta(Ⅲ),其次是Ta(Ⅲ)还原为金属钽和形成其它低价钽氯化物。 Ta(Ⅴ)/Ta(Ⅲ)和Ta(Ⅲ)/Ta在离子液体[Bmim]PF6中的阴极传递系数分别为0.155和0.406。 Ta(Ⅴ)在离子液体[Bmim]PF6中的扩散系数为1.629×10-9 cm2/s。 在100 ℃和-1.25 V条件下,采用恒电势法在铂片上电沉积钽,扫描电子显微镜照片和EDS分析表明,沉积物为钽和钽的低价氯化物。
The electrochemical behavior of 0.25 mol/L tantalum pentachloride is investigated in 1-butyl-3-methylimidazolium hexafluorophosphate([Bmim]PF6) by cyclic voltammetry. The results show that the electrodeposition process of tantalum is a two-step irreversible electrode reaction by diffusion control. Tantalum(Ⅴ) is first reduced to tantalum(Ⅲ), and tantalum(Ⅲ) is further reduced to tantalum metal and tantalum subchloride. The cathodic transfer coefficients of Ta(Ⅴ)/Ta(Ⅲ) and Ta(Ⅲ)/Ta are 0.155 and 0.406, respectively. The diffusion coefficient of Ta(Ⅴ) is 1.629×10-9 cm2/s. The electrodeposition of tantalum on platinum substrate from TaCl5-[Bmim]PF6 is performed using the potentiostatic method at 100 ℃ and -1.25 V.SEM and EDS analysis results indicate that the electrodeposits are mixtures of tantalum metal and tantalum subchiloride.
钽具有高熔点、耐腐蚀、延展性好等优异的性能被广泛应用于电子、机械和航空航天等工业领域[1]。 同时,钽的热稳定性好,在铜和硅中的扩散系数很小,热导率大,粘结性强等成为最佳的扩散隔层材料,在超大规模集成电路中具有广阔的应用前景[2,3]。 另外,钽在人的体液中是惰性的,其生物相容性、抗腐蚀能力和高纯度等使其成为理想的医疗材料。
钽的沉积电位比较负,几乎不可能从水性电解质溶液中沉积出来;而熔盐体系和离子液体具有较大的电化学窗口,可以沉积出钽。 最早Senderoff等[4]用K2TaF7作为钽源,在650~850 ℃的三元共晶LiF-NaF-KF熔盐中得到了致密的钽镀层。 Balikhin等[5]在LiF-NaF-K2TaF7混合熔盐中获得了钽镀层的优化工艺方法。 但是,上述电化学还原法制备钽都是在高温熔盐体系中进行,不可避免地产生设备高温腐蚀、电流效率低和能源消耗大等诸多问题。 室温离子液体以其宽阔的电化学窗口和良好的导电性,在制备金属、合金以及半导体等材料时成为备受关注的电解液[6]。 Barnard等[7]研究了TaCl5在40 ℃离子液体体系MeEtImCl/AlCl3中的电化学行为,其电化学还原过程分为3个步骤,首先TaCl5与离子液体中的Cl-结合形成[TaCl6]-,然后通过两次一个电子还原,Ta(Ⅴ)被还原成Ta(Ⅲ),最后Ta(Ⅲ)通过3个电子还原成金属钽。 Endres研究小组[8,9]通过循环伏安法和EQCM分析了0.5 mol/L TaF5在离子液体[BMPyr][TFSI]中的电化学还原过程,首先TaF5获得两个电子被还原成TaF3,然后在更低的电位下被还原成Ta,但是电沉积得到的钽十分疏松,容易脱落,厚度约为700 nm。 最近,Maguy等[10]通过相同的实验方法,分析了TaF5在相同离子液体[BMPyr][TFSI]中的电化学还原过程,认为TaF5获得5个电子被还原成Ta,同时TaF5与F-结合形成Ta
众所周知,第一代AlCl3离子液体(如MeEtImCl/AlCl3)吸水性强,稳定性差,电化学还原过程中容易发生副反应[12]。 本文选用TaCl5作为钽源,研究了其在室温离子液体[Bmim]PF6(对空气和水较稳定)中的电化学行为,并探讨了电沉积法制备金属钽的可行性。
离子液体1-丁基-3-甲基咪唑六氟磷酸盐([Bmim]PF6)(≥99%,河南利华制药有限公司),五氯化钽(TaCl5)(分析纯,宁夏东方钽业股份有限公司),铂片(99.99%,北京有色金属研究总院)。
所有的电化学实验都在充满Ar气的真空手套箱中进行。 采用CHI6081C型电化学工作站(上海辰华仪器有限公司)进行循环伏安法测试和恒电位电沉积研究,选用铂片作为工作电极和辅助电极,铂丝作为参比电极。 电极先用粒径13 μm的金相砂纸打磨后,在超声条件下依次用去离子水、丙酮和无水乙醇清洗,放在真空干燥箱中充分干燥后,放入手套箱中备用。 实验选择在100 ℃下沉积电势为-1.25 V进行TaCl5在铂片上的恒电势电沉积,沉积时间为2 h,电沉积的样品使用去离子水和丙酮进行冲洗。 采用LEO-1450型扫描电子显微镜(德国Carl Zeiss公司)和其附带的KEVEX Sigma能谱微分析仪对产物进行分析。
首先将离子液体[Bmim]PF6在真空干燥箱中105 ℃下干燥24 h,以降低离子液体中的水含量。 然后在真空手套箱中,将适量TaCl5缓慢加入到装有离子液体的玻璃电解池中,在60 ℃下搅拌1 h以保证TaCl5充分溶解,得到0.25 mol/L TaCl5-[Bmim]PF6的混合液体。
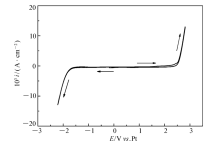
图1为不含TaCl5的离子液体[Bmim]PF6在100 ℃时的循环伏安曲线,扫描速率为50 mV/s。 由图1可知,离子液体[Bmim]PF6的电化学窗口可以达到4 V,与文献值[13]基本相符。图2为0.25 mol/L TaCl5在100 ℃离子液体[Bmim]PF6中的循环伏安曲线,以50 mV/s的扫描速率从开路电位-0.1 V开始向负方向扫描到-2.2 V,然后向正方向扫描到2 V,最后回到开路电位处。 阴极电位极限主要是离子液体中[Bmim]+阳离子的不可逆还原,阳极电位极限主要为离子液体中[PF6]-阴离子的不可逆氧化,也可能出现铂的钝化。
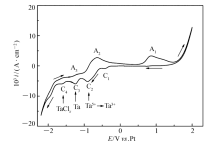 | 图2 0.25 mol/L TaCl5在100 ℃下 [Bmim]PF6中循环伏安曲线Fig.2 Cyclic voltammogram of [Bmim]PF6 with 0.25 mol/L TaCl5 at 100 ℃ |
从图2可以看出,负方向上有4个还原峰(C1~C4),正方向上出现了3个氧化峰(A1~A3)。 0.86 V处的氧化峰A1为Cl-的氧化过程,对应-0.4 V处的C1还原峰[14]。 氯离子在离子液体中电化学氧化并没有形成氯气从电解质中逸出,而是形成C
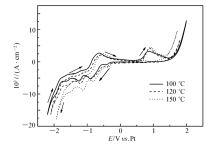
图3为0.25 mol/L TaCl5在不同温度的离子液体[Bmim]PF6中的循环伏安曲线,扫描速率为50 mV/s。 由图3可知,随着温度增加,还原峰的电位向较正的方向稍微偏移,同时还原峰的峰电流也随着温度升高而增大。 这是因为大部分离子液体的导电性会随着温度升高而增加,而黏度随着温度升高而降低,这有利于电活性离子向电极表面快速迁移以及电荷转移,也就使还原过程的速率增加,所以还原峰的峰电流就增加了。
图3中A1氧化峰的峰电流随温度的升高而增大,是因为温度升高,C
图4为不同扫描速率时0.25 mol/L TaCl5在100 ℃离子液体[Bmim]PF6中的循环伏安曲线。 由图4可知,随着扫描速率增加,峰值电流增大,还原电流峰向负电势方向移动,氧化电流峰向正电势方向移动。 对于可逆电极反应来说,峰值电位与扫描速率无关,因此可以判断钽沉积的电极反应过程为非可逆过程。 对于非可逆过程的电极反应,其阴极传递系数( α)与阴极过程的峰电势( Ep)及半峰电势( Ep/2)存在如下关系式[15]:
式中, R为气体常数, T为温度(K), n为电子转移数, F为法拉第常数。 阴极传递系数表示电极电位对阴极反应活化能影响的程度,其主要取决于电极反应的动力学性质,与反应粒子的浓度关系不大。 根据方程式(1)和循环伏安曲线获得的数据,能够计算该电极反应过程的阴极传递系数。 从循环伏安曲线得到的数据及相应的计算结果列于表1和表2中。 从表1和表2可知,Ta(Ⅴ)/Ta(Ⅲ)和Ta(Ⅲ)/Ta在离子液体[Bmim]PF6中的阴极传递系数分别为0.155和0.406。
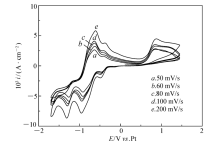 | 图4 不同扫描速率时0.25 mol/L TaCl5在100 ℃ [Bmim]PF6中的循环伏安曲线Fig.4 Cyclic voltammograms of 0.25 mol/L TaCl5 in [Bmim]PF6 at various scanning rates at 100 ℃ |
| 表1 不同扫描速率时Ta(Ⅴ)/Ta(Ⅲ)的循环伏安曲线数据 Table 1 Data of cyclic voltammograms for Ta(Ⅴ)/Ta(Ⅲ) with various scan rates |
| 表2 不同扫描速率时Ta(Ⅲ)/Ta的循环伏安曲线数据 Table 2 Data of cyclic voltammograms for Ta(Ⅲ)/Ta with various scan rates |
图5为还原峰C2的峰电流与扫描速率平方根的关系图。 对于非可逆扩散过程,电极反应过程的扩散系数可通过Berzins-Delahay方程计算[16]:
式中, Ip为峰电流, n为反应电子数, F为法拉第常数, R为摩尔气体常数, T为热力学温度(K), A为电极面积(cm2), c0为溶液本体浓度(mol/L), D为扩散系数(cm2/s), v为扫描速率(V/s)。 由图5可知,还原峰C2的峰电流 Ip与扫描速率 v的平方根呈线性关系,由此判断钽的电沉积过程是受扩散控制的非可逆过程。 根据式(2)和图5的斜率,可以计算出Ta(Ⅴ)在该体系中的扩散系数 D为1.629× 10-9 cm2/s。
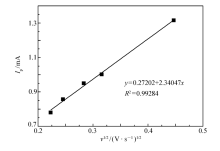 | 图5 阴极峰C2的峰电流与扫描速率平方根( Ip- v1/2)关系图Fig.5 A dependence plot of cathodic peak current of C2 against square root of sweep rate |
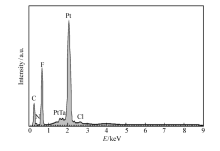
图6为0.25 mol/L TaCl5在离子液体[Bmim]PF6中电沉积的扫描电子显微镜照片。 从图6可以看出,许多白色的小颗粒分布在铂片表面。 选取了白色区域的电沉积物的进行EDS分析,如图7和表3所示。 从表3中可以得出, n(Ta): n(Cl)=3.1:1,推测其组成成分为金属钽和钽的低价氯化物。 F、N等元素的出现是由于电极表面还有残留的离子液体。 众所周知,大部分诸如Ta、Nb、Mo、Ti和W等难熔金属具有复杂簇结构。图8为Ta6C
| 表3 沉积层的EDS分析 Table 3 Composition analysis of electrodeposits by EDS |
通过研究0.25 mol/L TaCl5在离子液体[Bmim]PF6中的电化学行为可知:1)电沉积钽过程是两步骤的电极反应过程,首先是Ta(Ⅴ)还原为Ta(Ⅲ)的过程,其次是Ta(Ⅲ) 还原为金属钽和形成其它低价钽氯化物的过程。 随着扫描速率增加,还原峰电势负移,且峰值电流 Ip与扫描速率的平方根 v1/2呈线性关系,表明电沉积钽过程是受扩散控制的不可逆的电极反应过程;2)Ta(Ⅴ)/Ta(Ⅲ)和Ta(Ⅲ)/Ta在离子液体[Bmim]PF6中的阴极传递系数分别为0.155和0.406;Ta(Ⅴ)在离子液体[Bmim]PF6中的扩散系数为1.629×10-9 cm2/s;3)在100 ℃和沉积电势为-1.25 V时,0.25 mol/L TaCl5-[Bmim]PF6在铂片上的恒电势电沉积产物为金属钽和钽的低价氯化物。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|