以2-硝基苯磺酰氯为起始原料,经多步反应合成了12种新型1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物,产物收率高,水溶性好,并经1H NMR、13C NMR、MS-ESI和元素分析法确证结构。 用MTT法测试了这类衍生物对肝癌细胞HepG-2生长的抑制作用,结果显示目标化合物能不同程度地抑制肿瘤细胞生长,其中7-氨甲基-3-环丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪 (7c)对肝癌细胞HepG-2的抗性显著,最高抑制率达到79.3%。
Twelve unreported 4 H-1,2,4-benzothiadiazine 1,1-dioxide derivatives were synthesized from 2-nitrobenzene sulfonyl chloride with good water-solubility in high yields. These compounds were characterized by1H NMR,13C NMR, MS-ESI and elemental analysis. Their inhibiting effects on HepG-2 cell were evaluated with MTT protocol. The results show that 7-(aminomethyl)-3-cyclopropyl-1,1-dioxide-4 H-benzo[e][1,2,4]thiadiazine(7c) exhibits the highest inhibition rate of 79.3% among the synthesized compounds.
1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物不仅具有抗菌、消炎、刺激毛发生长等作用,还具有很强的KATP通道活化功能[1,2,3,4],能够有效的影响胰岛B细胞中胰岛素释放以及平滑肌的收缩[5,6],起到利尿、降糖、降压的作用。 进一步研究发现,该类化合物还能够作为丙肝病毒NS5B聚合酶抑制剂[7]和血小板损失抑制剂[8]。 该类化合物可以通过邻氨基苯磺酰胺与羰基化合物经托普反应和齐格勒反应缩合得到[9]。 文献[10]报道的1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪化合物的合成需要2-氨基苯磺酰胺类化合物先与硫羰基化合物在碳酸钾作用下进行加成,再经剧毒性的光气作用下分子内缩合得到,步骤操作危险复杂,并且收率较低。 该类化合物的合成中,使用原甲酸乙酯[11]或者在高温(~200 ℃)[12] 下进行关环反应。 使用原甲酸乙酯,操作简单,但是反应收率低;利用高温进行关环,反应速率加快,但副反应较多,分离提纯困难,反应收率低。
本研究综合参考上述文献,按图1所示的路线制得7-氨甲基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物(7a~7d)。 以2-硝基苯磺酰氯(1)为起始原料与乙酸铵发生置换反应得到2-硝基苯磺酰胺(2),后者在钯碳催化下加氢还原得到2-氨基苯磺酰胺(3),化合物3再与溴发生取代反应得到2-氨基-5-溴苯磺酰胺(4),化合物4在亚硫酸氢钠催化下,与4种羰基化合物缩合成环得到7-溴-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物(5a~5d),化合物5a~5d分别与氰化亚铜发生取代反应得到化合物7-氰基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物(6a~6d)。 最后化合物6a~6d经过钯碳催化还原得到最终产品7a~7d,对这12种化合物进行了抗肿瘤活性测试。
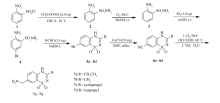 | 图1 7-氨甲基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物合成路线Fig.1 Synthetic route of 4 H-[1,2,4]-benzothiadiazine-7-carbonitrile 1,1-dioxide derivatives |
WRR型目视熔点仪(上海精科实业有限公司),温度经过校正;Bruker AV400型核磁共振仪(德国Bruker公司),溶剂为CDCl3或DMSO-d6,TMS为内标;Waters Acquity型液相质谱联用仪(美国Waters公司);Vario EL III型元素分析仪(德国Elementar公司);高压反应釜(上海予捷仪器有限公司);薄层层析板和柱层析硅胶(青岛海洋化工厂)。 所用试剂均为市售分析纯,其中溶剂使用前均按标准方法除水。
1.2.1 2-硝基苯磺酰胺(2)的合成 在反应瓶中加入2-硝基苯磺酰氯(1)(120.0 g,0.78 mol)、乙酸铵(360.0 g,4.70 mol)、四氢呋喃(280 mL),加热至回流过夜,TLC监控原料反应完全后冷却至5 ℃有大量固体析出,过滤后滤饼烘干得到黄色固体2-硝基苯磺酰胺2(86.0 g,80%)。 mp 193~194 ℃(文献值[13] mp 190~191 ℃);1H NMR(400 MHz,DMSO-d6), δ:8.04,7.92(2s,NH2,2H),7.85~7.80(m,Ar—H,4H);MS(ESI) m/z:203.1(M+H+)。
1.2.2 2-氨基苯磺酰胺(3)的合成 在高压釜中,将10%Pd/C(10.0 g)和化合物2(80.0 g,0.58 mol)溶于500 mL甲醇中,通入H2气,使反应釜内压力达到0.4 MPa,在50 ℃条件下反应过夜,反应结束后过滤除去催化剂,浓缩滤液得到灰白色固体2-氨基苯磺酰胺3(60.0 g,95%)。 mp 153~155 ℃(文献值[14] mp 153 ℃);1H NMR(400 MHz,DMSO-d6), δ:7.49,7.20(2s,SO2NH2,2H),7.17~6.57(m,Ar—H,4H),5.80(s,Ar—NH2,2H);MS(ESI) m/z:173.0(M+H+)。
1.2.3 2-氨基-5-溴苯磺酰胺(4)的合成 在室温条件下,向化合物3(232.0 g,1.34 mol)的乙酸(2000 mL)悬浮液中逐滴加入含有液溴(216.0 g,1.37 mol)的乙酸(1000 mL)溶液,搅拌2 h,TLC监控原料反应完全,将所得溶液倒入水中,有大量固体析出,抽滤后得到固体用水洗涤,粗产品经20%乙醇溶液重结晶3次,真空干燥得到白色固体2-氨基-5-溴苯磺酰胺物4(300.0 g,90%)。 mp 178~179 ℃(文献值[15] mp 179 ℃);1H NMR(400 MHz,DMSO-d6), δ:9.61,8.18(2s,SO2NH2,2H),7.82~7.25(m,Ar—H,3H),6.68(s,Ar—NH2,2H);MS(ESI) m/z:250.9(M+H+)。
1.2.4 化合物5a~5d的合成(以化合物5a为例) 在反应瓶中向溶有化合物4(30.0 g,0.12 mol)的DMF(300 mL)溶液中加入NaHSO3(18.7 g,0.18 mol)和丙醛(30.4 mL,0.42 mol),加热至120 ℃反应3 h,TLC监控原料反应完全。 向反应液中加入冰-水混合物,有大量固体析出,过滤得到粗产品,滤饼用水洗涤并真空干燥得到白色固体7-溴-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪5a(28.0 g,87%)。 用类似的方法合成化合物5b、5c和5d。
7-溴-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(5a):白色固体(收率 87%);mp 231~235 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.06(s,NH,1H),7.89~7.25(m,Ar—H,3H),2.55(q,CH2,2H),1.16(t,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:148.6,141.6,139.2,132.7,123.4,117.7,115.3,29.5,11.6;MS(ESI) m/z:288.9(M+H+);C9H9N2O2BrS元素分析实测值(计算值)/%:C 37.34(37.38),H 3.15(3.14),N 9.72(9.69)。
7-溴-3-甲基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(5b):白色固体(收率89%);mp 226~230 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.10(s,NH,1H),7.90~7.23(m,Ar—H,3H),2.27(s,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:147.7,142.4,137.6,132.7,124.1,118.5,115.7,26.9;MS(ESI) m/z:274.9(M+H+);C8H7N2O2BrS元素分析实测值(计算值)/%:C 34.90(34.92),H 2.53(2.56),N 10.19(10.18)。
7-溴-3-环丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(5c):白色固体(收率93%);mp 252~257 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.9(s,NH,1H),7.86~7.26(m,Ar—H,3H),1.88(m,CH,1H),1.15~1.05(m,CH2,2H),1.04~1.00(m,CH2,2H);13C NMR(100 MHz,DMSO-d6), δ:145.9,141.5,137.9,132.5,125.3,119.6,115.7,17.1,13.2,9.5;MS(ESI) m/z:300.9(M+H+ );C10H9N2O2BrS元素分析实测值(计算值)/%:C 39.90(39.88),H 2.99(3.01),N 9.32(9.30)。
7-溴-3-异丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(5d):白色固体(收率90%);mp 261~265 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.99(s,NH,1H),7.90~7.29(m,Ar—H,3H),2.79(m,CH,1H) ,1.16(d,—(CH3)CH3,6H);13C NMR(100 MHz,DMSO-d6), δ:149.2,141.5,138.1,131.9,127.1,119.6,115.7,33.6,17.9,16.3;MS(ESI) m/z:302.9(M+H+);C10H11N2O2BrS元素分析实测值(计算值)/%:C 39.59(39.62),H 3.63(3.66),N 9.22(9.24)。
1.2.5 化合物6a~6d的合成(以6a为例) 在反应瓶中向溶有化合物5a(50.0 g,0.17 mol)的DMF(500 mL)溶液中加入CuCN(40.0 g,0.35 mol),在N2气保护下加热至回流20 h,TLC监控原料反应完全,反应液冷却至室温,加入THF(200 mL),过滤,浓缩滤液,经柱层析[洗脱剂: V(石油醚): V(乙酸乙酯)=10:1]纯化得到黄色固体7-氰基-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪6a(26.0 g,53%)。 用类似的方法合成化合物6b、6c和6d。
7-氰基-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(6a):黄色固体(收率53%);mp 243~247 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.30(s,NH,1H),8.39~7.41(m,Ar—H,3H),2.60(q,CH2,2H),1.16(t,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:147.1,140.7,138.5,131.4,121.3,115.2,104.6,101.9,28.6,12.1;MS(ESI) m/z:236.0(M+H+);C10H9N3O2S元素分析实测值(计算值)/%:C 51.07(51.05),H 3.83(3.86),N 17.84(17.86)。
7-氰基-3-甲基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(6b):黄色固体(收率50%);mp 247~252 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.60(s,NH,1H),8.37~7.40(m,Ar—H,3H),2.47(s,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:147.5,141.0,138.5,131.5,120.9,115.4,105.9,101.7,31.5;MS(ESI) m/z:222.0(M+H+);C9H7N3O2S元素分析实测值(计算值)/%:C 48.87(48.86),H 3.18(3.19),N 18.98(18.99)。
7-氰基-3-环丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(6c):白色固体(收率61%);mp 277~281 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.63(s,NH,1H),8.34~7.43(m,Ar—H,3H),1.90(m,CH,1H),1.15~1.00(m,—CH2CH2—,4H);13C NMR(100 MHz,DMSO-d6), δ:146.9,140.5,139.7,131.5,123.1,111.4,102.7,101.3,21.4,9.5;MS(ESI) m/z:248.0(M+H+);C11H9N3O2S元素分析实测值(计算值)/%:C 53.45(53.43),H 3.68(3.67),N 16.96(16.99)。
7-氰基-3-异丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(6d):黄色固体(收率53%);mp 268~272 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.24(s,NH,1H),8.38~7.45(m,Ar—H,3H),2.82(m,CH,1H),1.19(d,—(CH3)CH3,6H);13C NMR(100 MHz,DMSO-d6), δ:148.3,140.7,138.5,131.3,125.4,117.5,112.8,109.1,41.2,33.8;MS(ESI) m/z:250.1(M+H+);C11H11N3O2S元素分析实测值(计算值)/%:C 53.01(53.00),H 4.43(4.45),N 16.84(16.86)。
1.2.6 化合物7a~7d的合成(以7a为例) 在高压釜中将化合物6a(17.0 g,72 mmol)和10%Pd/C(5.1 g)加入到HCl/EtOH(750 mL,3 mol/L)混合液中,置换气体后通入H2气,使釜内压力达到0.4 MPa,在60 ℃条件下过夜搅拌反应,TLC监控原料反应完全,过滤反应液,在0 ℃条件下,向滤液中逐滴滴加450 mL浓氨水,滴加完毕在室温下搅拌0.5 h,浓缩滤液所得固体先后用蒸馏水、THF洗涤并真空干燥得到黄色固体7-氨甲基-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪7a(15.0 g,87%)。 用类似的方法合成化合物7b、7c和7d。
7-氨甲基-3-乙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(7a):黄色固体(收率87%);mp 211~215 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.74(s,NH,1H),8.46(s,NH2,2H),7.95~7.48(m,Ar—H,3H),4.09(d,Ar—CH2—N,2H),2.61(q,CH2,2H),1.18(t,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:146.9,140.1,133.5,129.3,122.9,116.2,112.7,50.3,24.1,9.8;MS(ESI) m/z:240.1(M+H+);C10H13N3O2S元素分析实测值(计算值)/%:C 50.20(50.19),H 5.46(5.48),N 17.55(17.56)。
7-氨甲基-3-甲基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(7b):黄色固体(收率80%);mp 205~209 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.81(s,NH,1H),8.57(s,NH2,2H),7.97~7.37(m,Ar—H,3H),4.21(s,Ar—CH2—N,2H),2.36(s,CH3,3H);13C NMR(100 MHz,DMSO-d6), δ:146.8,140.1,133.4,129.5,123.3,116.1,114.2,50.4,25.2; MS(ESI) m/z:226.1(M+H+);C9H11N3O2S元素分析实测值(计算值)/%:C 47.98(47.99),H 4.94(4.92),N 18.64(18.65)。
7-氨甲基-3-环丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(7c):白色固体(收率80%);mp 217~221 ℃;1H NMR(400 MHz,DMSO-d6), δ:12.01(s,NH,1H),8.25(s,NH2,2H),7.95~7.40(m,Ar—H,3H),4.20(s,Ar—CH2—N,2H),1.92(m,CH,1H),1.23~1.10(m,—CH2CH2—,4H);13C NMR(100 MHz,DMSO-d6), δ:147.1,140.3,133.5,130.0,123.6,115.7,112.6,53.6,19.8,8.7;MS(ESI) m/z:252.1(M+H+ );C11H13N3O2S元素分析实测值(计算值)/%:C 52.58(52.57),H 5.19(5.21),N 16.71(16.72)。
7-氨甲基-3-异丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪(7d):黄色固体(收率86%);mp 229~232 ℃;1H NMR(400 MHz,DMSO-d6), δ:11.92(s,NH,1H),8.44(s,NH2,2H),7.95~7.53(m,Ar—H,3H),4.09(d,Ar—CH2—N,2H),2.92(m,CH,1H),1.20(d,—(CH3)CH3,6 H);13C NMR(100 MHz,DMSO-d6), δ:146.7,140.5,133.6,130.8,124.4,116.2,112.9,51.7,33.2,21.5;MS(ESI) m/z:254.1(M+H+);C11H15N3O2S元素分析实测值(计算值)/%:C 52.17(52.16),H 5.96(5.97),N 16.58(16.59)。
收集生长期肝癌细胞HepG-2,采用MTT法对所得的12个目标化合物进行初步的抗肿瘤细胞活性测试。 取对数生长期的HepG-2肿瘤细胞,用0.25 %的胰蛋白酶消化液消化,离心、重悬后计数,制备细胞悬液,计数约4×104个/mL。将细胞悬液注入96孔板上(180 μL/孔),置37 ℃恒温CO2培养箱培养24 h。 加入目标化合物的DMF溶液(20 μL/孔),再加入含10%血清培养液80 μL,培养48 h。将MTT加入96孔板中(20 μL/孔),置于培养箱中4 h。 吸去上清液,加入DMSO(150 μL/孔),在平板摇床振摇6 min。 用酶联免疫检测仪在波长在470 nm处测定每孔的吸光值(OD值)。 以未加受试药物,而只加相应溶媒的受试组作为阴性对照,以顺铂为阳性对照计算细胞抑制率[16,17,18]。 计算公式如下:
细胞抑制率/%=(阴性对照组OD值-受试药物组OD值)/阴性对照组OD值×100
由于化合物3苯环上的氨基为邻对位定位基,磺酰胺基为间位定位基,因此3,5位均较为活泼,容易生成化合物4和3-溴取代副产物(2-氨基-3-溴苯磺酰胺),必须严格控制反应温度。 我们在25、50和60 ℃下分别进行了取代反应实验,待原料反应完全后,发现化合物4收率分别为90%、77%、54%,表明反应温度超过60 ℃时,易生成2-氨基-4-溴苯磺酰胺,导致目标产物收率明显降低。 此外,在25 ℃条件下,分别改变反应时间(1.5、2和3 h),当反应超过2 h后,TLC监控显示随着反应时间的延长产物中未知杂质逐渐增多,反应时间为1.5 h时,仍有部分原料未反应完全,因此最佳反应时间为2 h。
在化合物5的合成中,反应物摩尔比对反应收率有很大的影响,我们研究了 na(2-氨基-5-溴苯磺酰胺): nb(羰基化合物)=1:1、1:2.5、1:3、1:3.5和1:4时的反应情况,TLC结果表明,1:1和1:2.5条件下目标产物收率均在50%以下,大部分原料仍未反应;当继续增加羰基化合物的量,摩尔比达到1:3时,化合物5收率明显提高,通过比较,1:3.5为最佳反应摩尔比。
当反应温度高于90 ℃时,反应3 h,TLC监控显示原料反应完全。 改变反应温度(90、100及120 ℃),并通过液相色谱监控,发现反应速率随温度升高而加快,且在固化析晶步骤中,90和100 ℃条件下反应液倒入冰水混合物中得到的是粘稠状固体,而120 ℃条件下反应液得到的是大量白色疏松状固体,易过滤洗涤。 因此,化合物5的最佳合成条件为在120 ℃条件下反应3 h。
以抗肿瘤药物顺铂(Cisplatin)为参照,测得12个目标化合物的初步抗肿瘤活性实验数据如表1所示。 按照抗肿瘤活性标准判断,当试样浓度为1和10 mg/L时,对肿瘤细胞抑制率小于50%,并且试样浓度为100 mg/L时抑制率大于或等于50%认定为弱效;当试样浓度为1 mg/L时,对肿瘤细胞抑制率小于50%,并且试样浓度为10和100 mg/L时抑制率大于或等于50%认定为中效;当试样浓度为1 mg/L时抑制率大于或等于50%认定为强效。
| 表1 目标化合物对肿瘤细胞增殖影响 Table 1 Inhibitory ratio of the compounds on tumor cell proliferation |
由表1可知,在12种目标化合物中,有7种化合物(5a、5c、5d、7a、7b、7c、7d)对肝癌细胞HepG-2抑制效果达到中效水平,其中化合物7c在样品浓度为1 mg/L时的抑制率达到43.7%,抑制效果接近强效水平。 并且不同取代基化合物活性对比,化合物7a~7d这4种化合物的抑制效果最强,化合物6a~6d抑制效果最弱,说明胺甲基取代的1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪化合物抗肿瘤活性强于腈基和卤素取代的衍生物。
经过多步反应合成得到12种新型1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪类衍生物,通过1H NMR、13C NMR、ESI-MS和元素分析对其结构进行了表征,化合物合成方法简便,收率较高,纯度好。 针对肝癌细胞HepG-2的抑制试验结果,说明这一系列化合物有一定的抗肿瘤活性,其中7-氨甲基-3-环丙基-1,1-二氧代-4 H-苯并[1,2,4]-噻二嗪7c对肝癌细胞HepG-2的抗性显著,最高抑制率达到79.3%。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|


