金纳米粒子(AuNPs)是构建用于诊断和治疗的纳米药物/探针的理想纳米材料之一,因此研究AuNPs与细胞的相互作用具有重要意义。 本文详细分析了金纳米簇(AuNCs)、球形金纳米粒子A(AuNPss)、金纳米球壳(AuNSs)和金纳米棒(AuNRs)等不同形貌的Au NPs对不同细胞模型的细胞毒性;讨论了AuNPs的理化性质(大小、形状、化学功能和表面电荷)对其细胞毒性的影响。 总结了AuNP细胞毒性研究遇到的挑战并提出相应解决方法。
Gold nanoparticles(AuNPs) are one of ideal nanomaterials for constructing diagnostic and therapeutic nanosystems. Therefore, it is important to understand interactions of AuNPs and cells. In this review, we present a detailed analysis of data on the cytotoxicity of most popular AuNPs including gold nanoclusters(AuNCs), spherical AuNPs(AuNPss), gold nanoshells(AuNSs) and gold nanorods(AuNRs). We discuss the effects of the cell models, physicochemical properties(size, shape, chemical functionality, and surface charge) of AuNPs on the cytotoxicity of AuNPs. Some general conclusions, current challenges and future prospects/solutions on the issue have been provided.
自20世纪90年代以来,纳米技术被广泛应用到生物分析科学和化学领域并取得了重大进展[1,2,3,4,5,6,7,8,9]。 纳米粒子因具有优异的磁学、光学和电学性能而被认为是构建诊疗一体化纳米探针及纳米药物的理想材料[1,3,4,5,6,7,8,9,10,11,12,13,14]。 尽管研究表明纳米治疗技术具有高疗效和低副作用,但是纳米材料的生物安全性仍存在很多争议[14,15,16,17,18,19,20]。 与其它纳米粒子相比,金纳米粒子(AuNPs)具有可调光学性质、易通过硫-金配位实现功能化等优点,从而使基于AuNPs的诊断与治疗相结合的纳米复合物在光热治疗、分子影像、分子诊断等生物医学领域逐渐成为一类有临床应用前景的纳米药物[1,9,10,11,12,13,14,15,16,17,18,19,20,21]。 目前已有一种基于AuNPs的药物被应用于自体免疫靶向治疗临床一期(phase I)实验[15]。 由于Au是惰性化学元素,因而AuNPs被认为是最稳定的生物相容性材料之一。 然而,一些研究表明AuNP具有毒性效应,且与纳米粒子的大小、表面电荷及功能团高度相关(如图1所示)[1,16,18,19,20]。 本文通过分析最近发表的一系列有关AuNP和哺乳动物细胞相互作用的研究结果,总结了AuNPs的形貌、表面电荷及配体等对其细胞毒性的影响,并探讨了其细胞毒性机制。
 | 图1 与Au NP细胞毒性相关的物理化学性质[1,16,18,19,20]Fig.1 The AuNPs characteristics outlined here are some of the properties that determine AuNPs cytotoxicity[1,16,18,19,20] |
粒径( Dcore)在10~100 nm范围内的AuNsP能够自由进出细胞,即在膜蛋白介导下通过内吞效应进入细胞,在细胞外分泌作用下排出[16,17,22,23,24,25,26,27,28]。 AuNPs在细胞内分布以及后续的排出由其物理化学性质来界定,如柠檬酸钠或聚乙烯醇(PEG)修饰的AuNPs通常分布于细胞质中[29,30];阳离子多肽(谷胱甘肽(GSH),细胞穿透肽(CPPs))修饰的AuNPs能够进入细胞核[31,32,33,34]。 Krpetic等[32]发现CPP修饰的AuNPs能够在胞内膜屏障中自由出入,其首先进入细胞质,细胞核和线粒体,随后紧密填充在囊泡中并反复释放。 Yao等[34]考察了不同粒径的AuNPs( Dcore=15、50或100 nm)与Caco-2细胞相互作用,研究发现AuNPs在细胞内的迁移速率与其粒径有关,粒径越小迁移速率越快(如图2所示)。 并且,AuNPs能够穿过细胞膜进入特定细胞器且有可能干扰细胞器的生理功能,因此AuNPs具有潜在的细胞毒性。 研究表明,AuNPs的细胞毒性和其浓度呈正相关。 另外,采用不同的合成方法所获得的不同形貌(球形、棒状、环状、空心立方体/球体等)的AuNPs与细胞的相互作用行为也不同[3,35,36,37]。 因此,AuNPs的细胞毒性必随其浓度、几何特征而发生变化。
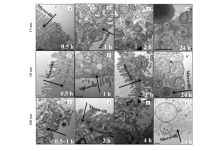 | 图2 Caco-2细胞与不同粒径的AuNPs( Dcore=15、50或100 nm)作用时间的TEM照片[34]Fig.2 TEM micrographs of the interactions of Caco-2 cells with AuNPs( Dcore=15, 50 or 100 nm) for various time periods(up to 24 h). The scale bar represents 500 nm. Images are reprinted with permission from reference[34]; Copyright(2015) American Chemical Society |
AuNPs的粒径决定其在动物体内的分布及代谢[38,39,40,41,42,43,44]。 较小的( Dcore<5 nm)AuNPs能够通过肾循环迅速排出体外;较大的( Dcore>30 nm)能够在血液循环中停留较长的时间,并在器官中富集后主要通过肝代谢[43]。 Dcore>15 nm的AuNPs在动物体内主要富集于肝、肺、脾、肾等器官,其中肝对AuNPs的富集能力最强[38,39,41,42,43,44]。 另外, Dcore<5 nm、 Dcore=15 nm和50 nm AuNP能够穿过血脑屏障(blood-brain barrier,BBB)进入脑部,这一现象对研发针对脑部疾病的纳米药物有积极意义[40,41]。
考察AuNPs细胞毒性的方法包括MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)法(测细胞代谢活动)、SYTOX red法(测细胞坏死)、LDH(lactate dehydrogenase)法(测细胞膜损伤)和Annexin V法(测细胞凋亡)等。其中,MTT法和LDH法均为比色法,是研究AuNPs细胞毒性的两种主要方法。MTT法的检测原理为:活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。 LDH法的检测原理为:当胞膜损伤时LDH快速释放到细胞培养液中并氧化乳酸盐生成丙酮酸盐,丙酮酸盐与四唑盐INT反应后生成Formazan结晶。
对于AuNPs来说,粒径( Dcore)是决定其细胞毒性强弱的基本参数。 已有研究表明,金纳米簇(AuNCs)( Dcore<2.0 nm的AuNPs)因能够穿过核膜进入到细胞核而具有显著的细胞毒性;当 Dcore>10 nm时AuNPs细胞毒性较弱并随 Dcore增大稍有增加[45,46,47]。 如早在2007年,Pan等[45]就已对不同粒径( Dcore=0.8、1.2、1.4、1.8和15 nm)的AuNPs与L929、HeLa、J774A1和SK-Mel-28等细胞的相互作用进行了研究。 研究发现,AuNPs的细胞毒性与其粒径存在依赖关系,即AuNCs的细胞毒性显著强于 Dcore>15 nm的AuNPs。 MTT法获得的不同粒径( Dcore=0.8、1.2、1.4和1.8 nm)AuNCs对不同细胞株的IC50值(半致死浓度)均小于300 μmol/L并与细胞类型密切相关[45,46]。 Vetten等[47]发现,粒径为20 nm的AuNPs对中国仓鼠卵巢(CHO)细胞的毒性略强于粒径为14 nm的AuNPs。
AuNPs形貌的不规则性及其在生物介质中的胶体稳定性等因素能够影响细胞对AuNPs的吞噬,并且不同形貌、不同分散状态的AuNPs对细胞膜、细胞器生理功能的影响也不同;因此AuNPs的形状、分散状态等物理性质也能影响其细胞毒性[34,35,48,49,50]。 Wang等[27]对不同形状的AuNPs(包括八面体(nanohexapods,核25.3 nm、臂长16.3 nm、宽13.6 nm),金纳米棒(AuNRs,长36.2 nm、宽9.1 nm),金纳米笼(外边长47.4 nm、内边长37.1 nm))的细胞毒性做了系统研究。 研究发现,AuNRs的细胞毒性最高,而nanohexapods即使在相对较高的浓度条件下(200 mg/L)仍未表现出明显的细胞毒性[27]。 最近,Wang等[48]通过主-客体系诱导AuNPs在细胞内自组装时发现,AuNPs在细胞内的聚集/组装会延长其在细胞内的停留时间从而使细胞产生的活性氧自由基增加,进而影响细胞功能导致细胞凋亡。 Albanese和Chan[49]研究发现,细胞内纳米粒子的聚集效应很难避免,AuNPs分散状态对其生物相容性的影响需要个案分析。
AuNPs的表面电荷决定了AuNPs的吞噬量及其在细胞中的分布情况[1,49,51,52,53,54,55,56,57,58,59]。 如Hauck等[51]发现,通过电解质(PE)涂层改变AuNPs表面电荷能够控制哺乳动物细胞对AuNPs的吞噬量。 尽管许多研究已经表明,荷正电的AuNP的细胞毒性大于电中性及荷负电的AuNPs,但AuNPs表面电荷与生物相容性之间的关系仍然不清楚[15,18]。 Pillai等[56]利用11-巯基十一酸(MUA)和 N, N, N-三甲基铵离子(TMA)使AuNPs相对净电荷( Qnet)从全部负电到全部正电,与Rat 2细胞相互作用后,荷正电的AuNsP容易被细胞吞噬而具有较高的细胞毒性,说明细胞对AuNPs的吞噬量取决于AuNPs的 Qnet。 Goodman等[58]考察了带不同电荷的AuNCs( Dcore=2 nm)与红细胞、COS-1细胞和大肠杆菌的相互作用,实验结果表明,荷正电的AuNC的细胞毒性大于电中性及荷负电的AuNCs。 与Goodman等的研究结果相反,Schaeublin等[55]研究 AuNCs( Dcore=1.5 nm)与HaCaT细胞相互作用时发现:1)荷正电或荷负电的AuNCs均具有细胞毒性,并且荷负电的AuNCs毒性更高; 2)电中性的AuNCs的毒性比荷电的AuNCs毒性低。 这两项研究(Goodman研究组和Schaeublin研究组)虽然使用的AuNCs尺寸相近,并且表面均经硫醇基团功能化以改变AuNCs的表面电荷,但是却得到不同的细胞毒性研究结果。 这一现象表明,表面电荷和大小相似的AuNPs的细胞毒性还与细胞类型密切相关。 Liu等[59]通过研究不同粒径( Dcore=16和58 nm)AuNPs与RAW 264细胞及HepG2细胞的相互作用也证实了上述观点。
除此之外,还要考虑粒径、表面电荷二者对细胞吞噬AuNPs的共同影响。 Jiang等[60]考察了HeLa细胞对不同粒径( Dcore=2、4和6 nm)的AuNPs吞噬作用,结果发现HeLa细胞对电中性或荷负电的AuNPs的吞噬量随AuNPs粒径的增大而减少;而细胞对荷正电的AuNPs的吞噬量随其粒径的增大而增加(如图3所示)。
 | 图3 ( A)HeLa细胞对带有不同电荷、不同粒径的AuNP的吞噬量;( B)粒径对吞噬量的影响[60]Fig.3 ( A)Cellular uptake of as-synthesized AuNPs with different size and varied surface charge by HeLa cells after 3 h incubation in serum-free media; ( B)size-dependent uptake trend of AuNPs. Images are reprinted with permission from reference 60; Copyright(2015) American Chemical Society[60] |
在AuNPs的表面修饰配体/稳定剂可以使其具有一定的靶向性,同时,配体类型还能够影响AuNPs的细胞毒性[61,62,63,64,65,66]。 如十六烷基三甲基溴化铵(CTAB)修饰的AuNRs能够显著降低PC-3细胞的增殖,而多肽YSA(N-YSAYPDSVPMMS-C)修饰的AuNRs对细胞增殖影响较弱[61]。 Kou等[63]研究了金纳米线(AuNWs)与NIH3T3细胞和HeLa细胞的相互作用,结果发现AuNWs的细胞毒性依赖于修饰到其表面的配体类型,配体对细胞的毒性作用顺序为:血清>氨基硫醇>烷基硫醇>羧基硫醇。 此外,AuNPs表面修饰靶向分子后,靶向分子对AuNPs的生物功能/生物相容性也有影响[64,65]。 生物相容性配体通常能够降低AuNPs的细胞毒性,如Deol等[66]通过配体交换或进一步功能化,将树枝状分子嫁接到谷胱甘肽修饰的AuNPs表面,能够改善其细胞毒性。
AuNPs能够与细胞内生物分子的氨基和巯基反应,对细胞功能产生影响[67,68,69,70,71,72]。 细胞内吞AuNPs后可诱导产生活性氧(ROS),影响细胞功能[67,68]。 如Gogna等[67]发现AuNPs( Dcore=10 nm和80 nm)能激活ROS介导的p53基因诱导多种细胞(MCF-7、HepG2、RKO、PC3、HCT116和H1299)凋亡和坏死。 Soenen等[68]考察了聚甲基丙烯酸修饰的AuNPs( Dcore=4 nm)在不同浓度和作用时间下对细胞活力、ROS、细胞形态、细胞骨架结构、细胞功能的影响,结果发现较高浓度(200 nmol/L)的AuNPs主要通过诱导产生ROS来降低细胞存活率。 高浓度的ROS能够导致蛋白质/酶功能失调。 如Sharma等[69]发现CH12.LX细胞内的AuNPs( Dcore=10 nm)能够与信号转导蛋白IKB激酶(IKK)结合,调节NF-κB的信号途径。 同时,AuNPs还可导致细胞形态的改变并干扰细胞器的功能。 如Soenen等[68]发现PMA修饰的AuNPs( Dcore=50 nm)使PC12细胞的轴突数量和长度显著降低,并减弱了细胞增殖和细胞分化。
理化性质(大小、形状、表面电荷、配体等)不同的AuNPs与不同类型的细胞相互作用表现出不同的生物相容性。 随着AuNPs与细胞的相互作用研究日益深入,其相关毒理学数据量不断丰富。 基于这些实验数据可获得以下几点结论:1)AuNPs可以与细胞内的生物分子如DNA和酶等共价结合;2)在AuNPs表面修饰生物相容性的配体/稳定剂(如聚甲基丙烯酸、硫醇化的PEG等)能够显著减少AuNPs的细胞毒性;3)AuNPs的细胞毒性具有浓度依赖性,浓度低于纳摩尔级的AuNPs( Dcore>5 nm)无细胞毒性;4)AuNPs的胶体稳定性和分散状态可影响其细胞毒性;5)AuNPs与细胞的相互作用不仅受AuNPs的理化性质(如形状、大小和表面电荷等)影响,还与作用的细胞类型密切相关。
但是,大量的、离散的实验设计导致产生相互矛盾的AuNPs细胞毒性数据。 为了充分揭示AuNPs的毒理学特征,迫切需要建立关于AuNsP合成及其细胞毒性评价方法的标准,以便对AuNP的毒性进行准确、系统的评估。 这一标准至少应该包括以下几点:1)标准化AuNPs的合成、功能化和纯化方法;2)标准化AuNPs与细胞相互作用的多参数测定/分析;3)标准化参照物,用于建立AuNPs物理化学参数(尺寸、形状、表面电荷、配体、浓度等)、实验设计和所观察到的细胞毒性之间的相关性;4)必须综合考虑细胞类型、细胞生长周期对AuNPs细胞毒性/生物效应的影响;5)充分考虑AuNPs在蛋白质组和基因组水平上对细胞功能的影响;6)建立新的理论计算模型和高通量筛选/分析方法,在生物分子学水平上解释AuNPs的毒性机制,获得AuNPs与生物分子的相互作用和其体内/体外毒性的相关性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|



