合成了一种新型的配合物{[Cu(Phen)(Nap)2]2·(EtOH)2·(H2O)2}(Phen=1,10-菲咯啉,Nap=1-萘甲酸,EtOH=乙醇)。 通过元素分析、红外光谱、热重等测试技术对其进行了表征,同时用X射线单晶衍射确定了其晶体结构,其配合物为双核铜结构。 利用循环伏安法和发射光谱研究了该配合物的电化学和发光性能;采用紫外光谱和荧光光谱法研究了配合物与小牛胸腺DNA( ct-DNA)的相互作用。 结果表明,配合物为不可逆氧化还原过程,其荧光发射光谱为416 nm,与小牛胸腺DNA( ct-DNA)以沟面结合方式相互作用,配合物结合常数 Kb1=4.68×103 L/mol。
A new complex [Cu(Phen)(Nap)2]2·(EtOH)2·(H2O)2(Phen=1,10-phenanthroline; Nap=1-naphthoic acid; EtOH=ethyl alcohol) was synthesized. The compound was characterized by elemental analysis, FTIR, TG-DTG, single crystal X-ray diffraction. The complex is dinuclear copper(Ⅱ) structure. The electrochemical and luminescent properties of the complex was studied by cyclic voltammetry and emission spectrum. The interactions of the complex with calf thymus DNA( ct-DNA) has been studied by UV and fluorescence spectroscopy. The results show that the copper(Ⅱ) complex shows irreversible redox process, and possesses a fluorescent emission band at 416 nm, and this copper(Ⅱ) complex binds to ct-DNA in groove binding and its intrinsic binding constant Kb is 4.68×103 L/mol.
过渡金属铜在生物生长发育中是必不可缺的微量元素,是生物体内许多酶的活性中心,具有特殊的生物功能,在体内可参与电子传递和氧化还原等一系列生命过程[1,2,3,4]。 同时,铜的配合物由于其具有特殊的性能及丰富的结构类型,在电学、磁学、光学等许多领域中表现出潜在应用价值,使铜配合物的合成、结构及性能研究成为人们关注的热点之一[5,6,7]。 由于配体邻菲罗啉和萘甲酸均具有很好的刚性平面,使其与金属离子结合有望合成性能优异发光材料,因此有关稀土萘甲酸邻菲咯啉配合物的合成及性能已有较多文献报道[8,9,10,11],而关于过渡金属萘甲酸邻菲咯啉配合物合成及性能还未见文献报道。 本文合成了一个新型的过渡金属铜萘甲酸邻菲咯啉配合物,通过红外光谱、元素分析、热重差热分析及X射线单晶衍射等技术手段对配合物进行了表征及结构分析,并研究了配合物电化学、发光性能及与小牛胸腺DNA之间的相互作用。
IRPrestige-21型红外光谱仪(日本岛津公司),PE-2400(Ⅱ)型元素分析仪(美国PE公司),Bruker SMART APEX II型单晶衍射仪(德国Bruker公司),TGA Q50型热重分析仪(美国TGA仪器公司),CHI660D型电化学工作站(上海辰华仪器有限公司),RF-5301PC型荧光分光光度计(日本岛津公司),UV-Vis8500型紫外可见分光度计(日本岛津公司),PHS-3C型酸度计(上海彭顺科学仪器有限公司)。
溴化乙锭(EB)和三羟甲基氨基甲烷(Tris)为阿拉丁试剂,小牛胸腺DNA为Sigma-Aldrich公司产品,其它试剂均为分析纯,水为超纯水。 Tris-HCl缓冲溶液pH值为7.40, c(Tris)=0.01 mol/L。 小牛胸腺DNA纯度通过比较260和280 nm处的吸光度来确定(纯DNA的 A260/ A280≈1.8,比值大于1.9时表明有RNA污染;小于1.6时表明有蛋白质、酚等污染),浓度以 ε260=6600 L/(mol·cm)确定[12]。 溴化乙锭溶液通过称取适量溴化乙锭固体,用pH=7.40的Tris-HCl(0.01 mol/L)缓冲溶液配制。
分别称取1 mmol邻菲啰啉、醋酸铜和萘甲酸和乙醇30 mL,加入50 mL圆底烧瓶中,加热至80 ℃搅拌回流反应8 h,冷却,过滤,静置,得到蓝色晶体0.220 g,产率68.3%。 元素分析实测值(计算值)/%:C 66.25(66.50),H 4.58(4.65),N 4.37(4.31)。 IR(KBr), σ/cm-1主要吸收峰:3442.94(s),3284.77(m),3053.32(m),2962.66(m),2891.30(m),1622.13(s),1606.70(s),1566.20(m),1519.91(m),1429.25(m),1352.10(s),1257.59(w),1088(w),1043.49(w),848.68(m),798.53(s),719.45(s),661.58(w),530.42(w),516.92(w),430.13(w)。
选取尺寸为0.25 mm×0.22 mm×0.21 mm配合物晶体,在单晶衍射仪上,采用经石墨单色化的Mo Kα射线( λ=0.071073 nm),于296(2) K,以 φ~ω扫描方式收集数据。 全部数据经Lp因子和经验吸收校正。 晶体结构由直接法解出,除水上的氢原子和乙醇羟基上的氢原子外,其余氢原子均为理论加氢。 水上的氢原子和乙醇羟基上的氢原子通过差值Fourier 合成得到。 对氢原子和非氢原子分别采用各向同性和各向异性热参数进行全矩阵最小二乘法修正。 全部结构分析计算工作采用SHEXTL-97程序系统[13]完成。 配合物的晶体学数据和结构精修参数列于表1。 CCDC:1409877。
| 表1 配合物的晶体学参数 Table 1 Crystallographlic date of the complex |
1.4.1 紫外吸收光谱 用Tris-HCl缓冲液配制一系列试样,固定配合物的浓度为32 μmol/L,使ct-DNA的浓度分别为0、16、31、47、63、79、94、110、126、142和157 μmol/L。 分别以缓冲液或相应浓度的DNA作空白,在紫外可见光谱仪的双光路系统中,在240~340 nm范围内测定配合物的吸收光谱。
1.4.2 荧光发射光谱 用Tris-HCl缓冲液配制一系列试样,固定ct-DNA的浓度为30 μmol/L,EB浓度为3 μmol/L,配合物的浓度分别为0、5、10、20、30、40、50、60、70和80 μmol/L。 仪器条件:狭缝宽度 Ex=3 nm、 Em=5.0 nm;激发波长260 nm;发射波长范围:535~720 nm,测定其荧光发射光谱。
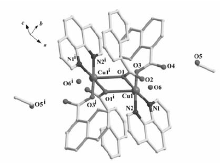
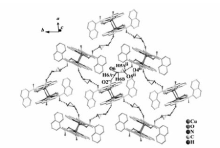
配合物的主要键长和键角见表2,配合物的分子结构如图1所示。 由图1可知,配合物分子中的4个原子Cu1、O1、Cu1i,O1i构成四元环近似平面。 该配合物为Cu离子、邻菲罗啉和萘甲酸根形成的双配体双核Cu(Ⅱ)配合物,其中以Cu(Ⅱ)离子作为中心离子,通过萘甲酸根单齿桥联。 在配合物中每1个Cu(Ⅱ)离子为五配位的结构,分别与来自3个萘甲酸根的3个O原子以及1个邻菲罗啉的2个N原子配位,形成了畸变的四方锥结构。 在此四方锥结构中,N1—Cu1—N2、O3—Cu1—N1、O1—Cu1—O3和O1—Cu1—N2的键角分别为:81.69(19)°、91.20(18)°、89.64(16)° 和97.48(17)°,其加和的总键角为360.01°,说明Cu1、N1、O1、N2、O2几乎在同一个平面,形成了四方锥的底面。 O1i即为该四方锥的锥顶,O1i—Cu1—O3、O1i—Cu1—N2、O1i—Cu1—N1、O1i—Cu1—O1的键角分别为85.90°、96.26°、111.80°、74.17°,与90°偏离均较大,表明该四方锥发生了畸变。 此外,从Cu离子5个配位键的键长数据发现,Cu—N的键长以及Cu—O的键长均在正常的配位键的键长范围之内,与文献[14]报道基本一致。 另外,分子结构中通过乙醇和水分子的氢键作用形成了二维网状结构,如图2所示。
| 表2 配合物的主要键长(nm)和键角(°) Table 2 Seleeted of bond lengths(nm) and bond angles(°) of complex |
| 表3 配合物的氢键数据 Table 3 Parameters of hydrogen bonding interactions in complex |
在配合物红外图谱中,萘甲酸的C=O伸缩振动尖锐吸收峰1674 cm-1和O—H弥散的伸缩振动吸收峰2623~3100 cm-1均消失,说明萘甲酸的羧酸基团已脱去氢质子。 在1607和1352 cm-1出现了新的尖锐吸收峰,分别为萘甲酸根上COO-基团的反对称伸缩振动( νas)和对称伸缩振动( νs)特征吸收峰,其峰值差Δ ν为255 cm-1,表明萘甲酸的羧酸基团脱去氢质子以羧基氧原子与Cu(Ⅱ)离子发生了单齿配位[15]。 自由配体邻菲罗啉的特征吸收峰C=N的伸缩振动峰1560 cm-1和C—H面外弯曲振动854、739 cm-1,分别红移至1520、849和719 cm-1,表明邻菲罗啉中的两个N原子同时参与配位[16]。
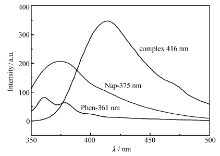
为了检测配体和配合物的发光特性,以甲醇为溶剂配制溶液,在室温下,测试了配体和配合物的激发光谱和发射光谱。 其中配体萘甲酸和邻菲罗啉及配合物的荧光发射光谱如图3所示,可知配体和配合物均具有一定的发光性能。 配体萘甲酸和邻菲罗啉分别在339和340 nm最大激发波长下, 在375和361 nm出现了最大发射波长;而配合物在320 nm最大激发波长下,在416 nm出现了最大发射波长。 配合物与配体荧光发射峰相比,位置及形状都发生了变化,可能是由于配体与金属离子发生配位,配合物的荧光发射峰可能主要归属于配体到金属的电荷转移(LMCT)[17,18]。
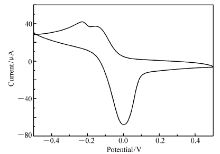
采用三电极体系,玻碳电极为工作电极、铂电极为辅助电极、SCE为参比电极,以水为溶剂,配合物的浓度为1×10-6 mol/L,2 mol/L的KCl溶液为支持电解质,对配合物进行扫描,以100 mV/s扫描速度在-0.50~0.50 V范围内进行循环伏安扫描。 从循环伏安曲线图形来看,配合物有一对氧化还原峰,其峰电位分别为0.004和-0.220 V,峰电流分别为 69.19和 35.30 μA。 因 ipa/ ipc≠1,由此说明该配合物的电解过程为不可逆过程[19]。
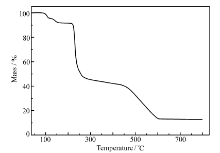
在空气的氛围下,升温速度20 ℃/min,热重分析图(图5)表明,从40~800 ℃的过程经历了4次失重,对应的可能分别是乙醇分子、水分子、萘甲羧基和邻菲罗啉配体的失去。 到600 ℃以后趋于恒重,残重为12.84%,假设配合物剩余残留物是CuO,与其理论值(12.23%)基本吻合。 这与配合物X单晶衍射的结构大致相符。
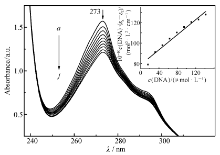
2.6.1 紫外吸收光谱图6为一定浓度的配合物溶液中加入不同浓度的DNA时测定的紫外吸收光谱。 由图6可知,随着ct-DNA浓度的增大,紫外吸收光谱发生明显的减色效应,浓度增大,减色效应增强。
为了定量研究配合物与DNA的结合强度,由方程 c(DNA)/( εa- εf)= c(DNA)/( εb- εf)+1/[ Kb( εb- εf)]作图[20],求出配合物和DNA的结合常数 Kb, Kb=4.68×103 L/mol,远小于以经典插入模式与DNA 结合的EB( Kb=3.3×105 L/mol) ,并且红移效应不太明显,由此可见,配合物可能不是主要以插入模式与DNA作用。
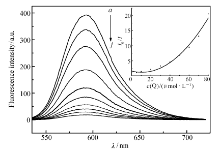
2.6.2 配合物对EB-DNA体系荧光光谱的影响图7为不同浓度的配合物对EB-DNA复合体系的荧光猝灭曲线。 加入配合物后,DNA-EB体系的荧光明显降低,说明配合物的存在使DNA-EB体系的荧光产生了猝灭,根据Stern-Volmer校正方程[21]: I0 /I=1 +( KSV+ K) cQ+ KSV K
本文合成了一个新的双核Cu(Ⅱ)配合物{[Cu(Phen)(Nap)2]2·(EtOH)2·(H2O)2},用X单晶衍射方法得到了其结构。 其性质测试结构表明:1)配合物在320 nm的激发波长下荧光最大发射波长为416 nm;2)通过循环伏安法测试配合物为不可逆氧化还原过程;3)配合物与DNA分子属于沟面结合作用方式,与EB-DNA复合体系的作用属于动态和静态联合猝灭。 这些性质结果为铜配合物在光学、电学、生物学等领域的应用提供了参考数据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|