以2-吡咯甲酰肼与2,4-二羟基苯甲醛和2-羟基-3-甲氧基苯甲醛经缩合反应合成2,4-二羟基苯甲醛-2-吡咯甲酰腙C12H11N3O3(Ⅰ)和2-羟基-3-甲氧基苯甲醛-2-吡咯甲酰腙C13H15N3O4(Ⅱ),并利用红外光谱、元素分析、1H NMR、X射线单晶衍射和热重分析进行表征,结果表明晶体Ⅰ属单斜晶系,空间群为P21/c, Z=4,晶胞参数为 a=1.2586(4) nm, b=0.8050(3) nm, c=1.1914(4) nm;晶体Ⅱ为正交晶系,空间群为P212121, Z=4,晶胞参数为 a=0.4756(2) nm, b=1.2491(6) nm, c=2.2145(11) nm。 热重结果显示,化合物Ⅰ和Ⅱ最大热分解峰分别出现在267.59和284.79 ℃,表观活化能分别为176.6和122.9 kJ/mol,表明化合物Ⅰ和Ⅱ具有较高的热稳定性。 利用粘度实验和微量热实验研究了化合物Ⅰ和Ⅱ与CT-DNA的相互作用,均显示两种化合物均与CT-DNA发生了插入作用,且相互作用过程放热,焓变值分别为Δ H(Ⅰ)=4.67 kJ/mol和Δ H(Ⅱ)=4.40 kJ/mol。
Two hydrazone componds( E) -N'-(2,4-dihydroxybenzylidene)-pyrrole-2-carbohydrazide C12H11N3O3(Ⅰ) and ( E) -N'-(2-hydroxy-3-methoxybenzylidene)-pyrrole-2-carbohydrazide C13H14N3O4(Ⅱ) have been synthesized from 2,4-dihydroxybenzaldehyde and 2-hydroxy-3-methoxybenzaldehyde with pyrrole-2-carbohydrazide, respectively. The compounds have been characterized by IR spectroscopy, elemental analysis,1H NMR spectroscopy, single-crystal X-ray diffraction and thermogravimetric analysis. The crystal of compound Ⅰ belonged to monoclinic crystal lattice, space group P21/c, Z=4, with unit cell parameters a=1.2586(4) nm, b=0.8050(3) nm, c=1.1914(4) nm, and compound Ⅱ crystallized in the orthorhombic system, space group P212121, Z=4, with unit cell parameters a=0.4756(2) nm, b=1.2491(6) nm, c=2.2145(11) nm. The TG-DTG result shows that the compounds Ⅰ and Ⅱ display good thermal stability, the maximum decomposition peaks are at the temperature of 267.59 ℃ and 284.79 ℃, and their apparent activation energy values are 176.6 kJ/mol and 122.9 kJ/mol, respectively. The thermogenic curves of the compounds Ⅰ and Ⅱ reacting with calf thymus DNA(CT-DNA) measured by viscosity and microcalorimetry, indicate that the interactions of compounds Ⅰ and Ⅱ with CT-DNA belong to the intercalation mode, and the interacting processes are all endothermic, their enthalpies are Δ H(Ⅰ)=4.67 kJ/mol and Δ H(Ⅱ)=4.40 kJ/mol, respectively.
吡咯及其衍生物是一类重要的五元杂环化合物,大多数具有杀虫、抗菌、消炎、抗病毒及抗肿瘤等生物和药物活性[1,2,3,4,5]。 吡咯环中的N原子可参与生物体中氢键的形成,增强药物与受体细胞的作用力[6]。 酰腙化合物含(CH—CONHN)基团,表现出良好的杀菌、抗肿瘤和抗病毒等生理作用[7,8,9,10,11,12]。 因此,若将吡咯环引入酰腙化合物中,实现两类活性基团的叠加,可望得到具有独特抑菌活性的新化合物。
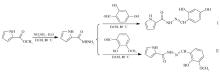
本文以2-吡咯甲酰肼与2,4-二羟基苯甲醛和2-羟基-3-甲氧基苯甲醛经缩合反应合成2,4-二羟基苯甲醛-2-吡咯甲酰腙C12H11N3O3(Ⅰ)和2-羟基-3-甲氧基苯甲醛-2-吡咯甲酰腙C13H15N3O4(Ⅱ),通过溶剂挥发法,在乙醇溶液中培养出单晶,合成路线见Scheme 1。 通过红外光谱、元素分析、1H NMR、X射线单晶衍射对晶体Ⅰ和Ⅱ进行结构表征,采用热重技术分析它们的热稳定性,利用粘度实验和微量热实验探究两种化合物与小牛胸腺DNA(CT-DNA)的相互作用。
Perkin-Elmer 2400-II型元素分析仪(美国铂金-艾尔默公司);Bruker TensorⅡ型傅里叶红外光谱仪(德国布鲁克公司);Bruker Avance-400 MHz型核磁共振仪(瑞士布鲁克公司);Bruker APEX-Ⅱ型CCD单晶衍射仪(德国布鲁克公司);Mettler Toledo TG-DSC1型热重分析仪(瑞士梅特勒公司);Setaram C80型微量热计(德国塞塔拉姆公司);乌氏粘度计0.5~0.6 mm(上海良晶玻璃仪器厂)。
2-吡咯甲酸甲酯购自上海TCI公司,2,4-二羟基苯甲醛和2-羟基-3-甲氧基苯甲醛购自上海J&K公司,小牛胸腺DNA购自美国Sigma公司;其它所用的化学试剂均为市售分析纯,使用前未经处理。
1.2.1 2-吡咯甲酰肼的合成 将0.2742 g(2 mmol)2-吡咯甲酸甲酯溶于5 mL无水乙醇中,加热搅拌使其完全溶解,然后逐滴滴入5 mL水合肼,溶液略带淡棕色,透明,在80 ℃水浴加热搅拌下回流2.5 h,使其完全反应,静置2 d出现白色晶体2-吡咯甲酰肼[13]。 过滤该晶体,抽滤、烘干,用无水乙醇重结晶,得到白色针状晶体。 产率75.2%,熔点225~227 ℃。 元素分析测试值/%:C 48.00,N 33.60,H 5.56;计算值/%:C 47.95,N 33.56,H 5.59。 IR(ATR), σ/cm-1:3301,3198,3138,3052,2933,2837,1622,1560,1499,1336,848,588;1H NMR(DMSO-d6,400 MHZ), δ:11.45(s,1H,C—NH),9.25(s,1H,NH),6.85~6.05(m,3H,Pyrrole-H),4.31(s,2H,NH2)。
1.2.2 化合物Ⅰ的合成 称取2-吡咯甲酰肼0.0125 g(0.1 mmol),将其溶于无水乙醇中,加热搅拌溶解后溶液呈无色透明,再将2,4-二羟基苯甲醛0.0138 g(0.1 mmol)溶于乙醇中并缓慢加入2-吡咯甲酰肼溶液中,溶液为淡黄色、透明,在80 ℃水浴加热搅拌下回流2.5 h,使其完全反应,静置3 d后出现淡黄色片状晶体。 产率90.9%,熔点269~271 ℃。 元素分析测试值/%:C 58.67,N 19.25,H 4.35;计算值/%:C 58.72,N 17.13,H 4.49。 IR(ATR), σ/cm-1:3418,3320,3219,3143,1626,1549,1510,1407,1315,1097,853,736,675;1H NMR(DMSO-d6,400 MHZ), δ:11.72~11.49(q,3H,OH),9.90(s,1H,NH),8.41(s,1H,N=CH),7.30~6.94(m,3H,Ar—H),6.37~6.17(m,3H,Pyrrole-H)。
1.2.3 化合物Ⅱ的合成 化合物Ⅱ的合成方法与化合物Ⅰ相似,只需要将2,4-二羟基苯甲醛替换成2-羟基-3-甲氧基苯甲醛,得到淡黄色针状晶体。 产率85.9%,熔点237~239 ℃。 元素分析测试值/%:C 60.23,N 18.53,H 5.01;计算值/%:C 60.17,N 16.20,H 5.79。 IR(ATR), σ/cm-1:3540,3361,3255,1555,1464,1407,1311,1250,1184,1133,838,726,600;1H NMR(DMSO-d6,400 MHZ), δ:11.78~11.71(t,2H,OH),11.40(s,1H,NH),8.55(s,1H, N=CH),7.14~7.03(m,3H,Ar—H),7.01~6.84(m,3H,Pyrrole-H),3.84~3.82(t,3H,OCH3)。
选取尺寸为0.31 mm×0.25 mm×0.14 mm的晶体Ⅰ和尺寸为0.36 mm×0.25 mm×0.14 mm的晶体Ⅰ分别置于Bruker APEX-Ⅱ CCD单晶衍射仪上,用经石墨单色器单色化的Mo- Kα射线( λ=0.071 073 nm)在296(2) K下收集数据,分别收集5587和6659个独立衍射点。 晶体结构采用SHELXL-97程序[14]由直接法解出,对非氢原子各向异性温度因子用全矩阵最小二乘法修正。
准确称取(10.0±0.05) mg的化合物放入氧化铝坩埚内,在Mettler Toledo TG-DSC1热重分析仪上测定化合物的热分解过程,实验条件为室温至800 ℃,N2气气氛,升温速率分别为5.00、10.00和15.00 ℃/min。
在温度恒定为(25±0.1) ℃的水浴锅中测定化合物与CT-DNA溶液的粘度。 在粘度计中加入10 mL用缓冲溶液配制的浓度为1.84×10-4 mol/L CT-DNA溶液,之后依次加入一定量的化合物,分别记录混合液流经毛细管的时间。 溶液的相对粘度[15]根据式(1)计算:
式中, t为化合物与CT-DNA溶液(含浓度不等的化合物)流经毛细管所需时间, t0为缓冲溶液流经毛细管所需时间。 以( η/η0)1/3对结合比率 r=ccompound/ cDNA作图, η0为未加化合物时CT-DNA溶液的相对粘度, η为加入化合物时CT-DNA溶液的相对粘度。
向参比池下层加入2 mL缓冲溶液,上层加入1 mL CT-DNA溶液;样品池下层加入2 mL样品溶液(化合物Ⅰ或Ⅱ),上层加入1 mL CT-DNA溶液,在25 ℃下,用C80微量热计测量并记录化合物与CT-DNA作用的热量变化。
化合物的晶体学数据见表1。 如表1所示,晶体Ⅰ属单斜晶系,空间群为P21/c,晶胞参数为 a=1.2586(4) nm, b=0.8050(3) nm, c=1.1914(4) nm, α=90°, β=107.374(7)°, γ=90°, Z =4;晶体Ⅱ为正交晶系,空间群为P212121,晶胞参数为 a=0.4756(2) nm, b=1.2491(6) nm, c=2.2145(11) nm, α=90°, β=90°, γ=90°, Z=4。
| 表1 化合物的晶体学参数 Table 1 Crystallographic data for compounds |
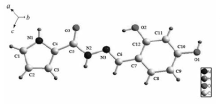
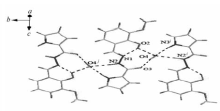
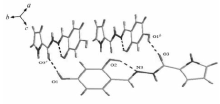
图1、2分别为化合物Ⅰ的分子结构和氢键图,化合物Ⅰ的键长、键角及其氢键键长和键角分别见表2和表3。 如图1所示,化合物Ⅰ分子由活性亚结构(—CONHN=CH—)连接吡咯环和苯环,两环间的二面角为8.4°,表明两环几乎处在同一平面上。 扭转角N3—N2—C5—O3、C5—N2—N3—C6和N2—N3—C6—C7分别为-0.4(4)°、179.0(2)°和179.5(2)°,表明环平面的扭曲程度不明显,环原子的共面性较好。 O3—C5的键长为0.1234 nm,是典型的C=O双键,证明化合物是以酮羰基形式存在。 N3—C6的键长为0.1285 nm,位于C=N双键的键长范围内[16]。 此外,N2—C5的键长介于C—N单双键键长之间,这是因为—NH—C=O与—N=C—OH之间产生了共振。 从图2可以看出,化合物Ⅰ晶体中存在两类氢键,分别是分子内氢键和分子间氢键。 苯酚羟基中的O2与—N=CH—中的N3形成分子内氢键O2—H2A≡N3,O2—H2A距离为0.0820 nm,H2A••••N3距离为0.1949 nm,O2—H2A••••N3的键角为146.4°。 苯酚4位上—OH的O1与相邻分子—CONH—中的O3(1- x,0.5 +y,-0.5 -z)形成分子间氢键O1—H1A••••O3,其中O1—H1A的距离为0.0820 nm, H1A••••O3的距离为1.9118 nm, O1—H1A••••O3的键角为149.4°。 环骨架上—C=O的O3与另外一个相邻分子苯酚4位上的O1(1- x,-0.5 +y,-0.5 -z)形成分子间氢键,氢键的键长、键角与O1—H1A••••O3相同。
 | 图2 化合物Ⅰ晶体的氢键图Fig.2 View of the hydrogen bonds of crystal ⅠSymetry code: a.1 -x, 0.5 +y, -0.5 -z; b.1 -x, -0.5 +y, -0.5 -z |
| 表2 化合物的主要键长(nm)、键角和扭转角(°) Table 2 Selected geometrical parameters(nm, °) for compounds |
| 表3 化合物的氢键键长(nm)和键角(°) Table 3 Hydrogen bond lengths(nm) and bond angles(°) for compounds |
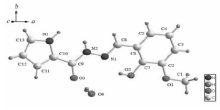
图3、4分别为化合物Ⅱ的分子结构和氢键图,化合物Ⅱ的键长、键角及其氢键键长和键角分别见表2、表3。 从图3可看出, 化合物Ⅱ的吡咯环与苯环间的二面角为11.8°,比化合物Ⅰ的共面性稍差一些。 N1—C8的键长为0.1282 nm,与化合物Ⅰ中N3—C6类似。 从图4可以看出,化合物Ⅱ中含有一个结晶水分子,水分子以分子间氢键形式连接相邻两个分子。 苯酚2位羟基上的O2与结晶水中的O4形成分子间氢键O2—H2A••••O4,O2—H2A距离为0.0820 nm, H2A—O4距离为0.2557 nm, O2—H2A••••O4键角为114.5°;环骨架—C=O上的O3与结晶水中的O4形成分子间氢键O4—H4A••••O3,O4—H4A距离为0.0826 nm, H4A••••O3距离为0.1834 nm, O4—H4A••••O3键角为174.6°;相邻分子中吡咯环上N3(1- x,0.5+y,0.5-z)与结晶水中的O4形成分子间氢键N3—H3A••••O4,N3—H3A距离为0.0964 nm, H3A••••O4距离为0.1941 nm, N3—H3A••••O4键角为167.1°;相邻分子中—NH—上N2(1- x,0.5 +y,0.5 -z)与结晶水中的O4形成分子间氢键N2—H2••••O4,其中N2—H2距离为0.0860 nm, H2—O4距离为0.2007 nm, N2—H2••••O4键角为174.8°。 苯酚羟基上的O2与CH—NHN中的N1形成分子内氢键O2—H2A••••N1,其中O2—H2A距离为0.0820 nm,H2A••••N1距离为0.1960 nm, O2—H2A••••N1键角为144.5°。
在化合物Ⅰ的红外光谱中,3418 cm-1处为—OH的吸收峰,3320 cm-1出现中等尖锐的—NH—吸收峰,3219、3143 cm-1属—CONH—中—NH的伸缩振动。 1626和1549 cm-1处分别为—C=O和—C=N的伸缩振动。 1510 cm-1处为NH的伸缩振动,1407和1315 cm-1属Ar—OH的伸缩振动。 在化合物Ⅱ中,结晶水的伸缩振动出现在3540 cm-1处,3361、3255 cm-1处分别属—OH和—NH的伸缩振动。 1555 cm-1处为—C=O的伸缩振动,1464 cm-1属—CH3的伸缩振动。
在1H NMR谱中,化合物Ⅰ和Ⅱ以烯醇式结构存在于配体中。 化合物Ⅰ和Ⅱ的—OH质子峰分别出现在 δ 11.72~11.49和11.78~11.71间;NH的质子峰出现在分别 δ 9.90和11.40处,N=CH质子峰出现在 δ 8.41和8.55处,且NH和N=CH的质子峰均为单峰;苯环上质子峰出现在 δ 7.30~6.94范围;吡咯环上质子峰则出现在 δ 7.01~6.17区域。
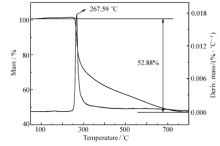
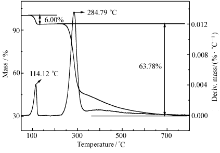
化合物Ⅰ和Ⅱ在5.00 ℃/min 的TG-DTG曲线分别如图5和图6所示,10.00和15.00 ℃/min的TG-DTG曲线与图5和6相似。 从图5可知,化合物Ⅰ的热分解过程为一个阶段,发生在237~398 ℃之间,最大热分解峰出现在267.59 ℃,质量损失为52.28%,失去基团为(—C6H6N3O—)。 由图6可知,化合物Ⅱ热分解过程分两个阶段,第一阶段在74~139 ℃范围内,质量损失为6.00%,最大热分解峰出现在114.12 ℃,该阶段是结合水的蒸发;第二阶段发生在214~369 ℃之间,质量损失为63.78%,最大热分解峰出现在284.79 ℃,损失基团为(—C9H8N2O3—)。 化合物Ⅰ和Ⅱ的主要分解基团推断结果如图7所示,每个化合物在热分解过程中的断键位置与热重实验结果基本一致。
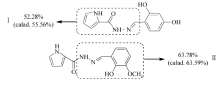 | 图7 化合物Ⅰ和Ⅱ在热分解过程中的分解基团Fig.7 Illustration of main thermal decomposition processes for compounds Ⅰ and Ⅱ |
采用Kissinger法和Ozawa法[17]计算化合物热分解过程的表观活化能,计算公式如式(2)、(3)所示:
式中, Tp为分解峰峰顶温度值, A为指前因子, R为气体摩尔常数, Ea为表观活化能, β为升温速率, G( α)为积分机理函数。
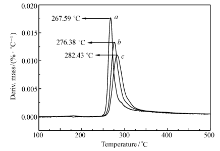
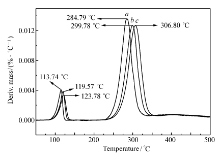
图8和9分别为化合物Ⅰ和Ⅱ在3个不同升温速率 β的DTG曲线,利用式(2)和(3),即可求得化合物Ⅰ和Ⅱ的指前因子(lg A)、线性相关系数( r)和表观活化能( Ea),计算结果见表4。 从表4可以看出,两种计算方法得到的结果基本相同。 化合物Ⅰ的分解温度高于267 ℃,表观活化能为176.6 kJ/mol。 化合物Ⅱ的分解温度高于284 ℃,表观活化能为122.9 kJ/mol,表明化合物Ⅰ和Ⅱ均具有较好的热稳定性。
| 表4 化合物主要热分解过程动力学参数 Table 4 Kinetic parameters of main thermal decomposition of compounds |
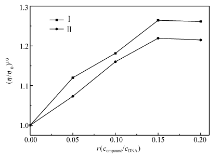
从图10可以看出,随着化合物Ⅰ和Ⅱ的浓度的增加,CT-DNA溶液的相对粘度升高,说明化合物Ⅰ和Ⅱ以插入方式均与CT-DNA作用。 这是由于为了容纳化合物Ⅰ或Ⅱ,CT-DNA相邻碱基对间的距离增大,双螺旋长度增长,导致CT-DNA的粘度增加[18]。
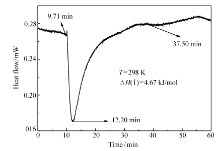
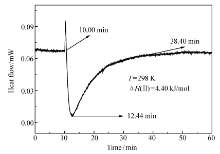
图11、12分别为化合物Ⅰ和Ⅱ与CT-DNA相互作用的热谱曲线,可以看出两个反应均为吸热过程。 化合物Ⅰ从 9.71 min开始到37.50 min平衡,反应时长为27.79 min,反应热流值在12.20 min时达到最大;化合物Ⅱ与CT-DNA 的相互作用趋势和化合物Ⅰ相似,它的反应时长为28.40 min,表明化合物Ⅰ和Ⅱ与CT-DNA的相互作用十分迅速。 化合物Ⅰ和Ⅱ的焓变值分别为Δ H(Ⅰ)=4.67 kJ/mol和Δ H(Ⅱ)=4.40 kJ/mol,表明化合物Ⅰ和Ⅱ与CT-DNA的作用主要以插入模式为主[19],与粘度实验的结果相一致。
1)采用溶剂挥发法在乙醇溶液中培养出2,4-二羟基苯甲醛-2-吡咯甲酰腙单晶C12H11N3O3(Ⅰ)和2-羟基-3-甲氧基苯甲醛-2-吡咯甲酰腙单晶C13H15N3O4(Ⅱ);2)X射线单晶衍射结果显示,晶体Ⅰ为单斜晶系,Ⅱ为斜方晶系。 每个晶胞中含有4个分子;3)热重分析说明,化合物Ⅰ和Ⅱ最大热分解峰温分别出现在267.59和284.79 ℃,表观活化能分别为176.6和122.9 kJ/mol,表明化合物Ⅰ和Ⅱ具有很好的热稳定性;4)利用粘度实验和微量热实验研究了化合物Ⅰ和Ⅱ与CT-DNA的相互作用,均显示两种化合物均与CT-DNA发生了插入作用,且相互作用过程放热,焓变值分别为Δ H(Ⅰ)=4.67 kJ/mol和Δ H(Ⅱ)= 4.40 kJ/mol。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|