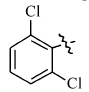
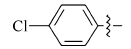
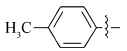
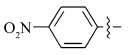
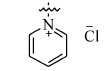
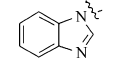
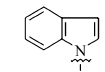
在微波辅助下,1,3-二甲基-5-醛基巴比妥酸与芳氧基/芳胺基乙酰肼及含氮杂环乙酰肼缩合制备新型酰腙化合物,并对其抑菌活性进行评价的研究。 新化合物的结构经过元素分析、红外光谱、核磁共振谱、质谱和X射线单晶衍射等技术手段确认。 体外的抑菌活性实验显示,部分目标化合物呈现出优于环丙沙星的抑菌活性。 经过构效关系分析表明,当芳基为含氮杂环时,所形成的化合物抗菌活性与芳基为苯环时相比明显较强,抑菌活性最强的酰腙化合物2t对金黄色葡萄球菌的最小抑菌浓度(MIC)值为0.8 g/L,对大肠杆菌的最小抑菌浓度(MIC)值为1.6 g/L。
A series of novel acylhydrazone compounds was synthesized by a simple and efficient condensation of 1,3-dimethy-5-formyllbarbituric acids with aryloxy/arylamino acetylhydrazides and nitrogen-containing heterocyclic acetylhydrazides under microwave irradiation. The structures of all new compounds were confirmed by elemental analysis, IR,1H NMR, mass spectrometry and single-crystal X-ray diffraction analysis. In vitro antimicrobial activity evaluation results show that some of the target compounds exhibit superior antimicrobial activities compared with ciprofloxacin. Structure-activity relationship analysis shows that when the aryl group is a nitrogen-containing heterocyclic compound, its antibacterial activity is significantly stronger than that of a benzene ring compound. One of target compounds 2t shows the strongest activities against S.Aureus with the minimum inhibitory concentration(MIC) of 0.8 g/L and against E.Coli with the MIC of 1.6 g/L.
巴比妥酸及其衍生物是一类具有重要生理活性的嘧啶酮杂环化合物[1,2],巴比妥酸分子内含有富电子的氮氧杂原子及共轭体系,具有强分子内电子离域能力,其嘧啶环上为烷基、芳基、杂芳基取代的衍生物具有抗痉挛[3,4]、抗焦虑[5]、抗氧化[6]、止痛[7]、安眠[8]、抑菌[9,10]及抗病毒[11,12]等生物活性。 芳香乙酰肼是一类具有较高反应活性的化合物,可以用作药物、高聚物、染料和照相材料等许多重要材料的前体和有机中间体[13],并且其参与形成的化合物具有广谱的生物活性[14,15,16]。 酰腙化合物中含有一类很好的活性单元CONHN=C,被大量用作抗病毒[17]、抑菌[18,19]、抗癌[20]、抗肿瘤[21]、抗白血病[22]等生物活性分子的结构组分,是目前药物研究领域的热点之一。 为了合成具有高抑菌活性的先导化合物,在微波辅助合成下,本文将含不同取代基的苯氧、苯胺乙酰肼以及吲哚、吡啶、咔唑等含氮杂环乙酰肼与1,3-二甲基-5-醛基巴比妥酸缩合,设计合成一系列结构新颖的巴比妥酸芳香乙酰腙化合物,同时讨论了这些化合物结构与活性的关系,并评价了目标化合物对4种细菌的抑制活性。目标物合成路线见Scheme 1。
1,3-二甲基-5-醛基巴比妥酸按文献[10]合成。 大肠杆菌( E.coli)、金黄色葡萄球菌( S.aureus)、铜绿假单胞菌( P.aeruginosa)、萎缩芽孢杆菌( B.atrophaeus)购自江苏无锡赛维科技有限公司;其余试剂均为市售分析纯。
Discover型单模微波合成仪(美国CEM公司);X-5型双目显微熔点测定仪(北京泰克仪器有限公司),温度计未经校正;Ascend-400 MHz型核磁共振仪(德国Bruker公司),DMSO-d6为溶剂,TMS为内标;ZAB-HS型质谱仪(英国VG公司);1700型傅里叶变换红外光谱仪测定(美国PE公司),KBr压片;Smart APEX II型单晶X射线衍射仪(德国Bruker公司);Vario EL型元素分析仪(德国Elementar公司);GF254硅胶薄层板(武汉药物科技有限公司)。
1.2.1 中间体1的合成 以化合物1a的合成为例:将1.94 g(10 mmol)2-甲基苯氧乙酸乙酯加入到盛有10 mL 80%水合肼的35 mL微波反应管中,然后将反应管转移到微波合成仪中,在250 W的微波功率下反应45 s。 TLC( V(乙醇): V(乙酸乙酯)=1:4为展开剂)检测显示反应完毕,冷却至室温,有大量白色固体产生,过滤,用H2O-EtOH(体积比1:1)重结晶,得到2.85 g白色片状晶体1a,产率82.4%。 同样方法制得化合物1b~1j,其物理化学数据见表1。
| 表1 化合物1a~1t的物理化学数据 Table 1 Physicochemical data of compounds 1a~1t |
1.2.2 目标物2的微波合成 以化合物2a的合成为例:将0.90 g(5 mmol)化合物1a加入到盛有0.92 g(5 mmol)1,3-二甲基-5-醛基巴比妥酸和10 mL甲醇溶液的35 ml微波反应管中,再加入催化剂量的冰乙酸后,将反应管转移到微波合成仪中,在200 W的微波功率下反应80 s。 TLC( V(甲醇): V(乙酸乙酯)=1:2为展开剂)检测显示反应完毕,冷却至室温,过滤,用DMF-EtOH(体积比1:2)重结晶,得到化合物2a,1.47 g(产率85%)。 同样方法制得化合物2b~2t。
5-(2-甲基)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2a):白色片状晶体,1.47 g(产率85%),mp 205~207℃;1H NMR(DMSO-d6,400 MHz), δ:11.41(d,2H),8.13(s,1H),7.18(d, J=7.6 Hz,2H),6.92(d, J=7.8 Hz,2H),4.70(s,2H),3.17(d,6H),2.26(s,3H);IR(KBr), σ/cm-1:3241,3022,2924,1717,1641,1592,1475,1459;ESI-MS:347.2[M+H]+。 元素分析C16H18N4O5测定值(计算值)/%:C 55.26(55.49),H 5.27(5.24),N 16.35(16.18)。
5-(2-硝基)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2b):黄色固体,1.55 g(产率82%),mp 212~214 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.41(s,2H),8.09(s,1H),7.92(dd, J=8.1Hz,1H),7.74~7.56(m,1H),7.44~7.27(m,1H),7.18(t, J=7.7 Hz,1H),4.91(s,2H),3.15(s,6H);IR(KBr), σ/cm-1:3344,3221,1716,1645,1606,1584,1481;ESI-MS: m/z 378.2 [M+H]+。 元素分析C15H15N5O7测定值(计算值)/%:C 47.71( 47.75),H 4.12( 4.01),N 18.39(18.56)。
5-(2,6-二氯)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2c):白色固体,1.72 g(产率86%),mp 209~211 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.78(s,1H),11.61(d, J=12.2 Hz,1H),8.18(d, J=11.8 Hz,1H),7.55(dd, J=8.1,2H),7.26(t, J=8.1 Hz,1H),4.63(s,2H),3.17(d,6H);IR(KBr), σ/cm-1:3205,3020,1687,1651,1634,1608,1477,1456;ESI-MS:402.1[M+H]+。 元素分析C15H14Cl2N4O5测定值(计算值)/%:C 44.79(44.91),H 3.51(3.52),N 13.89(13.96)。
5-(4-氯)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2d):白色固体,1.44 g(产率79%),mp 198~200 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.49(s,2H),8.14(s,1H),7.36(d, J=8.9 Hz,2H),7.04(d, J=8.9 Hz,2H),4.70(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3168,3092,1687,1636,1608,1494;ESI-MS:367.2[M+H]+。 元素分析C15H15ClN4O5测定值(计算值)/%:C 49.23(49.12),H 4.15( 4.12),N 15.19(15.28)。
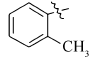
5-(4-甲基)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2e):白色晶体,1.38 g(产率81%),mp 167~169 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.53(s,2H),8.14(s,1H),7.12(d, J=8.2 Hz,2H),6.90(d, J=8.6 Hz,2H),4.64(s,2H),3.16(s,6H),2.24(s,3H);IR(KBr), σ/cm-1:3221,3031,1685,1650,1636,1606 ,1499;ESI-MS:348.2[M+H]+。 元素分析C16H18N4O5测定值(计算值)/%:C 55.45(55.49),H 5.17(5.24),N 16.21(16.18)。
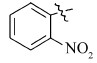
5-(4-硝基)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2f):黄色固体,1.43 g(产率76%),mp 204~206 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.48(s,2H),8.25(d, J=9.3 Hz,2H),8.15(s,1H),7.23(d, J=9.3 Hz,2H),4.88(s,2H),3.17(s,6H);IR(KBr), σ/cm-1:3269,3057,1725,1651,1628,1593,1510;ESI-MS:378.1[M+H]+。 元素分析C15H15N5O7测定值(计算值)/%:C 47.79( 47.75),H 4.11(4.01),N 18.54(18.56)。
5-苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2g):白色晶体,1.22 g(产率74%),mp 245~247 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.54(s,2H),8.15(s,1H),7.33(d,2H),7.07~6.95(m,3H),4.69(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3293,3247,1694,1653,1635,1588,1496;ESI-MS:333.1[M+H]+。 元素分析C15H16N4O5测定值(计算值)/%:C 54.32(54.21),H 4.63(4.85),N 16.89(16.86)。
5-(4-甲氧基)苯氧乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2h):灰色固体,1.30 g(产率72%),mp 211~213 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.54(s,2H),8.15(s,1H),7.02~6.93(m,2H),6.93~6.85(m,2H),4.62(s,2H),3.71(s,3H),3.17(d,6H);IR(KBr), σ/cm-1:3271,3063,1692 1651,1636,1590,1513;ESI-MS:363.2[M+H]+。 元素分析C16H18N4O测定值(计算值)/%:C 53.12(53.04),H 5.08(5.01),N 15.49(15.46)。
5-(1-萘氧基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2i):白色固体,1.53 g(产率80%),mp 201~203 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.51(s,2H),8.43(d,1H),8.20(s,1H),7.90(d,1H),7.67~7.34(m,3H),7.01(d,1H),4.90(s,2H),3.17(s,6H);IR(KBr), σ/cm-1:3358,3234,1698,1650,1635,1596,1509;ESI-MS:383.1[M+H]+。 元素分析C19H18N4O5测定值(计算值)/%:C 59.62(59.68),H 4.53(4.74),N 14.55(14.65)。
5-(8-喹啉氧基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2j):灰色固体,1.36 g(产率71%),mp 168~170 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.52(s,H),8.92(s,1H),8.39(d, J=8.3,1H),8.16(s,1H),7.77~7.41(m,3H),7.31(d, J=7.7,1H),4.96(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3234,3067,1707,1654,1632,1506,1457;ESI-MS:384.2[M+H]+。 元素分析C18H17N5O5测定值(计算值)/%:C 56.37(56.39),H 4.36(4.47),N 18.12(18.27)。
5-(2-甲基)苯胺乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2k):白色固体,1.19 g(产率69%),mp 254~256℃;1H NMR(DMSO-d6,400 MHz), δ:11.46(d,2H),8.10(s,1H),7.11~6.87(m,2H),6.58(d, J=7.3,1H),6.40(d, J=7.9 Hz,1H),5.45(s,1H),3.87(s,2H),3.16(d,6H),2.15(s,3H);IR(KBr), σ/cm-1:3411,3212,3044,1699,1646,1633,1509,1456;ESI-MS:346.1[M+H]+。 元素分析C16H19N5O4测定值(计算值)/%:C 55.56(55.64),H 5.59(5.55),N 20.21(20.28)。
5-苯胺乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2l):白色晶体,1.48 g(产率89%),mp 201~ 203 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.44(s,2H),8.10(s,1H),7.38 ~ 6.38(m,5H),6.09(s,1H),3.81(s,2H),3.13(d,6H);IR(KBr), σ/cm-1:3375,3215,3059,1697,1654,1610,1599,1509;ESI-MS:332.1[M+H]+。 元素分析C15H17N5O4测定值(计算值)/%:C 54.41(54.38),H 5.19(5.17),N 21.27(21.14)。
5-(4-甲氧基)苯胺乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2m):白色固体,1.48 g(产率82%),mp 176~178 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.49(s,2H),8.12(s,1H),6.82~6.70(m,2H),6.61~6.51(m,2H),5.74(s,1H),3.77(s,2H),3.65(s,3H),3.16(s,6H);IR(KBr), σ/cm-1:3362,3217,3067,1699,1651,1616,1604,1518;ESI-MS:362.2[M+H]+。 元素分析C16H19N5O5测定值(计算值)/%:C 53.27(53.18),H 5.19(5.30),N 19.42(19.38)。
5-(4-氯)苯胺乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2n):白色固体,1.55 g(产率85%),mp 211~213 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.42(s,2H),8.10(s,1H),7.14(d,2H),6.69~6.50(m,2H),6.29(s,1H),3.82(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3318,3256,1685,1648,1618;ESI-MS:366.1[M+H]+。 元素分析C15H16ClN5O测定值(计算值)/%:C 49.34(49.25),H 4.52(4.41),N 19.23(19.15)。
5-(4-甲基)苯胺乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2o):白色固体,1.33 g(产率77%),mp 212~214 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.43(s,2H),8.11(s,1H),6.94(d, J=8.1 Hz,2H),6.51(d, J=8.4 Hz,2H),5.88(s,1H),3.78(s,2H),3.16(s,6H),2.17(s,3H);IR(KBr), σ/cm-1:3364,3217,3058,1699,1646,1606;ESI-MS:346.1[M+H]+。 元素分析C16H19N5O4测定值(计算值)/%:C 55.57(55.64),H 5.46(5.55),N 20.14(20.28)。
5-(9-咔唑基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2p):棕色固体,1.74 g(产率86%),mp 189~191 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.63(s,1H),11.44(s,1H),8.18(d, J=7.7 Hz,2H),8.10(s,1H),7.59(d, J=8.2 Hz,2H),7.52~7.43(m,2H),7.25(d,2H),5.19(s,2H),3.15(d,6H);IR(KBr), σ/cm-1:3283,3142,1688,1661,1634,1605,1458;ESI-MS:406.1[M+H]+。 元素分析C21H19N5O4测定值(计算值)/%:C 62.13(62.22),H 4.59(4.72),N 17.25(17.27)。
5-(1-苯并[1,2,3]三氮唑基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2q):白色固体,1.34 g(产率75%),mp 223~225 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.54(d,2H),8.13(s,1H),8.08(d, J=8.4 Hz,1H),7.85(d, J=8.4 Hz,1H),7.60(d, J=11.2,1H),7.44(d, J=11.3,1H),5.61(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3281,3044,1693,1644,1595,1456;ESI-MS:358.1[M+H]+。 元素分析C15H15N7O4测定值(计算值)/%:C 50.51(50.42),H 4.19(4.23),N 27.38(27.44)。
5-(1-氯化吡啶基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2r):黄色固体,1.20 g(产率68%),mp 175~177 ℃;1H NMR(DMSO-d6,400 MHz), δ:12.39(s,1H),11.48(s,1H),9.17~8.23(m,5H),8.21(s,1H),5.65(s,2H),3.18(s,6H);IR(KBr), σ/cm-1:3437,3048,1706,1689,1651,1622,1488;ESI-MS:354.2[M+H]+。 元素分析C14H16ClN5O4测定值(计算值)/%:C 47.49(47.53),H 4.43(4.56),N 19.72(19.80)。
5-(1-苯并咪唑基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2s):白色固体,1.26 g(产率71%),mp 261~263 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.44(s,2H),8.26(s,1H),8.11(s,1H),7.68(d, J=7.6 Hz,1H),7.57(d, J=7.6 Hz,1H),7.26(d,2H),5.10(s,2H),3.16(s,6H);IR(KBr), σ/cm-1:3270,3132,1701,1644,1600,1459;ESI-MS:357.2[M+H]+。 元素分析 C16H16N6O4测定值(计算值)/%:C 53.87(53.93),H 4.39(4.53),N 23.43(23.58)。
5-(1-吲哚基)乙酰基氨基亚氨基次甲基- N, N'-二甲基-2,4,6-三氧代六氢嘧啶(2t):棕色固体,1.51 g(产率85%),mp 241~243 ℃;1H NMR(DMSO-d6,400 MHz), δ:11.47(d,2H),8.10(s,1H),7.57(d, J=7.8 Hz,1H),7.44(d, J=8.2 Hz,1H),7.37(d,1H),7.21~7.12(m,1H),7.10~6.99(m,1H),6.58~6.45(m,1H),4.98(s,2H),3.15(s,6H);IR(KBr), σ/cm-1:3266,3022,1719,1666,1638,1598,1464;ESI-MS:356.2[M+H]+。 元素分析C17H17N5O4测定值(计算值)/%:C 57.42(57.46),H 4.76(4.82),N 19.65(19.71)。
在合成芳香乙酰肼中间体1及目标化合物2时,由于普通加热回流的方法所需时间太长、副反应较多,然而微波辐射法在有机合成中具有高效的反应特点,使其在药物合成领域的应用越来越广泛,因此我们尝试在微波辐射条件下进行反应。 在合成芳氧乙酰肼中间体时,文献[23]报道以甲醇为溶剂,芳氧乙酸乙酯与水合肼在室温下搅拌1 h,产率为66%~75%,而本文不使用任何溶剂,反应物在250 W的微波辐射下,仅需45 s即可完成反应,并且产率略有提高。 在合成目标化合物2时,通过对反应中的催化剂、溶剂、微波功率及辐射时间的考察,探讨了在该反应条件下对目标物产率的影响,同时筛选出最优条件应用于目标物的合成,并将微波合成法与普通加热法对目标物产率的影响相比较。
2.1.1 催化剂对反应产率的影响 以化合物2a的合成为例,按照1.2.2节的操作,选用甲醇作为溶剂,在200 W的微波辐射下反应80 s,结果见表2。
| 表2 催化剂对目标物2a产率的影响 Table 2 Effect of catalyst on the yields of compound 2a |
由表2可知,5种催化剂对反应产率均有不同程度影响,其中CF3CO2H与TsOH对反应催化作用较弱,产率分别为35%和43%,而AcOH、H3PO4以及10%HCl对反应催化作用较强,反应产率分别为85%、67%和70%,出现这种结果可能是由于CF3CO2H及TsOH不易对醛羰基的氧质子化,导致羰基不能更好的与亲核基团发生反应,因此对反应的催化作用较弱,所以选择AcOH作为催化剂。
2.1.2 溶剂对反应产率的影响 在微波辐射的条件下,不同的溶剂对亲核反应有一定影响,因此,在优化催化剂的基础上,考察了6种溶剂对反应产率的影响,结果见表3。
| 表3 溶剂对目标物2a产率的影响 Table 3 Effect of solvent on the yields of compound 2a |
从表3可以得知,用AcOH做溶剂反应产率仅有42%,而CH3OH作为溶剂的产率却高达85%,因此选择CH3OH作溶剂。
2.1.3 微波功率和反应时间对反应产率的影响 在2.1.2节的基础上,考察了微波功率和反应时间对反应产率的影响,结果见表4。
| 表4 微波功率和反应时间对目标物2a产率的影响 Table 4 Effect of microwave power and reaction time on the yields of compound 2a |
从表4可以看出,当微波功率低于200 W时随着反应时间的增加产率逐渐增加,且当时间不变时,功率增加,产率增加幅度较大,说明功率是影响产率的主要因素。 当功率为250 W时,产率下降到73.2%,可能是由于微波功率过高,副反应增多,导致产率降低。
2.1.4 微波合成法与普通加热法的比较 在优化微波反应的条件下,以合成目标物2a~2e为例,将常规加热法与微波辐射法相比较,结果见表5。
| 表5 微波辐射法和常规加热法合成2a~2e的比较 Table 5 Effect of microwave irradiation and traditional refluxing on 2a~2e |
从表5中可知,普通加热法需用约8 h完成的反应,微波辐射仅需约85 s,且产率相对较高,因此在实验方法上选择微波辐射法。
分析化合物的1H NMR数据,发现目标物CONH基团中的氢吸收峰在 δ 11.45附近,而醛亚胺结构(CH=N)中的氢吸收峰在 δ 9左右,ArNHCH2CO的亚甲基氢在 δ 3.80附近出现一个细而高的单峰,其中NH的质子在 δ 5.45~6.29之间有一个矮而宽的峰,而ArOCH2CO的亚甲基氢由于氮氧原子电负性的差异,化学位移向低场移动,在 δ 4.75附近出现一个细而高单峰。 芳环上的氢因取代基电子效应的影响,化学位移在 δ 6.3~8.5之间。 在目标化合物的IR中,CONH基团的N—H伸缩振动吸收峰在3230 cm-1左右,同时芳环上的C—H伸缩振动吸收峰出现在3040 cm-1附近,亚甲基—CH2—的弯曲振动吸收峰在1470 cm-1左右,酰腙基团及巴比妥酸环上的C=O的伸缩振动峰在1700 cm-1附近,由于共轭效应的影响,酰腙亚胺C=N的伸缩振动吸收峰在1630 cm-1左右。 在MS谱图中,目标产物的ESI-MS[M+H]+与理论值也均吻合,并且元素分析数据的理论值与计算值也符合得很好。
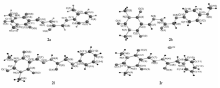
为了进一步确证产物分子的结构,加深对产物晶体结构的了解,我们用DMF:EtOH(体积比1:2)对目标产物进行重结晶,得到了化合物2a、2h、2l及2r的晶体,并进行单晶X射线衍射测试,结果表明,化合物2a为单斜晶系(Monclinic),C12/c1空间群,分子式为C16H18N4O5,晶胞参数为 a=3.9230(4) nm, b=0.8895(8) nm, c=2.4298(2) nm, β=124.121(2)°, V=7.019(6) nm3, Dc=1.392 mg/m3, μ=0.106 mm-1, Z=8, F(000)=3076;化合物2h为单斜晶系(Monclinic),P21/n空间群,分子式为C16H18N4O6,晶胞参数为 a=1.0989(16) nm, b=0.9119(12) nm, c=1.6618(2) nm, β=94.385(2)°, V=1.6604(4) nm3, Dc=1.445 mg/m3, μ=0.113 mm-1, Z=4, F(000)=756;化合物2l为单斜晶系(Monclinic);P121/n1空间群,分子式为C15H17N5O4,晶胞参数为 a=0.8540(3) nm, b=0.62457(19) nm, c=2.8793(9) nm, β=98.965(5)°, V=1.5171(8) nm3, Dc=1.446 mg/m3, μ=0.108 mm-1, Z=4, F(000)=692,化合物2r为单斜晶系(Monclinic),P121/n1空间群,分子式为C14H16N5O4Cl,晶胞参数为 a=0.69593(11) nm, b=1.3229(2) nm, c=1.7518(3) nm, β=96.105(3)°, V=1.6037(4) nm3, Dc=1.461 mg/m3, μ=0.268 mm-1, Z=4, F(000)=732;化合物2a、2h、2l及2r的晶体数据已存于剑桥晶体数据库,CCDC号分别为1426606、1426604、1426603、1426605。图1为化合物的单胞晶体结构图。
采用两倍稀释法[27]测定了目标化合物对4种细菌:大肠杆菌( E.coli)、金黄色葡萄球菌( S.aureus)、铜绿假单胞菌( P.aeruginosa)、萎缩芽孢杆菌( B.atrophaeus)的抑菌活性。 抑菌实验以环丙沙星作为阳性对照,DMSO为阴性对照,菌液浓度为1×106个/mL,最大药物浓度为100 g/L,每个样品对每种菌重复测试3次,取平均值并保留一位小数,结果见表6。
| 表6 目标物对不同细菌的最低抑菌浓度 Table 6 The MIC values of different target compounds |
从表6可看出,当芳香环为苯环时,苯环上的氢逐渐被吸电子基团取代,抑菌活性会进一步增强,其中化合物2c对萎缩芽孢杆菌的最低抑制浓度为1.6 g/L,与对照药环丙沙星对该菌的抑菌浓度相等,在苯环为同一取代基的条件下,目标物中苯环和氮原子相连与苯环和氧原子相连的抑菌活性相比较并无明显差异。 当芳环为含氮杂环时,目标物对除萎缩芽孢杆菌以外的3种细菌均具有较好的抑制作用,化合物2q对铜绿假单胞菌的抑制浓度为6.2 g/L,与环丙沙星的抑菌浓度较接近,化合物2t对金黄色葡萄球菌和大肠杆菌的抑制浓度分别达到了0.8和1.6 g/L,与环丙沙星对两种菌的最低抑制浓度相等。
本文在微波辐射条件下,由芳香乙酸酯经过肼解、缩合合成了20个含巴比妥酸的芳香乙酰腙化合物。 研究了催化剂、溶剂及微波辐射功率与时间对目标物产率的影响,得到目标物最佳的合成条件:以AcOH为催化剂,甲醇为溶剂,在200 W的辐射功率下反应80~100 s有较好的产率。 同时还对目标物进行了抗菌活性测试,构效关系分析结果表明,当芳基为含氮杂环时,所形成的化合物抗菌活性与芳基为苯环时相比明显较强,研究结果表明,该类化合物值得进一步结构优化与深入研究。
辅助材料(Supporting information)[目标物的1H NMR、13C NMR]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|