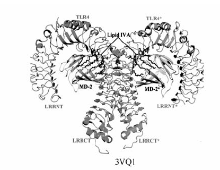
Toll样受体(Toll-like receptors,TLRs)是进化保守的天然免疫模式识别受体,能够识别外源的病原菌相关分子模式(Pathogen-associated molecular patterns,PAMPs)、内源的损害相关分子模式(Damage-associated molecular patterns,DAMPs)和异源物相关分子模式(Xenobiotic-associated molecular patterns),诱导炎症免疫反应。 其中,TLR4(Toll-like receptor 4)是目前研究最为广泛的Toll样受体之一,TLR4是脂多糖(lipopoiysaccharide,LPS)的主要受体,LPS激活的TLR4信号通路在炎症信号的传递中发挥着重要作用,而此信号转导需要通过LPS与TLR4及其附属蛋白髓样分化因子2(myeloid differentiation factor 2,MD-2)的相互作用来实现。 因此,TLR4/MD-2成为炎症反应和免疫调控最重要的研究热点。 本文综述靶向TLR4/MD-2的小分子激动剂和抑制剂的研究进展,以进一步理解TLR4小分子调节剂与其相互作用的复杂性,帮助靶向TLR4/MD-2的免疫调节剂药物发现。
Toll-like receptors(TLRs) are evolutionarily conserved innate immunity receptor proteins that detect pathogen-associated molecular patterns(PAMPs), danger-associated molecular patterns(DAMPs) and xenobiotic-associated molecular patterns(XAMPs), triggering inflammatory responses. TLR4 is the main receptor for bacterial lipopolysaccharide(LPS) and the accessory protein myeloid differentiation factor 2(MD-2) is responsible for ligand recognition. LPS binding induces(TLR4-MD-2-LPS)2 and TLR4/MD-2 complex dimeriztion, which activates TLR4 signaling and produce pro-inflammatory factors. The dysregulation of innate immune TLR4 signaling contributes to numerous pathological diseases. Therefore, TLR4/MD-2 is emerging as an important drug discovery target. In this review, we summarize the up-to-date discovery of TLR4 small molecule modulators and provide insights into future drug discovery, which will be interesting to colleagues major in chemical biology, medicinal chemistry, signal transduction and translational medicine.
天然免疫系统是机体免受病原菌感染的进化保守机制。 Toll样受体(Toll-like receptors,TLRs)是被发现的最早的天然免疫模式识别受体(Pattern-recognition receptors,PRRs),识别外源的病原菌相关分子模式(Pathogen-associated molecular patterns,PAMPs)、内源的损害相关分子模式(Damage-associated molecular patterns,DAMPs)和异源物相关分子模式(Xenobiotic-associated molecular patterns,XAMPs)诱导炎症免疫反应[1,2]。 1997年,Medzhitov等[3]首次在哺乳动物中发现同源于果蝇Toll的蛋白受体,并命名为Toll样受体4(Toll-like receptor 4,TLR4)。 随后,在哺乳动物中发现了13种Toll样受体TLR1-13[4,5,6,7,8,9,10,11,12,13,14],其中TLR4是目前为止研究最为广泛的Toll样受体之一。
TLR4是一种保守的I型跨膜蛋白(type I transmembrane protein),包括胞外域、跨膜区和胞内域3个部分,其中胞外域具有富含亮氨酸重复单元(Leucine-rich repeats,LxxLxLxxN)N端,胞外结构域高度保守,呈马蹄形。 配体结合到TLR4胞外结构域,诱导TLR4同源二聚化或构象变化,C端募集髓样分化因子88(Myeloid differentiation primary response gene 88,Myd88)和其它接头蛋白诱导TLR4信号通路级联激活,诱导炎症因子产生,当然TLR4还可以通过Toll/IL-1受体接头蛋白分子(Toll/IL-1 receptor containing adaptor molecule,TRIF)和TRIF相关接头分子(TRIF related adaptor molecule,TRAM)介导的Myd88非依赖途径活化干扰素调节因子和一系列级联响应。
TLR4信号通路的激活与抑制非常敏感,激活TLR4信号通路不但可以刺激先天性免疫应答同时还能够通过获得性免疫反应来对机体进行保护,但这些应答引起的持续性炎性反应有时也会对机体产生损伤,因此,天然免疫TLR4通路异常是许多疾病的分子病因,例如药物成瘾和神经病理性疼痛[2,15]、自身免疫疾病(系统性红斑狼疮和类风湿性关节炎)[16]、癌症(肺癌、乳腺癌和卵巢癌等)[17,18]和心血管疾病[19]等。 所以,TLR4信号通路的激活与抑制必须受到严格的调控,以保持免疫系统的稳定[20]。 鉴于TLR4信号通路在生物医学方面的重要性,靶向TLR4及其附属蛋白MD-2的小分子调节剂的研究十分活跃。 本文综述近年来作用于TLR4/MD-2复合物的小分子激动剂和抑制剂研究进展(表1)。
| 表1 靶向TLR4/MD-2的小分子调节剂 Table 1 Small molecule modulators of TLR4/MD-2 |
脂多糖(LPS)是革兰氏阴性细菌细胞壁的主要成分,是经典的TLR4天然配体。 LPS与TLR4结合后,信号通路被激活,引起细胞表面的MD-2与TLR4形成二聚化复合体,开启下游的一系列反应。 细菌释放进入生物血液中的LPS会通过两种方式激活TLR4信号通路:一是LPS由其结合蛋白LBP运送到结构辅助蛋白CD14,再同TLR4/MD-2相互作用,激活TLR4下游通路;二是LPS直接与TLR4的附属蛋白MD-2结合并相互作用,进而激活TLR4信号通路[21]。 TLR4信号转导通路起始于细胞内的TIR结构域[22],TIR结构域能够结合多种胞内衔接蛋白,如Myd88、干扰素TIR结构域衔接蛋白TRIFs和TIRAP等。 TLR4参与的信号通路也主要有两种:一是Myd88依赖性通路,Myd88激活信号转导因子,包括白介素1受体联合激酶4(IL-1R-associated kinase4,IRAK4)、肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6,TRAF6)和激活胞膜激酶(TGF-activated kinase1,TAK1),最后导致核转录因子NF-κB(nuclear factor κB)活化和相关促炎因子的产生;二是由TRIF转导的Myd88非依赖性通路,能够激活干扰素调节因子3(interferon regulatory factor 3,IRF3)和TANK联合激酶1(TANK binding kinase1,TBK1)等信号转导分子,最终诱导干扰素- β(Interferon- β,IFN- β)的表达[23],引起相关的炎症反应。
TLR4信号通路的激活可以抵御PAMPs、DAMPs和XAMPs,然而持续的炎性反应也会对机体产生损伤。 因此,TLR4信号通路的激活必须受到严格的负调控,以保持免疫系统的稳定。 TLR4及其附属蛋白MD-2是一类胞外的可溶性负调控因子,可通过抑制膜表面TLR4与配体的结合来抑制或封闭TLR4信号通路;跨膜部分负调节因子可以分为两类:一是对连接复合体的解离,例如肿瘤发生抑制物可使得Myd88和Myd88的接头蛋白类似物解离;二是干扰功能复合体的顺利形成,例如IRAK和TRAF可分别跟免疫球蛋白IL-1的分子相关受体(single immunoglobulin IL-1 related receptor,SI-GIRR)形成复合体,从而干扰前两者形成复合物等[24];最后,胞内域也存在有许多负调控因子,主要是通过竞争性抑制、泛素化和去泛素化等方式来实现。
脂多糖LPS是经典的TLR4外源性激动剂。LPS虽然活化TLR4信号通路,但TLR4的表达水平及其下游通路的活化,均依赖与其辅助蛋白MD-2形成的复合物[25,26]。 MD-2是5kD的糖蛋白,与TLR4形成复合物TLR4/MD-2定位于细胞膜表面。 TLR4/MD-2识别并与LPS结合后,两分子的LPS/TLR4/MD-2形成二聚体(寡聚化)(图1),在细胞膜稳定表达。 抑制MD-2/TLR4复合物的形成或敲除MD-2均将降低TLR4在细胞膜的表达。 因此,LPS诱导TLR4/MD-2复合物的二聚化是TLR4高表达的必须条件。 随后不到10年的时间,通过高分辨率的晶体结构和基因定点突变表型的比较结果,TLR4/MD-2受体的分子机理[6,7,27,28,29]得到了进一步分析。 LPS结构中Lipid A结构有4~6个乙酰基与葡萄糖胺骨架的2个磷酸基,是与TLR4/MD-2结合的关键基团(图2)。 其中乙酰基深埋于MD-2及TLR4的疏水口袋中,葡萄糖胺骨架的2个磷酸基则与TLR4和MD-2的阳离子基团结合,使TLR4/MD-2复合物形成二聚体,并发生构象旋转;与此同时LPS的O-Antigen的碳水化合物结构可与MD-2和TLR4以离子键合,对TLR4/MD-2的二聚物起到稳定作用。
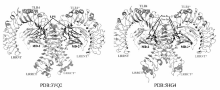 | 图1 TLR4/MD-2/Agonist结构[29,30]Fig.1 Structure of the TLR4/MD-2/Agonist complex3VQ2 is the structure of mouse TLR4/MD-2/LPS[29] and 5HG4 is the structure of mouse TLR4/MD-2/Neoseptin-3[30] |
基于LPS与TLR4/MD-2的相互作用过程中Lipid A的关键作用,一些Lipid A类似物TLR4激动剂被合成。 改变Lipid A的酰基链的长度能够引起相应的免疫反应[31],并且Lipid A的构型变化能够转变其活性从传统的激动剂转变为抑制剂[6,32,33]。 例如,Dunn-Siegrist 等[32]合成了一系列带有一个或者两个磷酸基的三酰基Lipid A类似物,研究表明这些小分子化合物均能够调节TLR4活性。 其中OM-197-MP-AC(图2)表现为一种TLR4激动剂,虽然其活性不如LPS,但具有较小的内毒性,因此,有望被开发成一款疫苗佐剂。 与OM-197-MP-AC相反,OM-174-DP等一系列小分子化合物表现出明显的TLR4拮抗作用。 Pantel等[34]报道了一种新的合成无毒模拟脂多糖,吡喃葡萄糖基的Lipid A(Glucopyranosyl lipid A,GLA)(图2),有佐剂的辅助能力。 数据表明,GLA是一种合成的临床可行的TLR4激动剂,它能够刺激巨噬细胞在体内迅速发育成熟,使适应性免疫能力在多几个星期乃至几个月后还能有所提高[34,35]。 低毒性的LPS衍生物单磷酰脂质A(Monophosphoryl Lipid A,MPLA)(图2)是一种有用的TLR4激动剂。 Mata-Haro等[36]研究表明,在小鼠体内,MPLA的低毒性的佐剂作用主要归因于它对TRIF信号通路的偏好性选择,这一发现可能对发展未来的疫苗佐剂有重要的意义。 CRX-547属于氨基葡萄糖苷4酰基物(aminoalkyl glucosaminide 4-phosphate,AGP)的一种,同样是一种合成的Lipid A类似物,并且在人体细胞中是一种很好的TLR4激动剂和疫苗佐剂。 很有意思的是,Bowen等[37]研究表明CRX-547(图2)不能激活MyD88依赖途径的信号分子或细胞因子,但CRX-547在激活TRIF依赖途径的信号分子或细胞因子方面与结构相关的炎性AGP以及沙门氏菌脂多糖LPS具有几乎相当的活性。 这种TRIF偏好性的信号响应导致通过MyD88信号相关的炎症介质介导的炎症因子的大幅的较少,从而有可能降低毒副作用,提高这种TLR4受体激动剂和疫苗佐剂CRX-547的治疗指数。 Mancek-Keber和Jerala[38]通过对一些天然的和人工合成的LPS或Lipid A类似物分析总结了能够成为活化TLR4的经典MD-2配体至少要满足以下几个条件:第一,具有适当间隔的负电荷的亲水性上端;第二,具有一个体积庞大的,能够尽可能填满MD-2疏水口袋的疏水部;第三,与此同时Lipid A酰基链的下端必须保持暴露在外;第四,与TLR4的胞外域的疏水结合位点相互作用。
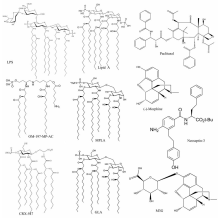 | 图2 典型的TLR4小分子激动剂的结构[21,30,31,32,34,36,37,39,40,42]Fig.2 Structures of typical TLR4 agonistsLPS[21], Lipid A[31] and Lipid A analogue:MPLA[36], OM-197-MP-Ac[32], CRX-547[37] and GLA[34]; Non-Lipid A ligands:Paclitaxel[39,40], (-)-Morphine[42], M3G[42] and Neoseptin-3[30] |
紫杉醇Paclitaxel(taxol)(图2)是一种在结构上与Lipid A非常不同的小分子物质,Paclitaxel通过小鼠的TLR4/MD-2诱导信号产生[39,40],Resman等[41] 发现Paclitaxel能够结合到人的MD-2进而对LPS的诱导信号有一定的抑制作用。 Paclitaxel激活小鼠TLR4的原因尚不完全清楚,但在某种条件下很有可能是由于它的疏水部分的结构和Lipid A的结构和暴露形状比较相似,然而,关于小鼠MD-2基因点突变的研究发现激活Paclitaxel反应所需的残基不同于激活LPS反应所需的残基,这可能是导致Paclitaxel和Lipid A对TLR4/MD-2产生类似但不完全相同结果的原因[40]。
吗啡Morphine及其代谢物质吗啡-3-葡萄糖苷酸(morphine-3-glucoronide,M3G)(图2)均是TLR4信号通路的小分子激动剂。 Hutchinson等[42]通过小鼠体内外实验发现,鸦片类物质吗啡(morphine)、美沙酮(methadone)、哌替啶(meperidine)、芬太尼(fentanyl)、羟考酮(oxycodone)等能够对TLR4/MD-2信号通路产生影响,通过计算机模拟这些结构不同的疏水异源物被TLR4的辅助蛋白MD-2的疏水脂多糖LPS结合口袋识别,影响TLR4/MD-2信号通路,并产生一系列的行为后果。 Wang等[43]进一步发现,鸦片精神活性物质吗啡在小胶质细胞的天然免疫受体TLR4而非经典的G-protein coupled receptor(GPCR)类型鸦片受体引起神经炎症反应。吗啡结合MD-2,诱导TLR4寡聚化,并且以与脂多糖LPS相似的一种方式,引起苯丙氨酸PHE126所在loop区构象变化,诱导TLR4/MD-2二聚,活化TLR4信号通路,诱导胶质细胞活化和炎症因子表达。 TLR4/MD-2复合体的小分子抑制剂可以抑制吗啡诱导的体内外的免疫细胞活性,因此,可以靶向TLR4/MD-2复合物来提高当前基于鸦片类镇痛治疗的疗法。 吗啡进入机体后立即代谢,产生代谢产物吗啡-6-葡萄糖苷酸(morphine-6-glucoronide,M6G)和吗啡-3-葡萄糖苷酸(morphine-3-glucoronide,M3G),M6G对鸦片受体有高度特异的亲和性,镇痛效力强于Morphine,是经典鸦片受体激活剂。而M3G的作用相反,它与经典鸦片受体无亲和性,却能够激活TLR4。 鞘内注射M3G能够导致痛觉过敏,称为鸦片诱发性痛觉过敏(opioid induced hyperalgesia,OIH)[42,44]。
Wang等[30]通过分子筛选、逆向遗传学、结构-活性关系分析和化学修饰等方法合成了肽模拟物Neoseptin-3(Neo-3),它与经典TLR4配体LPS或Lipid A没有结构上的相似性,但能够极富成效地激活小鼠TLR4受体,是一种新型的TLR4小分子激动剂。 TLR4/MD-2/Neoseptin-3的0.257 nm分辨率的晶体结构显示,两个Neoseptin-3(图1)小分子结合为一个非对称二聚体并且连接在MD-2的疏水口袋内,诱导生成具有活性的TLR4/MD-2受体复合物。 然而,Neoseptin-3与TLR4/MD-2的接触方式不同于Lipid A,因此不需要模仿LPS也能够得到TLR4/MD-2强激动剂。 Wang等[30]提出了一种新的天然免疫调节剂的研发机制:第一,激动剂在激活二聚体过程中必须包含能够形成MD-2和TLR4之间二聚化界面的基团,Neoseptin-3和Lipid A通过不同的功能/化学基团和不同配体-蛋白之间的连接分别实现了这一点;第二,配体与MD-2的疏水口袋之间要有紧密的特异性相互作用,以至配体能够比较合适地锚定在MD-2口袋上,即配体可以不像经典配体LPS那样完全填充MD-2疏水口袋,也能顺利的激活TLR4信号通路。
Loppnow等[45]从非病原细菌,如荚膜红细菌( Rhodobacter capsulatus, R.capsulatus)和类红球细菌( Rhodobacter sphaeroides, R.sphaeroides)中得到没有毒性的Lipid A,并且在体外实验中证实这些分子均是有效的LPS抑制剂。 其中化合物E5531(图4)是 R.capsulatus的一种Lipid A类似物,1995年Eisai实验室首次将E5531研制成功并用作LPS抑制剂[46],实验结果显示E5531只对TLR4信号通路有拮抗作用。 虽然E5531在体内外均可以对LPS的毒性进行有效的抑制,但是E5531与血浆蛋白的相互作用使得它的活性随时间的增加有明显的减弱[47]。 随后Eisai实验室2002年从 R.sphaeroides中得到第二代LPS抑制剂Eritoran(E5564)[48]。 E5564(图4)是一种高效的内毒素LPS抑制剂[49],它直接结合在MD-2的疏水口袋中,完全阻止内毒素的Lipid A再结合到同样的位置,进而抑制TLR4二聚及其信号通路的激活[6]。 E5564对动物模型的脓毒症有明显的保护作用[49],并且能够在健康志愿者体内以剂量依赖的方式抑制内毒素败血症的体征和症状[50]。 Eritoran的Ⅱ期临床试验取得到了不错的效果,但在Eritoran的Ⅲ期大规模临床试验中发现Eritoran无明显改善败血症活性。 Lipid IVA(图4)是一种Lipid A前体,Akashi等[51]通过种特异性药理学研究表明,Lipid IVA对鼠的TLR4/MD-2具有激动作用,但对人的TLR4/MD-2不具有这样的作用,在人的TLR4/MD-2上Lipid IVA是一种LPS或Lipid A抑制剂,进一步的研究发现,Lipid IVA可以通过人的MD-2抑制鼠的TLR4信号通路,Lipid IVA的这种种属特异性活性表明MD-2结构具有种属差异性。 Muroi和Tanamoto研究表明[52],小鼠MD-2的57、61和122氨基酸残基是确定Lipid IVA的拮抗活性的关键,2007年,Kim等[29]成功地解出了鼠的TLR4/MD-2/Lipid IVA晶体结构(图3)。
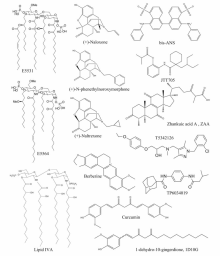 | 图4 典型的TLR4小分子抑制剂的结构[43,46,48,51,52,54,59,61,62,63,64]Fig.4 Structures of typical TLR4 antagonistsLipid A analogues Lipid IVA[51,52], E5531[46] and E5564[48]; Non-Lipid A ligands:T5342126[43], TP6034019[43], (+)-Naloxone[54], (+)-Naltrexone[54], (+)- N-phenethylnoroxymorphone[54], bis-ANS[59], JTT705[59], Curcumin[61], 1D10G[62], Berberine[63] and ZAA[64] |
纳洛酮(Naloxone)和纳曲酮(Naltrexone)能抑制LPS诱导HEK-TLR4细胞的基因表达,并且抑制效果没有立体选择性,(+)和(-)对映体表现出非常相似的活性。 (+)-Naltrexone和(+)-Naloxone(图4)具有很好的血脑屏障透过能力,并且不会抑制鸦片样物质的经典鸦片受体活化,因此它们具有很好的药物依从性、普适性和协同性[53]。 Selfridge 等[54]对(+)-Naltrexone/(+)-Naloxone进行进一步的结构活性研究,旨在研发下一代活性更好的TLR4抑制剂,通过模仿LPS的疏水长链,增加(+)-Naltrexone/(+)-Naloxone的疏水性侧链,体外实验显示活性最好的类似物(+)- N-phenethylnoroxymorphone抑制LPS诱导的TLR4下游产物NO的活性几乎是(+)-Naltrexone/(+)-Naloxone活性的75倍[54]。 最近,Wang等[55]进一步阐明了(+)-Naltrexone/(+)-Naloxone调节TLR4信号通路的分子机制,(+)-Naltrexone和(+)-Naloxone作用于TLR4的辅助蛋白MD-2的LPS结合疏水腔,阻碍TLR4信号通路炎症因子和活性氧自由基的表达。 需要指出的是(+)-Naltrexone和(+)-Naloxone不抑制TLR-MyD88信号通路,偏好性地抑制TLR4-TRIF-IRF3信号通路,是目前发现的首例偏好性的TLR4信号通路抑制剂。
Wang等[43]以TLR4/MD-2的结合界面的蛋白相互作用作为药物发现靶标,通过虚拟筛选发现了两种TLR4抑制剂T5342126和TP6034019(图4),二者均能有效抑制吗啡诱导的TLR4信号通路,显著增强吗啡的镇痛效果。 T5342126已转让给以色列纳斯达克上市制药公司BioLineRx,目前正在进行神经病理性疼痛和治疗药物成瘾方面的临床前研究。TAK-242(图4)[56]是一种经典的TLR4抑制剂,不过它是通过直接结合TLR4胞内域的半胱氨酸CYS747来抑制TLR4信号通路,阻止TLR4与接头蛋白分子相互作用[57,58]。
天然产物中有许多化合物被发现能够被天然免疫TLR4受体的辅助蛋白MD-2识别,他们阻碍TLR4小分子激动剂顺利地结合到MD-2疏水口袋,抑制TLR4信号通路和炎症因子的表达。Mancek和Jerala[59]报道疏水蛋白荧光探针bis-ANS(图4)与MD-2蛋白具有很高的亲和力,但bis-ANS有很强的细胞毒性。 IAANS、auranofin和JTT705等[59]小分子有共同的分子特征,即,它们都具有硫醇反应功能,能够与MD-2中的自由残基半胱氨酸CYS133相互作用生成不可逆的共价键,进而有效地抑制LPS诱导的TLR4信号通路。 Youn等[60]在BaF3细胞株中发现姜黄素(Curcumin)(图4)能够抑制TLR4的寡聚化,从而通过Myd88依赖和Myd88非依赖信号通路,抑制炎症反应。 Gradisar等[61]对Curcumin的作用机理进行了更加详细的分析,他们发现Curcumin通过与MD-2上的半胱氨酸CYS133之间的加成作用竞争性地结合在MD-2上,抑制LPS刺激的TLR4信号的产生。 Park等[62]描述了一种新的生姜中的刺鼻的分离物1D10G(1-dehydro-10-gingerdione),1D10G(图4)也能够通过结合MD-2的疏水腔,抑制LPS/TLR4介导炎症反应。 Chu等[63]研究表明,黄连素Berberine可以作为LPS抑制剂阻断LPS/TLR4信号源,分子机制表明,Berberine(图4)能够绑定到TLR4/MD-2受体,与脂多糖相比,具有较高的亲和力。 Chen等[64]发现樟芝酸A(Zhankuic acid A,ZAA)(图4)通过疏水相互作用结合到MD-2的LPS疏水结合口袋,抑制TLR4信号通路,能够显著改善LPS诱导的内毒素血症和沙门氏菌引起的小鼠腹泻。
目前开发的TLR4/MD-2的小分子激动剂主要为以下两类,一类是模仿经典的TLR4/MD-2配体LPS或Lipid A的一类化合物,它们与MD-2结合并尽可能填满MD-2疏水腔体的疏水部分,与此同时它们的Lipid A酰基链的下端必须有部分保持暴露在外,与TLR4的胞外域的疏水结合位点相互作用,使TLR4/MD-2二聚化,从而激活TLR4信号通路;另一类是不具有经典LPS或Lipid A结构的小分子化合物,但具有可以锚定在MD-2口袋上的基团,并且包含能够形成MD-2和TLR4之间二聚化界面的基团,这一点类似于一种暴露在外的Lipid A酰基链。 对于TLR4/MD-2的小分子抑制剂也可以分为两类,一类是通过结构修饰将TLR4激动剂转变为对应的TLR4抑制剂,例如:Lipid A类似结构抑制剂E5531、E5564和Lipid IVA,非Lipid A类似结构抑制剂(+)-Naltrexone /(+)-Naloxone;第二类是通过筛选化合物库和天然产物组份得到的抑制剂。 但不管是哪种抑制剂都会竞争性地结合在MD-2疏水腔体内,阻止激动剂进入疏水口袋诱导TLR4/MD-2二聚,进而抑制下游炎症因子的产生。 因此,针对TLR4/MD-2与小分子调节剂相互作用以及构象变化的研究一直是分子调节剂的主要研发方向。 除此之外,非常值得注意的是,MPLA和CRX-547偏好性地激活TLR4-TRIF信号通路,(+)-Naltrexone和(+)-Naloxone偏好性地抑制TLR4-TRIF-IRF3信号通路,这些发现表明,针对TLR4/MD-2以及其它药物靶点的偏好性药物研究也是未来药物研发的重要方向,这对未来的疫苗佐剂的发展具有非常重要的意义。
髓样分化蛋白MD-2是一种关键的TLR4辅助蛋白,在亿万年的物种进化过程中,MD-2的疏水口袋能够结合各种各样的分子,大到脂多糖LPS分子,小到Morphine分子,并且能够识别自我与非我的分子模式,从而保持机体的免疫平衡。 因此,针对TLR4/MD-2为靶点的小分子调节剂的研发具有非常深远的意义。 目前,模仿TLR4/MD-2的天然配体已被证明是一个成功的TLR4调节剂研发方法,已经有很多配体衍生物成为候选药物,正在进行临床试验。 近几年,合理药物设计、高通量筛选和计算机虚拟筛选等方法都是现在比较常见的小分子调节剂研发方法,应该注意的是,这些方法各有优缺点,不同方法之间的组合或交叉使用也许能够提供更加理想的结果,为识别更多更好的候选抗炎药物提供机会。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|