为提高La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60的电化学性能,由5-溴水杨酸和苯胺合成了一种席夫碱作为表面改性剂,对储氢合金进行表面处理。 从紫外与红外图谱可知,合成了目标席夫碱。 添加1%席夫碱后,合金的相结构没有改变。 与未添加席夫碱的合金电极相比,电极的最大放电容量略有下降,但50次充放电循环后合金电极的容量保持率有较大幅度提高,添加5%席夫碱的电极容量保持率从63%提高到75%,高倍率放电性能也有增加。 经表面处理后,合金电极的交换电流密度 I0与极限电流密度 IL均有大幅度提高,动电位极化曲线也表明合金电极的抗腐蚀能力变强。 以上结果均表明,添加少量席夫碱有助于改善储氢合金电极的电化学性能。
To improve the electrochemical properties of La-Mg-Ni-based hydrogen storage alloy La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60, a kind of Schiff base was synthesized and added to the alloy as a surface modifier. According to the results of UV and infrared spectroscopies, the phase structure of the alloy does not change after adding this Schiff base. Compared with the original alloy, the maximum discharge capacity decreases somewaht. The cycle stability of the alloy electrodes with 5% addition of Schiff base is improved from original 63% to 75% after 50 cycles, and the high rate discharge performance is improved also. After surface treatment, the exchange current density I0 and the limiting current density IL increases obviously. The potentiodynamic polarization curves of the alloy electrodes indicate that the corrosion resistance is increased. The results above suggest that the addition of small amount of Schiff base contributes to improving the electrochemical properties of the hydrogen storage alloy.
已经商业生产的Ni/MH二次电池,其负极材料主要是AB5型稀土系储氢合金,因其放电容量不高而受到限制。 La-Mg-Ni基储氢合金具有比AB5型稀土系储氢合金更大的放电容量,被认为更具发展潜能[1]。 但在充放电的过程中,合金的粉化、腐蚀,会降低合金负极的放电容量和缩短合金负极的循环寿命[2]。 表面处理是一种有效改善电催化活性和抗腐蚀能力的方法[3]。 近年来,常用来表面改性的方法主要有化学镀[4,5]、聚合物改性[6]、氟化处理[7]、复合表面处理[8]等。
席夫碱是通过缩合反应合成的一类含有亚胺或甲亚胺特性基团(—RC=N—)的有机化合物。 席夫碱具有生物活性,在医药方面有广泛应用;席夫碱也具有化学活性,在催化剂、分析、腐蚀与防护等方面均发挥重要作用[9]。 众所周知,席夫碱的原料价廉易得,合成工艺简单,有缓解腐蚀的作用,其中芳香族且苯环上有—OH键的席夫碱有良好的抗腐蚀性能[10]。 本文将5-溴水杨醛与苯胺缩合而成的席夫碱添加到La-Mg-Ni基储氢合金中,以缓解强电解液对合金负极的腐蚀,并研究其电化学性能。
iS10型傅里叶红外光谱分析仪(美国Thermo Fisher公司);Lambda750型紫外可见近红外光谱仪(美国Perkin Elmer公司);X'PERT PRO 型XRD粉末衍射仪(荷兰Panalytical公司);CHI 660E型电化学工作站(上海辰华仪器公司)。
5-溴水杨醛(分析纯,四川西亚化工有限公司);苯胺,氢氧化钾,甲酸,DMF( N, N-二甲基甲酰胺,分析纯,西陇化工股份有限公司);无水乙醇(分析纯,广东光华科技股份有限公司)。
制备La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60。 采用真空悬浮熔炼技术,炉内充入Ar气,以防合金氧化,铸锭要翻转重熔2~3次。 取出铸锭,冷却至室温,研碎过0.075 mm筛。
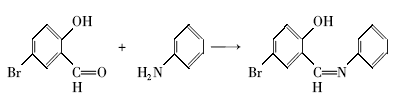
席夫碱的制备:称取1.05 g 5-溴水杨醛溶于30 mL无水乙醇中,倒入三口烧瓶中,加入1~2滴甲酸作为催化剂,置于80 ℃水浴锅中。 称取0.47 g苯胺,溶于10 mL无水乙醇中,缓慢滴加到三口烧瓶内。 磁力搅拌,反应4 h。 产物用无水乙醇洗涤两次,放入40 ℃干燥箱,干燥至恒重,得橙黄色针状5-溴水杨醛缩苯胺席夫碱。 反应式如下:
负极片的制备:将合成的5-溴水杨醛缩苯胺席夫碱以质量分数1%、2%、5%添加到La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60中,分别取0.1与0.2 g的羰基镍粉研磨均匀,以10 MPa的压力压制成直径为11 mm的电极片,并将电极片放在两片泡沫镍间,压制成负极片。 记添加了1%、2%、5%的席夫碱的电极为L1、L2、L3,只有La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60的电极片为L。
相结构用X射线粉末衍射仪测得。 电池的放电及循环性能用开口式两电极体系,正极为高容量烧结式Ni(OH)2/NiOOH,制备的电极为负极,电解液是6 mol/L的KOH溶液,测试前需在电解液中浸泡2 h,使其活化。 测试参数为:静置5 min;恒流充电5 h,充电电流密度是100 mA·h/g;静置5 min;恒流放电到1 V,放电电流密度是50 mA·h/g;循环50次。 高倍率放电(High rate discharge ability)曲线,放电电流密度分别为50、150、300、600 mA·h/g。
用电化学工作站测试电池的动力学性能,参比电极为Hg/HgO,正负极及电解液不变。循环伏安曲线,扫速为10 mV/s,电位为-1.0~-0.2 V(相对于Hg/HgO)。 动电位极化曲线,扫速为0.1 mV/s,电位为-1.0~-0.2 V(相对于Hg/HgO)。 线性极化曲线,扫速为0.1 mV/s,过电位为-5~5 mV(相对于开路电位);阳极极化曲线,扫速为0.5 mV/s,过电位为0~600 mV(相对于开路电位);交流阻抗曲线,振幅为5 mV,频率是1000~0.001 Hz。 除动电位极化曲线外,其余3个曲线均在放电深度为50%条件下测试。
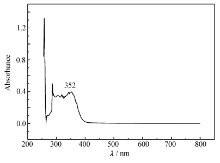
图1为席夫碱在溶剂DMF中的紫外吸收光谱,浓度为5×10-5 mol/L。 溶剂DMF的吸收峰在200~300 nm处,在352 nm处的吸收峰为席夫碱分子,因席夫碱分子是共轭体系,由体系的π-π*电子跃迁形成K吸收带,相似的席夫碱的吸收峰也基本在这个位置[11,12]。
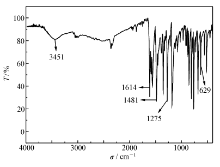
将席夫碱与KBr研磨压片,测得红外谱图如图2所示。 标准水杨醛红外图谱中,在1665 cm-1有C=O键的振动吸收峰,而合成的席夫碱红外中并未出现这个吸收峰,在1614 cm-1处出现C=N键的伸缩振动吸收峰,说明5-溴水杨醛与苯胺反应,生成含C=N键的席夫碱。 另外,在3451 cm-1处出现了酚—OH的伸缩振动吸收峰,在1481 cm-1处为苯环的特征吸收峰,1275 cm-1处出现C—N的伸缩振动吸收峰,在629 cm-1出的吸收峰为5-溴水杨醛中的溴的特征吸收峰。 紫外和红外图谱表明成功合成了目标席夫碱。
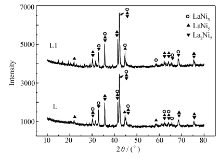
添加1%席夫碱的储氢合金L1与储氢合金L的XRD图如图3所示。 这两种合金有相似的衍射峰,且均由La2Ni7、LaNi5、LaNi3这3种相组成,这3种相是La-Mg-Ni基储氢合金常含有的相[13,14,15]。 从图3可知,添加少量席夫碱不能改变合金的相结构,说明席夫碱只是吸附于合金表面。
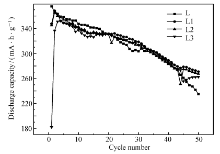
图4为储氢合金电极的50次循环的放电容量图。表1为电极放电性能的相关数据。 Cmax表示最大放电容量, C50为第50次循环的放电容量, C50/ Cmax是第50次循环的放电容量保持率。 由数据可得,电极L的最大放电容量是375 mA·h/g添加席夫碱后,放电容量稍有下降,但放电容量保持率有较大提高,添加5%席夫碱电极放电容量保持率从63%提高到75%。 合金电极的活化次数随席夫碱含量的增加而增加。 从这些数据可以看出,席夫碱的添加可以提高电极放电容量保持率,可能是因为席夫碱能够减缓在强碱电解质中的腐蚀,保护了电极中的活性物质[16,17]。
| 表1 合金电极的放电容量 Table 1 Discharge capacities of the alloy electrodes |
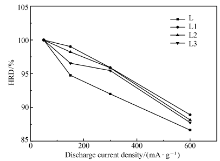
高倍率放电能力主要是电极与电解液间的电荷传递与合金内部的氢扩散决定。图5为合金电极的高倍率放电曲线。 放电电流密度分别为50、150、300和600 mA·h/g。 显然,添加1%席夫碱电极的高倍率放电性能最好,储氢合金电极L相对较差。
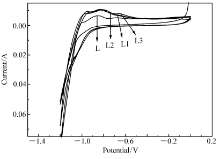
图6为合金电极的循环伏安曲线。 添加席夫碱的3个合金电极在约-0.8 V处出现了阳极峰,峰电流较储氢合金电极L大,表示电极的脱氢反应动力学性能增强。 在-1.0 V处出现了不明显的阴极峰,阴极峰对应的是储氢合金的吸氢反应。 图中随席夫碱含量的变化,循环伏安曲线变化不明显,但相对于储氢合金电极L,峰面积和峰电流均有增加,说明席夫碱的添加可改善储氢合金的吸脱氢动力学性能。
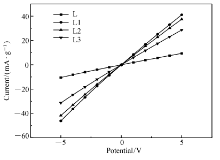
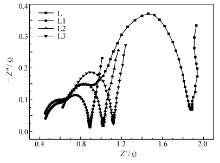
图7为合金电极的线性极化曲线。 交换电流密度 I0,通常可用来描述充放电反应中电极与电解液间氢的转移速率,可根据线性极化曲线斜率及公式计算交换电流密度,计算公式如下[18]:
I0=
式中, R、 T、 F、 η、 Id分别表示气体常数、温度、法拉第常数、过电位、电流密度。 计算得出的交换电流密度值列于表2。 数值越大,表明合金电极表面与电解液接触面的电荷转移速度越大。 可以看出,添加席夫碱合金电极的交换电流密度 I0比未改性合金的交换电流密度 I0有明显增加,说明添加席夫碱后合金电极表面与电解液接触面的电荷转移速度增加,其中电极L1交换电流密度数值最大。
| 表2 合金电极的动力学性能参数 Table 2 Kinetic properties parameters of the alloy electrodes |
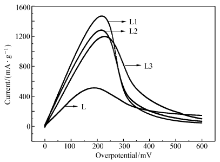
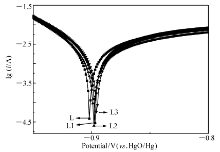
随阳极极化过电位的增加,电极表面电荷转移速度加快,当过电位达到一定值,氢原子在合金内部的扩散成为电极反应的控制步骤[19]。 阳极极化曲线是当过电位达一定值时,会对应一个峰值电流,称之为极限电流密度 IL。 极限电流密度越大,合金内部的氢扩散速率越大。 合金电极的阳极极化曲线如图8所示。 极限电流密度数值列于表2。 从图8与表2可以知道,添加少量的席夫碱后,对比储氢合金电极L,3个电极极限电流密度均有较大幅度的增加,其中电极L1的极限电流密度最大。
将合成的5-溴水杨醛缩苯胺席夫碱以质量分数1%、2%、5%添加到La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60中,对合金进行表面改性。 添加少量席夫碱不能改变合金的相结构。 添加席夫碱后,电极的最大放电容量稍有下降,放电容量保持率有较大幅度提升,其中添加5%席夫碱的负极放电容量保持率从63%提高到75%。 高倍率放电性能也有一定的提升。 因席夫碱有一定的抗腐蚀能力,缓解了强碱电解液对合金的腐蚀。 相对于储氢合金电极L,改性电极的交换电流密度 I0与极限电流密度 IL均有大幅度提高,动电位极化曲线也表明合金电极的抗腐蚀能力变强。 席夫碱可有效改善La-Mg-Ni基储氢合金La0.73Ce0.18Mg0.09Ni3.20Al0.21Mn0.10Co0.60的电化学性能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|