利用Kröhnke方法,以芳基乙酮为原料一锅法简洁地合成了6-芳基-6'-溴-2,2'-联吡啶2b~2d。 通过( R)-3-(4,4,5,5-四甲基-1,3,2-二噁唑硼烷基)-2,2'-乙氧基-1,1'-联萘(( R)-1)与6-溴-2,2'-联吡啶及其衍生物2a~2d的Suzuki偶联, 合成了4种手性6-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'-联吡啶( R)-3a~3d。 将配体( R)-3a~3d应用于苯乙酮的不对称氢转移反应中,配体( R)-3a给出92%的转化率和4%的对映体过量( ee)值。
6-Aryl-6'-bromo-2,2'-bipyridine derivatives 2b~2d were synthesized efficiently from aryl-ethanone by the Kröhnke method in one-pot. Then, four chiral 6-[3-(( R)-2,2'-diethoxyl-1,1'-binaphthyl)]-2,2'-bipyridine ligands ( R)-3a~3d were synthesized by Suzuki coupling of ( R)-3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolanyl)-2,2' -diethoxyl-1,1'-binaphthyl ( R)-1 with 6-bromo-2,2'-bipyridine derivatives 2a~2d. These ligands were applied to asymmetric transfer hydrogenation of acetophenone. The ligand ( R)-3a affords 92% of conversion and 4% enantiomeric excess( ee).
2,2'-联吡啶及其衍生物作为一类重要的联芳杂环化合物,与大多数金属具有很好的配位能力,因此在有机化学、无机化学、超分子化学、材料化学等领域受到广泛关注[1,2,3,4,5]。 自1984年Botteghi小组合成第一例手性联吡啶(4-( S)-异丁基-2,2'-联吡啶)以来[6],它的合成及其应用成为联吡啶化学的新增长点。 先后以萜类,氨基酸和胺类为手性源,合成了不同类型的手性联吡啶并将其用于手性催化及手性识别等领域[7,8,9,10]。 其中,von Zelesky小组以萜类为手性源,开展的工作尤为出色[11,12]。
联萘酚作为一类轴手性化合物,在很多不对称过程中表现出非常出色的手性诱导能力。 对此,我们小组以联萘酚为手性源,成功合成了多种具有C2-对称性、含联萘基团的手性联吡啶,并将其用于手性配合物的合成中[13,14]。
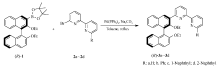
本文报道一类手性联萘基联吡啶( R)-3的合成(如Scheme 1所示)。 利用Suzuki偶联反应,将(3-( R)-联萘基)硼酸片那醇酯( R)-1与溴代联吡啶衍生物2a~2d进行交叉偶联,合成手性联萘基联吡啶( R)-3a~3d,并初步用于一些不对称合成。 在此基础上,探讨手性配体在不对称反应中的应用。
Bruker-300、600 MHz型核磁共振仪(瑞士布鲁克(BRUKER)公司),DMSO-d6或CDCl3为溶剂;RY-1型熔点仪(天津天光光学仪器有限公司),温度计未经校正;LCQ型电喷雾质谱仪(美国菲尼根质谱公司);GmbH VarioEL V2.8型元素分析仪(德国Elementar公司);Bio-Rad FTS-135型傅里叶变换红外谱仪(美国Bio-Rad公司);Polarimeter 341LC型旋光仪(美国Perkin Elmer公司);GC-2010型气相色谱仪(日本岛津公司),使用了Chiralcel DEX CB气相色谱柱。
( R)-1,1'-联(2-萘酚)(98%,99.9%对映体过量( ee)值)购自北京春莆应用技术研究中心。 其它试剂由安乃吉化学采购,均为市售分析纯。 乙醚进行无水无氧处理, N, N, N', N'-四甲基乙二胺(TMEDA)需重蒸处理,其它试剂未经进一步处理直接使用。
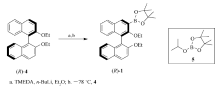
1.2.1 [3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]硼酸片那醇二酯( R)-1的合成 向250 mL单口瓶(经火焰干燥,Ar气保护)中,加入( R)-2,2'-二甲氧基-1,1'-联萘(3.92 g,11.4 mmol)、 N, N, N', N'-四甲基乙二胺(2.60 mL,17.2 mmol)和100 mL无水乙醚,搅拌混合。 在常温下,一次性加入2.5 mol/L的 n-BuLi(5.90 mL,17.2 mmol),搅拌3 h。 将反应混合物冷却至-78 ℃,一次性加入异丙氧基硼酸片那醇二酯(7.00 mL,34.2 mmol)继续搅拌。 将反应体系缓慢升至室温,搅拌过夜。 向反应混合物中加入100 mL的盐酸溶液(1 mol/L,分液,水层用CH2Cl2 萃取(100 mL×2)。 合并有机层,并用无水硫酸镁干燥,滤除硫酸镁、蒸干溶剂,得粗产物。 粗产物柱层析分离纯化,得3.80 g白色固体( R)-1。 产率72%,mp 62~64 ℃,[ α
1H NMR(DMSO-d6,600 MHz), δ:8.42(s,1H),7.94(d,1H, J=9.0 Hz),7.91(t,1H, J=7.8 Hz),7.40(d,1H, J=9.0 Hz),7.35(t,1H, J=7.8 Hz),7.29(d,1H, J=7.8 Hz),7.21(t,1H, J=8.4 Hz),7.17(t,1H, J=8.4 Hz),7.15~7.11(m,2H),4.06~4.02(m,2H),3.73~3.71(m,1H),3.68~3.67(m,1H),1.40(s,12H),1.02(t,3H),0.85(t,3H);IR(KBr disk). σ/cm-1:3055,2976,2927,1620,1350,1144,747;C30H33BO4元素分析值(计算值)/%:C 76.80(76.93),H 6.92(7.10);ESI-MS:469.2 m/z(100,M+1)。
1.2.2 6-溴-2,2'-联吡啶(2a)的合成 根据文献[15]方法合成化合物2a。
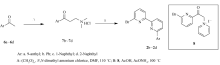
1.2.3 6-芳基-6'-溴-2,2'-联吡啶(2a~2d)的合成 以化合物2b为例:向50 mL单口瓶中,加入苯甲酮(0.720 g,6.00 mmol)、二甲胺盐酸盐(0.530 g,6.60 mmol)、多聚甲醛(0.540 g,18.0 mmol)和DMF(10 mL),并在110 ℃下反应5 h。 减压蒸除溶剂,即可制得Mannich碱7b。 向反应瓶中加入Kröhnke盐8(2.68 g,6.60 mmol)、4.00 g AcONH4和35 mL乙酸,在100 ℃下反应。 12 h后冷却、向反应混合物中加入50 mL的水,有大量沉淀生成。 经过滤、干燥得粗产物。 粗产物柱层析进行分离(石油醚/乙酸乙酯/CH2Cl2体积比16:1:1)、纯化得1.10 g淡黄色固体6-苯基-6'-溴-2,2'-联吡啶(2b)。
产率75 %,mp 108~110 ℃。1H NMR(CDCl3,600 MHz), δ:8.62(dd,1H, J=7.8,0.6 Hz),8.38(dd,1H, J=7.8,0.6 Hz),8.13~8.12(m,2H),7.90(t,1H, J=7.8 Hz),7.80(dd,1H, J=7.8,1.2 Hz),7.70(t,1H, J=7.8 Hz),7.52~7.50(m,3H),7.46~7.45(m,1H);IR(KBr disk), σ/cm-1:3047,2923,1549,1417,1124,760;C16H11BrN2元素分析值(计算值)/%:C (61.4761.76),H 3.34(3.56),N 8.71(9.00);ESI-MS:311.2 m/z(100,M+1)。
6-(1-萘基)-6'-溴-2,2'-联吡啶(2c):产率70%,mp 122~124 ℃。1H NMR(CDCl3,600 MHz), δ:8.48(d,1H, J=7.8 Hz),8.48(d,1H, J=7.8 Hz),8.20(d,1H, J=8.4 Hz),7.96(t,1H, J=7.8 Hz),7.95~7.94(m,2H),7.69(d,1H, J=7.2 Hz),7.64~7.63(m,2H),7.60(t,1H, J=7.8 Hz),7.52(d,1H, J=7.8 Hz),7.50~7.49(m,2H);IR(KBr disk), σ/cm-1:3045,1546,1418,1122,781;C20H13BrN2元素分析值(计算值)/%:C 66.34(66.50),H 3.43(3.63),N 7.37(7.75);ESI-MS:361.1 m/z(100,M+1)。
6-(2-萘基)-6'-溴-2,2'-联吡啶(2d):产率75%,mp 138~140 ℃。1H NMR(CDCl3,600 MHz), δ:8.70(d,1H, J=7.8 Hz) 8.58(s,1H),8.42~8.41(m,1H),8.30(dd,1H, J=8.4,1.2 Hz),8.00~7.98(m,2H),7.96~7.95(s,2H),7.90~7.89(m,1H),7.74(t,1H, J=7.2 Hz),7.54~7.52(m,3H);IR(KBr disk), σ/cm-1:3045,1570,1417,1122,781;C20H13BrN2元素分析值(计算值)/%:C 66.52(66.50),H 3.29(3.63),N 7.58(7.75);ESI-MS:361.1 m/z(100,M+1)。
1.2.4 6-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'-联吡啶及其衍生物( R)-3a~3d 以( R)-3a合成为例:化合物2a(0.234 g,1.00 mmol)、甲苯(10 mL)和Pd(PPh3)4(0.057 g,5.00×10-2 mmol)混合,并在N2气保护下室温搅拌10 min。 向反应混合液中,加入1 mol/L的Na2CO3水溶液(12.0 mL,12.0 mmol)和( R)-1(0.452 g,1.00 mmol),在N2气保护下回流反应24 h。 蒸除溶剂,得到粗产物。 粗产物柱层析分离(CH2Cl2/石油醚体积比1:8)、纯化得到0.370 g白色固体6-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'-联吡啶( R)-3a。
产率72%,mp 134~136 ℃,[ α
6-苯基-6'-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'- 联吡啶( R)-3b:白色固体,产率81%,mp 108~110 ℃,[ α
6-(1-萘基)-6'-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'-联吡啶( R)-3c:白色固体,产率85%,mp 92~94 ℃,[ α
6-(2-萘基)-6'-[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]-2,2'-联吡啶( R)-3d:白色固体,产率90%,mp 94~96 ℃,[ α
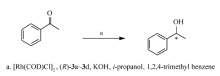
1.2.5 手性联萘基-2,2'-联吡啶配体( R)-3a~3d在不对称氢转移反应中的应用 向25 mL 的三颈瓶中,加入配体( R)-3(1.25×10-2 mmol)、[Rh(COD)Cl]2(0.0012 g,2.5×10-3 mmol)和甲苯(1 mL)搅拌使其全部溶解。 加入KOH-异丙醇溶液(0.50 mL,0.10 mo/L)和5.0 mL 异丙醇,并在N2气保护下回流。 反应1 h 后,冷却至室温,搅拌过夜制备催化剂。 向催化体系中加入内标1,2,4-三甲基苯(0.10 mmol,140 mmol和苯乙酮(1.00 mmol,117 μL),回流反应,回流前取出部分反应液作为标准液使用。 0.5~6 h后,取出反应液测定它的转化率和 ee值。
Scheme 2所示的是[3-(( R)-2,2'-二乙氧基-1,1'-联萘)基]硼酸片那醇二酯( R)-1的合成路线。 轴手性化合物( R)-2,2'-乙氧基联萘(( R)-4)在室温下与1.5当量的正丁基锂发生锂化反应,低温下与异丙氧基硼酸片那醇酯5反应,制得目标化合物( R)-1,产率为72%。
如Scheme 3所示,以芳基乙酮为原料经两步反应合成6-芳基-6'-溴代-2,2'-联吡啶(2b~2d。 芳基乙酮6在酸催化下与多聚甲醛进行Mannich反应,生成Mannich碱7。 与Kröhnke盐8[16]进行缩合、环化、芳构化等反应,生成6-芳基-6'-溴代联吡啶2b~2d。 当芳基乙酮6的芳基为苯基或萘基(6b~6d)时,可顺利得到相应的目标产物(2b~2d)。 但芳基取代基为9-蒽基(6a)时,Mannich反应不能进行(TLC检测),因此没有得到目标化合物。 这可能是由于空间位阻大,使酮羰基和蒽基不能处于共平面,导致酸催化下的烯醇式结构不稳定引起的。 另一种溴代联吡啶6-溴-2,2'-联吡啶2a是根据已有的文献以2,6-二溴吡啶为原料经两步反应制得[15]。
如Scheme 1所示,手性联萘基硼酸片那醇化合物( R)-1与溴代联吡啶衍生物2a~2d进行Suzuki偶联合成了手性联萘基联吡啶衍生物( R)-3a~3d,产率在70%~90%。
不对称氢转移反应具有操作简单,适用于多种官能团底物等特点。 尤其是还原酮转化为醇的反应,作为基础反应用于配体催化效果的评价。 这里选择了铑为中心金属,异丙醇为氢源的苯乙酮还原反应[17]。 测试结果显示只有配体( R)-3a具有催化活性,苯乙酮的转化率可达92%,但对映选择性仅为4%。
利用Kröhnke 法,以芳基乙酮6b~6d为起始原料一锅法,简捷地合成了芳基取代的溴代联吡啶衍生物2b~2d。 最后,利用Suzuki偶联反应,将轴手性联萘衍生物引入到2,2'-联吡啶的6-位,成功合成了手性联萘基联吡啶衍生物( R)-3a~3d。 将配体( R)-3a~3d应用于不对称氢转移反应中,结果显示只有配体( R)-3a具有较高的反应活性,但对映选择性差。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|