通过基因重组技术,克隆表达了 β-葡聚糖特异性结合美洲鲎G因子 α亚基片段a(G αa)蛋白,并建立了 β-葡聚糖比浊检测方法。 克隆的G αa基因相对分子质量为40000(1251 bp),浓度为2 g/L,纯度达到98%以上。 该蛋白能与 βG特异性结合,紫外分光光度计在340 nm下检测的吸光度与 βG含量呈正线性相关,线性范围3.125~200 mg/L, R2=0.997,检测限3.125 mg/L。 结合力实验表明,该蛋白与 βG具有良好的亲和性及特异性。 该方法具有成本低、快速、专一性强等特点。
In this paper, a beta-glucan binding protein of horseshoe crab(limulus polyphemus) factor G-subunit α fragment-a was cloned, expressed and purified. A turbidimetry assay for the detection of beta-glucan was established. The DNA fragment of the binding protein gene was cloned into an expressional plasmid pET-15b. The protein was expressed with 6x-Histag on N-terminal and purified with Ni-column. The purified protein has relative molecular mass of 40000(1251 bp) on SDS-PAGE and the concentration is 2 g/L with the purity of >98%. The highly purified protein can combine with beta-glucan specifically with an affinity constant KD of 3.14×10-9 mol/L. The absorbance measurement at 340 nm using the ultraviolet spectrophotometer shows that the absorbance is linearly correlated with the concentration of beta-glucan. The linear range is 3.125~200 mg/L, R2 is 0.997, and the detection limit is 3.125 mg/L. The novel turbidimetry assay for the detection of beta-glucan has low cost, rapid, and highly sensitive and specific.
β-葡聚糖( βG)来源于新鲜的食品啤酒酵母、燕麦、食用菌类等。 根据糖键结构差异可分 β-(1→3)-葡聚糖和 β-(1→6)-葡聚糖,其中 β-葡聚糖的活性结构是由葡萄糖单位组成的多聚糖,它能够活化巨噬细胞、嗜中性白血球,从而提高白细胞素、细胞分裂素和特殊抗体的含量,全面刺激机体的免疫系统。 此外, β-葡聚糖还具有清除游离基、抗辐射、溶解胆固醇,预防高脂血症及抵抗滤过性病毒、真菌、细菌等感染的功能;在治疗肿瘤、肝炎、心血管、糖尿病和降血脂、抗衰老等方面也有独特的生物活性[1,2,3,4,5]。 因此, β-葡聚糖含量的测定在现代生物检测具有很高的应用价值。
从国内外的研究现状可以了解到,目前用于检测 β-葡聚糖的方法可归纳为以下几种:1)粘度法测定结果误差很大[6];2)沉淀法局限性在于抽提过程不能完全排除其它物质的干扰[7];3)刚果红用于测定啤酒中 βG含量,但不适用于测定固态供试品中 βG含量[8,9];4)双酶法有较高的专一性和准确性,是目前国际上较通用的测定方法,缺点是测定时间长,试剂盒单价高,试剂保存时间短[10];5)荧光法常在一些啤酒企业中使用,但其荧光物质的荧光性在光照条件下不稳定,随光照时间的增加会迅速下降[11];6)苯酚-硫酸法对 βG无专一性[12];7)鲎试剂法(鲎的血细胞提取物)主要应用于检测血液中 βG含量。 但是鲎属于天然材料,过度提取易造成资源枯竭,存在成本高、测定时间长的缺点[13,14,15,16]。
目前对 βG浓度的测定方法均不是很理想,存在灵敏度和专一性差,价格昂贵,检测时间长等缺点。 因此迫切需求一种高稳定性,低成本,快速测定 βG的方法。
本研究利用基因重组技术,克隆表达了与 β-葡聚糖特异性结合美洲鲎G因子 α亚基片段a蛋白,并建立了一种特异性蛋白检测 β-葡聚糖的比浊法,当样品中含有 βG时,蛋白与 βG特异性结合,在紫外可见分光光度计下,测得在340 nm下蛋白与 βG复合物的吸光度值与 βG含量呈正相关。 随后对该方法进行了精确度和准确度的评估,为推进 β-葡聚糖检测提供了新的可能性。
LifeTouch基因扩增仪TC-96/G/H(b)B (上海珂淮仪器有限公司);UV-2550型紫外可见分光光度计(日本岛津公司);HZQ-F160型全温振荡培养箱(哈东联公司); HPX-9162 MBE型电热恒温培养箱(上海博迅实业有限公司医疗设备厂);SPH-211B型恒温培养摇床(上海世平实验设备有限公司);生物分子相互作用系统(自制);FYY25001-RO型基础应用型纯水机(青岛富勒姆科技有限公司)。
表达宿主 E.coli BL21和大肠杆菌 E.coli DH5 α(本实验室保存);工程菌JM109-pMD19-T-G αa(上海生物工程有限公司构建);BamHⅠ、NdeⅠ酶、Taq聚合酶、dNTP和10×PCR buffer(长春宝泰克制药有限公司);低相对分子质量标准蛋白质Marker(上海生物化学研究所);DNA胶回收试剂盒(上海生物工程有限公司);His-Binging-resin纯化柱(上海悦克生物科技有限公司)。
1.2.1 目的基因的克隆 根据GenBank:AB547712.1上登记的美洲鲎属G因子 α亚基片段a(G αa)的基因序列,大小是1251 bp,合成为JM109-pMD19-T- G αa的工程菌。 通过表达载体的多克隆位点设计特异性引物,分别引入BamHⅠ和NdeⅠ酶切位点(斜体带下划线)。引物序列F 5'-CATATGAATACACCTTCTCCTGTTGACG-3',引物R 5'-GGATCCTGTAACCTTTGT-3'。
用DNA提取试剂盒对工程菌进行目的基因片段的回收,采用PCR技术克隆G αa片段,反应体系为:模版1 μL,引物2 μL ,10×PCR buffer 5 μL,Taq聚合酶2 μL,dNTP 2 μL,双蒸水26 μL。 反应条件为:95 ℃预变性2 min,95 ℃变性15 s,50 ℃退火30 s,68 ℃延伸2 min,30个循环,68 ℃延伸5 min。 PCR扩增产物采用DNA胶回收试剂盒回收。
1.2.2 重组表达质粒pET-15b- G αa的构建 将回收的目的片段在T4DNA连接酶作用下与pUCm-T连接,构建克隆载体pUCm-T-G αa。 转化至E.coli DH5 α,蓝白斑筛选阳性转化子,提取质粒用BamHⅠ和NdeⅠ双酶切,鉴定正确后,回收G αa后与经同样双酶切的pET-15b连接,构建重组表达质粒pET-15b-G αa,转化到大肠杆菌 E.coli DH5 α中,小量提取质粒,质粒鉴定正确后,送到上海生工生物工程上海(股份)有限公司测序,测序结果无误,可以将质粒转化至表达宿主 E.coli BL21中。
1.2.3 重组菌的表达纯化 将含有重组质粒的 E.coli BL21阳性菌株按体积比1:50到LB(Amp 100 mg/L)液体培养液中活化37 ℃,180 r/min过夜,次日转接培养的菌液按体积比120到LB(Amp 100 mg/L)液体培养液中扩大,37 ℃,180 r/min培养至OD600约为0.8(约在4 h),加入IPTG至终浓度为1 mmol/L,继续培养48 h,培养后,将培养液进行离心分离,回收所得的沉淀物(菌体)。 将沉淀物用PBS洗涤2次,然后用NPI-1重悬菌体,放一定量的溶菌酶,通过反复冻融和超声破碎,工作参数:工作时间10 s,间歇时间9 s,功率200 W,循环30次。 离心10000 r/min,4 ℃离心10 min取上清。 过柱纯化前将样品溶液用0.22 μm孔径滤膜过滤。 过Ni柱时按照Qiagen公司的Ni-NTA亲和层析柱的说明书纯化目的蛋白,经过透析去除多余的咪唑,浓缩,收集每步样品进行SDS-PAGE凝胶电泳检测。
1.2.4 方法学建立 实验原理:上述纯化蛋白与 β-葡聚糖溶液能够发生特异性结合形成免疫复合物。 该免疫复合物溶液的浊度随着 βG浓度的变化而改变,这种变化可利用紫外可见分光光度计进行测定。 当340 nm波长光线通过该反应溶液时,被免疫复合物吸收,导致复合物在该波段的吸光值增大。 吸光值与免疫复合物含量呈正相关,即当蛋白质浓度固定时,免疫复合物的浊度与样品 βG含量成正比。 通过测得的吸光值绘制出标准曲线,从而达到对未知 βG浓度的定量检测。
本文比较不同浓度的蛋白质跟相同浓度的 βG反应后,在340 nm波长下得到的吸光值,找到最适合反应的蛋白质浓度。 在该蛋白质浓度下加入梯度稀释的 βG,绘制出复合物吸光值的曲线,逐步找到最佳的线性范围。 通过5组实验,算出精确度,根据结果绘制标准曲线。
1.2.5 方法学回收率的评估 根据林伟静等[17]在2011年在燕麦中提取了 β-葡聚糖,参考她的方法在燕麦中提取了 βG,燕麦籽粒→粉碎→用不同PH的缓冲溶液分散→搅拌提取→(→等电点除蛋白)→离心分离→收集上清,对上清样品进行加标回收,评估了实验方法的准确度。
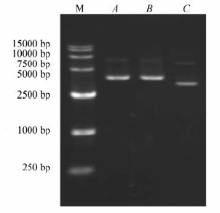
采用PCR技术对pMD19-T-G αa质粒中G αa进行克隆扩增,产物经0.8%琼脂糖凝胶电泳结果显示,扩增目的条带相对分子质量大小为1251 bp左右,与Genebank上相符,结果如图1所示,表明目的基因已经大量获得。
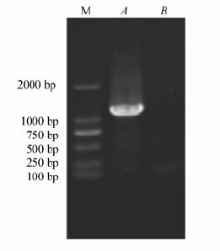 | 图1 pMD19-T-G αa质粒 PCR产物的0.8%琼脂糖凝胶电泳图Fig.1 0.8% Agarose gel electrophoresis of pMD19-T-G αa PCR amplified productsM:Maker-DL2000; lane A:blank control; lane B:pMD19-T-G αa PCR amplified products |
用试剂盒提取pET-15b-G αa及pET-15b质粒,带有G αa目的片段的质粒明显比pET-15b多1251 bp,核酸电泳结果如图2,说明pET-15b-G αa质粒初步构建成功。
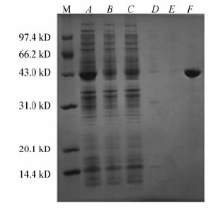
对重组工程菌采用IPTG诱导表达G αa蛋白,过Ni柱纯化蛋白,用NPI-1、NPI-20、NPI-30除去杂蛋白,最后用NPI-200洗脱纯净的目的蛋白,过镍柱每步流出样经过SDS-PAGE鉴定,蛋白电泳结果如图3所示,在约40 kD处有一条明显表达带,与预期蛋白相对分子质量相符。
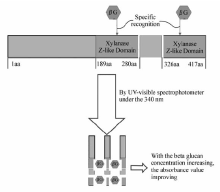
目的氨基酸C末端侧具有被认为是 βG结合结构域2聚体的木聚糖Z样结构域,相当于美洲鲎属G因子 α亚基的氨基酸序列的从N末端起第189位~第280位的氨基酸和第326位~第417位的氨基酸序列部分。 在溶液中有 βG存在时, βG会与目的蛋白的特定结构域结合,形成复合物,这种复合物用紫外可见分光光度计在340 nm波长下,其吸光值比空白值大,而且随着 βG浓度的增加呈正相关,原理如图4所示。
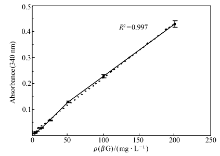
配制 βG标准品的浓度为200 mg/L,将 βG按体积梯度稀释,用蒸馏水代替 βG进行测定作为空白值。 向比色皿内加入(0.3 mL)待测样品和100 mg/L(3 mL)的特异性蛋白质,在37 ℃混匀,反应5 min。 用紫外-可见分光光度计,在340 nm波长下测定其吸光值,同一样品测5次,再做5组相同的实验。 记录实验数据并计算均值,标准差和变异系数,根据所得数据绘制标准曲线。 经实验测得该方法的批内和批间变异系数均小于5%,在允许的范围内。 结果如图5所示, Y轴为实际吸光度值减去空白值, X轴为不同 βG的浓度,标准曲线检测下限为3.125 mg/L,线性范围是3.125~200 mg/L, R2=0.997。
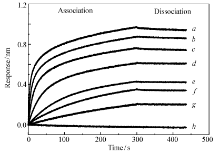
用生物分子相互作用系统测定目的蛋白与 βG的结合/解离平衡常数。 在SA传感器前端共价偶联50 mg/L βG标准品,与浓度分别为1000、500、250、125、72.5、36.25、18.125和0 mg/L的目的蛋白进行结合反应,反应时间300 s,然后将传感器置于PBS中进行解离反应,反应时间140 s,得到结合与解离曲线。 结果如图6所示, X轴为反应时间, Y轴为传感器响应值。 反应曲线经数据分析,目的蛋白与 βG的结合/解离平衡常数 KD=3.14×10-9 mol/L时用上述方法分别对50 mg/L脂多糖、糖原和海藻糖与目的蛋白间的结合/解离平衡常数进行测定,结果表明,目的蛋白与脂多糖、糖原和海藻糖物无亲合力。 因此,目的蛋白与 βG的结合有高度专一性。
对提取的上清样品进行 βG的检测,在已知 βG浓度的燕麦样品中进行加标回收实验,将配制好的4个已知不同浓度(在标准曲线范围上)的 βG标准品0.3 mL加入2 mL的上清样品,与终浓度为100 mg/L特异性蛋白质混合,补充PBS使溶液体积达到3.3 mL,在37 ℃混匀,反应5 min,同一浓度的 βG检测5次。 用蒸馏水代替 βG的样品进行测定作为空白值,使用紫外-可见分光光度计,在340 nm波长下进行测定,测得特定蛋白与 βG复合物的吸光值的变化,将测得的吸光值与空白值做差,得到的结果与图5标准曲线中相同浓度对应的吸光值进行对比,算出准确度(回收率)。 结果如表1所示,回收率在97%~101%之间,在允许范围内,准确度较好。
| 表1 回收率评估结果 Table 1 Recovery evaluation result |
本文成功克隆了与 β-葡聚糖特异性结合美洲鲎G因子 α亚基片段a的基因,相对分子质量大小为40000(1251 bp)。 表达并纯化了该基因,浓度为2 g/L,纯度高达98%以上。 用该蛋白检测 β-葡聚糖含量的标准曲线 R2=0.997,检测下限为3.125 mg/L。 蛋白与 β-葡聚糖的结合有高度的专一性,结合/解离常数 KD=3.14×10-9 mol/L。该方法的批间和批内变异系数均小于5%,准确度(回收率)在97%~101%之间,均在允许范围内。
本文实验所用原料均为自己表达的蛋白,弥补了酶法试剂盒单价高, 试剂保存时间短的特点,无需利用天然珍稀材料鲎(现已列入二级保护动物)试剂,有效防止资源枯竭,成本变高带来的隐患。 本文实验简洁,结果回报时间短,只需5 min,便于及时反馈信息,可节约大量的人力物力,有利于大批量样品的处理,在应用中有明显优势。 蛋白与 βG有高度专一的亲和性,结合解离常数小,干扰因素少,结果判断更加客观、准确。 本文的实验方法和实验结果表明,这种特异性蛋白检测 β-葡聚糖的比浊法具有低成本、快速、高灵敏等特点,弥补了现今国内外方法的不足。 在食品检测、医药开发、化妆品检测和疾病检测等领域,具有较高的实用价值和广阔的市场前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|