分别通过水热法和室温挥发法合成了2,2'-联咪唑(H2biim)镍、镉配合物([Ni(H2biim)3](phth)(phth,邻苯二甲酸根)(1)、[Cd(H3biim)2Cl4](2)),并通过X射线单晶衍射、元素分析和红外等技术手段对它们进行了表征。 单晶X衍射结果表明,配合物1的配离子中心镍离子周围的配体以3个中性联咪唑分子形式分别进行二齿螯合配位,构成六配位的畸变八面体构型,邻苯二甲酸根离子在外界与配体形成丰富的氢键;而在配合物2中,两个联咪唑配体却以含有氢质子的阳离子H3biim+形式与中心镉离子单齿配位,镉离子同时结合4个氯原子形成六配位配位环境。 通过紫外光谱、荧光光谱和黏度法测试结果表明配合物1和2分别与小牛胸腺DNA( ct-DNA)以经典插入和部分插入模式进行相互作用。
Two complexes {[Ni(H2biim)3](phth)}(H2biim=2,2'-biimidazole, phth=phthalate)(1) and [Cd(H3biim)2Cl4](2) were synthesized under hydrothermal and common solution conditions, and characterized by elemental analysis, IR spectroscopy and single crystal X-ray diffraction analysis. Complex 1 consists of [Ni(H2biim)3]2+ cations hydrogen bonds with phthalate dianions. Each Ni atom coordinates six N atoms of three chelating biimidazole ligands in a pseudo-octahedral geometry. Complex 2 is a neutral compound. One N atom in H2biim is protonated, forming a H3biim+ cation. The central metal Cd is coordinated by two unidentate H3biim+ ligands and four Cl atoms. The binding of the complexes with calf thymus DNA has been investigated by UV and fluorescence spectroscopy and viscosity measurement. All of the results indicate that the complexes 1 and 2 bind to DNA base pairs in intercalation and partial intercalation modes, respectively.
由于生物无机化学的兴起与快速发展,金属离子及其配合物在生物学的应用越来越受到关注,对生物功能的模拟研究,成为近年来的研究热点领域之一。 通过研究金属配合物与DNA的相互作用,有助于从分子水平上了解生命现象的本质[1]。 最近一些金属配合物,如Co3+、Ni2+、Cu2+等配合物具有很好的诱导DNA缩合的能力,将这类金属配合物作为安全高效的非病毒型基因载体应用于基因治疗领域备受重视和关注[2,3,4]。
咪唑是一种被广泛用于生物和医药领域的化学药剂。 咪唑及其衍生物的过渡金属化合物具有很好的生物活性[5]。 2,2'-联咪唑(H2biim)有非常丰富的配位形式,可以和过渡金属分别以H3biim+、H2biim、Hbiim-及biim2- 4种形式进行配位,从而形成结构各异、性能多样的配合物[6,7,8,9,10,11,12,13,14,15,16,17]。 本文报道了2,2'-联咪唑与过渡金属Ni2+、Cd2+分别以不同配位模式形成的两种配合物晶体的合成、表征及其与小牛胸腺DNA的相互作用。
2,2'-联咪唑按文献[18,19]方法合成;小牛胸腺DNA( ct-DNA)(生化试剂,Sigma公司);三羟甲基氨基甲烷(Tris.,(CH3OH)3CNH2,阿拉丁试剂公司);邻苯二甲酸氢钾(KHphth,上海恒远生物科技有限公司)、醋酸镍(Ni(OAc)2,西安化学试剂厂)、氯化镉(CdCl2,西安化学试剂厂)、氢氧化钾(天津市天力化学试剂有限公司)均为分析纯试剂,使用前未经纯化处理,纯净水(杭州娃哈哈集团有限公司)。
Vario EL-IIIG型元素分析仪(德国EA元素分析系统公司);EQUINOX55型红外光谱仪(德国Bruckr公司);STA449C型热分析仪(N2气氛,流速30 cm3/min,升温速率为10 ℃/min,德国Netzsch公司);Bruker Smart APEX CCD型X射线衍射仪(德国Bruckr公司);1800型紫外可见分光光度计(日本岛津公司);Ubbeoldhe型黏度计(上海申玻玻璃仪器公司),F-4500型荧光分光光光度计(日本日立公司)。
1.2.1 配合物1{[Ni(H2biim)3](phth)}的合成 将Ni(OAc)2 (0.124 g,0.5 mmol)、H2biim(0.067 g,0.5 mmol)、邻苯二甲酸氢钾KHphth(0.102 g,0.5 mmol)和8 mL水混合,在空气中搅拌30 min并用氢氧化钾调节pH值为6~7,将混合液放入体积为23 mL带聚四氟乙烯内胆的不锈钢反应釜中,封好后放入烘箱,加热到160 ℃并保持4 d,然后自然降温至室温,得到紫色片状晶体。 元素分析计算值/%:C 49.90,H 3.52, N 26.89;实验值/%: C 49.39,H 3.24,N 26.40。 红外光谱(KBr压片), σ/cm-1:3127~2527(br,m),1542(s),1487(m),1398(vs),1115(m),991(m),756(m),689(m)。
1.2.2 配合物2[Cd (H3biim)2Cl4]的合成 将H2biim(0.204 g,1.5 mmol)悬浮于50 mL的蒸馏水中,持续剧烈搅拌下加入CdCl2·2.5H2O(0.137 g,0.6 mmol)固体,形成悬浮液,向其中加入少量稀盐酸溶液直至固体刚刚溶解,搅拌30 min,形成无色溶液,过滤,在空气中缓慢蒸发溶剂,30 d,有淡黄色棒状晶体析出。 元素分析计算值/%:C 27.45,N 21.36,H 2.67;实验值/%:C 26.99,N 20.84,H 2.45。 红外光谱(KBr压片), δ/cm-1:3156~2790[ ν(NH)],764,672[ δ(H2biim)]。
1.2.3 化合物与DNA相互作用实验 采用经典方法[20,21]配制与DNA相互作用实验所需试剂、缓冲溶液并进行相关实验。
挑选大小分别为0.49 mm×0.19 mm×0.15 mm、0.38 mm×0.27 mm×0.22 mm的配合物1、2单晶样品,置于Bruker Smart APEX CCD单晶衍射仪上,用Mo Kα辐射( λ=0.071073 nm),以 φ-ω扫描方式收集衍射数据。 对所得数据进行Lp因子及半经验法吸收校正,晶体结构采用SHEXTL-97[22]程序由直接法解出。 对氢原子和非氢原子分别采用各向同性和各向异性热参数,并用理论加氢法得到氢原子位置,用全矩阵最小二乘法进行结构修正(有关晶体学数据见表1)。
| 表1 配合物的晶体学参数 Table 1 The crystal parameters of complexes |
配合物1是由[Ni(H2biim)3]2+阳离子和邻苯二甲酸根阴离子组成的。 每一个结构单元是由两分子{[Ni(H2biim)3](phth)}组成,分别是{[Ni(1)(H2biim)3](phth)}和{[Ni(2)(H2biim)3](phth)}。 每个配离子的中心NiⅡ与3个中性联咪唑配体分子配位,形成了扭曲的八面体配位结构,如图1 A。 部分键长键角数据见表2。 二齿螯合配位的配体与金属之间的N—Ni—N键角平均只有79°,而Ni—N之间的键长在0.2072(2)~0.2137(2) nm范围内,这比类似结构的{[NiII(Hbim)3](NMe4)}中的相应键长(0.196(3)~0.219(2) nm)要略长一些[23]。 在配合物中,配体的两个咪唑环几乎共面,N—C—C—N的扭角小于10°,而且为了更好地与NiⅡ配位,配体分子的两个咪唑环互相靠近,例如{[ Ni(1)(H2biim)3](phth)}中的N1—C3—C4和N2—C3—C4的键角分别为118.4°和129.6°。 晶体结构中,羧基氧原子与未配位的配体氮原子之间所存在着丰富而复杂的氢键N—H••••O键,如图1 B,部分氢键参数见表3。 在{[Ni(1)(H2biim)3](phth)}中,每一个配阳离子周围通过7个N—H••••O氢键连接3个邻苯二甲酸根阴离子, N—H••••O键的键长在0.2693(3)~0.3028(3) nm之间;而在每一个[Ni(2)(H2biim)3]+阳离子周围则通过6个较强的N—H••••O氢键连接4个邻苯二甲酸根阴离子, N—H••••O键的键长在0.2674(3)~0.2788(3) nm之间。 相邻的配合物阳离子的金属原子之间的平均距离为0.76 nm。
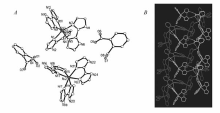 | 图1 {[Ni(H2biim)3](phth)}的晶体结构图( A),氢键相互作用图( B)Fig.1 The crystal structure( A) and hydrogen-bonding interaction( B) between the sheets in the structure of {[Ni(H2biim)3](phth)} |
| 表2 配合物1的选择键长和键角 Table 2 The data of selected bond lengths(nm) and bond angles(°) of complex 1 |
| 表3 配合物1的氢键键长和键角 Table 3 The data of bond lengths(nm) and bond angles(°) of hydrogen bonds of complex 1 |
配合物2的每个结构单元中也包含两个中性[Cd(H3biim)2Cl4]分子,两个分子仅仅是键长键角参数略有不同,其配位模式完全相同。 其中每个Cd2+与4个Cl原子和2个H3biim+配体阳离子的非氢氮原子形成六配位的稍有畸变的八面体构型。 如图2 A,部分键长键角数据见表4。 键角∠N(9)—Cd(1)—N(13)= 177.9(4)°,∠Cl(8)—Cd(1)—Cl(6)=179.55(15)°,∠Cl(7)—Cd(1)—Cl(5)=179.43(15)°,非常接近于180°,因此是一个接近于理想八面体的立体结构,Cl(7)—Cd(1)—Cl(5)处于轴向位置。 与配合物1不同的是,中性的H2biim分子在酸性配合物合成环境中质子化,成为H3biim+配体阳离子,因此在配合物中只有唯一的一个非氢氮原子单齿配位,两个配体阳离子以反式排列在金属周围。 Cd—N的键长比[Cd(H2biim)2(Htere)2](Cd(1)—N(1)=0.2323(2) nm,Cd(1)—N(2)=0.2291(2) nm)中的略长一些[24]。 由于1位上的一个氮原子质子化,H3biim+中的两个咪唑环因为位阻发生了扭曲,其扭角为30°。 Cd—Cl的键长比[CdCl2(Me2biim)] n(Cd—Cl1= 0.2398(4) nm,Cd—Cl2=0.2400(4) nm)也略长一些[25]。 在晶体结构中,卤素原子作为电子受体,与每个配体中的两个N—H键形成N—H••••Cl氢键,如图2 B,氢键参数见表5。 配合物分子之间,每个H3biim+的咪唑环上未质子化的N—H键与相邻分子中轴向位置的氯原子存在氢键作用,这样使分子之间由于氢键而形成了一维链,同时,质子化的咪唑环上的N—H键与相邻链上的轴向氯原子之间也存在氢键作用,将一条条一维链联结成了二维的格子状网络结构,而且相距较近的咪唑环之间相互平行,平均距离为0.34 nm,存在π-π堆积作用,使晶体结构更加稳定,如图2 C。
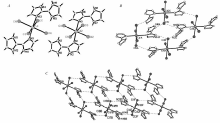 | 图2 [Cd (H3biim)2Cl4]的晶体结构( A)、氢键相互作用图( B)及二维结构图( C)Fig.2 The crystal structure( A) and hydrogen-bonding interaction( B) and 2-D structure( C) of [Cd (H3biim)2Cl4] |
| 表4 配合物2的选择键长和键角 Table 4 The data of selected bond lengths(nm) and bond angles(°) of complex 2 |
| 表5 配合物2的氢键键长和键角 Table 5 The data of bond lengths(nm) and bond angles(°) of hydrogen bonds of complex 2 |
2.2.1 镍、镉配合物与DNA作用的紫外吸收光谱 从图3可已看出,随着向配合物中滴加 ct-DNA的量的增加,配合物紫外吸收光谱的强度发生了变化,配合物的紫外吸收峰发生红移(≤2 nm),同时发生了较为明显的减色效应,说明配合物与DNA之间存在较强的相互作用。 配合物与 ct-DNA的结合常数可以通过以下公式求得:
c(DNA)/( εA- εF)= cDNA/( εB- εF)+1/ Kb( εB- εF)
式中, c(DNA)为DNA的浓度, εA、 εF和 εB分别为在不同DNA浓度下、游离的以及与DNA键合饱和的配合物摩尔消光系数。 以 c(DNA)/( εA- εF)对 c(DNA)作图,求斜率和截距之比,得到结合常数 Kb。 利用配合物在275 nm左右的吸收峰强度变化进行线性拟合,求得配合物1和配合物2与DNA的结合常数分别是8.88×105和1.89×105。 由此可见,配合物1与DNA相互作用强于配合物2。 配合物1与DNA的结合常数比文献报道的经典金属配合物插入剂[Ru(phen)2(dppz)]2+(106~107)略小[26],但比相似结构其它配体的Ni(Ⅱ)配合物结合能力强[27]。 配合物2与DNA的结合常数也比文献报道的[Cd(H3biim)2(NCS)2Cl2]与DNA的结合常数1.98×104大了一个数量级[28]。 根据结合常数 Kb的大小可以推测,两种配合物与DNA是以插入方式结合,但插入作用的强度不很大,尤其配合物2[29]。 这可能是由于两种配合物结构虽然含有共平面联咪唑环,但比较两种配合物的单晶结构,发现配合物1中联咪唑的平面性更好一些。
2.2.2 镍、镉配合物与DNA作用的荧光发射光谱 从图4可以看出,配合物与DNA作用后,其荧光光谱强度随着DNA浓度的增大而增大。 化合物小分子若插入DNA双螺旋碱基对之间,从溶液的亲水环境进入DNA内腔的疏水环境,避免了溶剂分子的猝灭,即发生强烈的荧光敏化现象[30]。 随着DNA浓度的增大,配合物的荧光强度增强程度明显,尤其配合物1,同时配合物2还发生了一定程度的红移现象。 这说明配合物与DNA可能是以插入的模式作用的。 根据增色程度大小判断,配合物1与DNA的作用更强,这可能与二者的结构不同有关[31],同时也和与DNA相互作用的紫外吸收实验结果一致。
2.2.3 黏度分析 光谱法对于确定化合物与DNA的作用模式只能提供与DNA发生了一定相互作用的必要证据。 在缺少晶体结构资料的情况下,黏度测定是检测化合物与DNA是否以插入方式结合的最有效方法,其结果比光谱数据更具说服力[32]。 从图5可以看出,随配合物1浓度的增加,DNA相对黏度缓慢增大。说明配合物1与DNA的结合模式可能是插入模式,因为若配合物插入到相邻碱基对的中间,就会导致DNA双螺旋链的拉伸,提高了DNA的黏度[33]。 相反,随配合物2浓度的增加,DNA相对黏度在减小,从这一现象可以排除配合物2与DNA以经典的插入方式作用,可能以部分插入方式与DNA作用[34]。
分别以水热法和普通溶液法合成了联咪唑的2种不同配位模式的金属配合物。 结果表明,[Ni(H2biim)3](phth)中3个联咪唑配体分子围绕中心离子Ni2+,以二齿螯合配位方式形成六配位构型的配离子,配合物通过外界的邻苯二甲酸根与配体之间丰富而多样的氢键形成了超分子结构;[Cd (H3biim)2Cl4]则是以2个含有氢质子的联咪唑阳离子进行单齿配位,结合4个氯离子与Cd2+形成了六配位的中性配分子。 [Ni(H2biim)3](phth)和[Cd (H3biim)2Cl4]配合物由于结构不同,导致了与 ct-DNA分别以插入或部分插入模式进行相互作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|