共同通讯联系人:刘益林, 讲师; Tel/Fax:0745-2851014; E-mail:liuyilinhn@126.com; 研究方向:有机催化与合成
发展了一种可见光诱导的活泼烯烃串联自由基环化合成含氟异喹啉二酮的反应。 在可见光诱导下,多种 N-烷基 -N-甲基丙烯酰基苯甲酰胺与二氟溴乙酸乙酯发生自由基串联环化反应,以66%~75%的产率合成了一系列具有潜在生理活性的二氟烷基化异喹啉二酮。 此研究为合成具有潜在药用价值的氟取代异喹啉二酮提供了一条高效、条件温和的途径。
Co-corresponding author:LIU Yilin, lecturer; Tel/Fax:0745-2851014; E-mail:liuyilinhn@126.com; Research interests:organic catalysis and synthesis
A visible-light-induced cyclization reaction of activated alkenes leading to difluoroacetating isoquinolinedione was developed. By visible-light photoredox catalysis, various N-alkyl- N-methacryloyl benzamides underwent radical cascade cyclization smoothly and afforded a series of difluoroacetating isoquinolinediones in 66%~75% yields, providing a highly efficient, mild means to fluorinated isoquinolinediones with potential bioactivity.
二氟亚甲基基团(CF2)是一种重要的含氟结构单元,在医药、农药和材料等领域得到广泛应用[1,2]。 这种结构单元在立体位阻和电子效应上可作为氧氧原子及羰基的生物电子等排体。 在这些含二氟亚甲基的基团中,由于其容易被修饰,二氟乙酸乙酯基团(CF2CO2Et)得到合成研究者的青睐。 另一方面,异喹啉-1,3-二酮广泛存在于天然产物和药物化合物中,是许多潜在生理活性的重要构建骨架(Scheme 1)[3,4,5,6,7]。 因此,在异喹啉-1,3-二酮中引入含氟基团,特别是CF2CO2Et基团,具有重要的意义。 最近,以廉价易得的BrCF2CO2Et做为氟源,通过光催化烯烃的双官能团化于有机分子中引入CF2CO2Et策略得到化学家的关注[8,9,10,11]。 例如,2015年,Zhu课题组[11]利用 fac-Ir(ppy)3在可见光作用下用催化多取代烯丙醇类化合物发生串联自由基插入/1,2-芳基迁移合成一系列CF2CO2Et取代的芳酮类化合物。 基于以上研究背景,我们设想通过可见光诱导 N-烷基- N-甲基丙烯酰基苯甲酰胺与BrCF2CO2Et发生串联自由基插入/C-H环化构筑二氟烷基化异喹啉-1,3-二酮的方法。 然而,据我们所知,光催化于异喹啉二酮骨架中引入CF2CO2Et的迄今还未见报道。 因此,基于我们合成含氟杂环化合物研究兴趣的拓展[12,13],本文发展了一种可见光诱导的活泼烯烃与二氟溴乙酸乙酯经过串联自由基环化合成含氟异喹啉二酮或吲哚酮的反应(Scheme 1)。 此方法底物适应范围较广,操作简单,反应条件温和,且产率高达75%。
所用的芳基酰氯、草酰氯、烷基胺和二氟溴乙酸乙酯试剂购自阿拉丁试剂公司或百灵威试剂公司,其它试剂除标明外均为分析纯。 实验中所需的原料 N-丙烯酰基- N-烷基苯甲酰胺衍生物参照相关文献[6,14,15,16]报道方法合成得到。 AV ANCE 400或500 MHz型超导傅里叶数字化核磁共振仪(瑞士Bruker公司);GC-MS-QP2010型质谱仪(日本岛津公司)。
以产物3a合成为例,在封管中依次加入1.8 mg(0.003 mmol,1.0 mol%) fac-Ir(ppy)3,127.2 mg(0.6 mmol)的K3PO4,73.5 mg(0.3 mmol)原料 N-丁基- N-甲基丙烯酰基苯甲酰胺(1a),120 mg(0.6 mmol)二氟溴乙酸乙酯,1.5 mL二氧六环作溶剂,然后在N2气保护下,5 W LED蓝光灯照射常温下搅拌24 h。 经TLC检测反应完全后,柱层析分离,石油醚-乙酸乙酯(体积比7:1)洗脱,得到最终目标产物3a,为一种微黄色油状液体。
产物3a:微黄色油状物。1H NMR(500 MHz,CDCl3), δ:8.28(dd, J=7.9,1.1 Hz,1H),7.63(td, J=7.8,1.4 Hz,1H),7.50~7.44(m,1H),7.42(d, J=7.9 Hz,1H),4.05~3.88(m,4H),3.31(ddd, J=17.1,15.2,11.9 Hz,1H),2.91(dt, J=18.9,14.8 Hz,1H),1.67~1.58(m,5H),1.46~1.36(m,2H),1.21(t, J=7.2 Hz,3H),0.97(t, J=7.4 Hz,3H);13C NMR(126 MHz,CDCl3), δ:174.6,163.5,163.3(t, J=20.2 Hz,—CF2—CO2—),140.7,133.3,129.2,127.8,126.0,124.7,114.5(t, J=222.2 Hz,—CF2—),63.0,44.6(t, J=20.2 Hz,—CH2—CF2—),43.6,40.6,31.7,29.6,20.2,13.8,13.6;19F NMR(471 MHz,CDCl3), δ: -99.4(d, JF-F=266.2 Hz ,1F),-104.3(d, JF-F=266.1 Hz,1F);HRMS m/z(ESI)计算值C19H24F2NO4 [M+H]+:368.1668,实测值:368.1670。
产物3b:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.22(d, J=7.8 Hz,1H),7.57(t, J=7.6 Hz,1H),7.42(t, J=7.6 Hz,1H),7.35(d, J=7.8 Hz,1H),5.19(dt, J=13.9,6.9 Hz,1H),4.04~3.83(m,2H),3.31~3.19(m,1H),2.84(dt, J=19.1,14.8 Hz,1H),1.61(s,3H),1.50~1.44(m,6H),1.17(t, J=7.1 Hz,3H);13C NMR(101 MHz,CDCl3), δ:174.8,163.8,163.3(t, J=30.3 Hz,—CF2—CO2—),140.6,133.2,129.1,127.8,125.8,125.3,114.5(t, J=252.5 Hz,—CF2—),63.0,45.7,44.7(t, J=30.3 Hz,—CH2—CF2—),43.8,31.6,29.7,19.4,13.6;19F NMR(376 MHz,CDCl3), δ: -99.3(d, JF-F=267.7 Hz,1F),-104.3(d, JF-F=266.6 Hz,1F);HRMS m/z(ESI) 计算值C18H22F2NO4 [M+H]+:354.1512,实测值:354.1509。
产物3d:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.12(d, J=8.1 Hz,1H),7.23(d, J=9.9 Hz,1H),7.15(s,1H),4.02~3.82(m,4H),3.32~3.19(m,1H),2.86(dt, J=19.4,14.6 Hz,1H),2.42(s,3H),1.61~1.53(m,5H),1.36(dd, J=15.2,7.6 Hz,2H),1.17(t, J=7.2 Hz,3H),0.93(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:174.7,163.6,163.4(t, J=60.6 Hz,—CF2—CO2—),144.2,140.7,129.2,128.9,126.4,122.2,114.5(t, J=353.5 Hz,—CF2—),62.9,44.6(t, J=30.3 Hz,—CH2—CF2—),43.5,40.5,31.7,29.6,21.8,20.2,13.8,13.7;19F NMR(376 MHz,CDCl3), δ:-99.2(d, JF-F=266.5 Hz,1F),-104.5(d, JF-F=266.6 Hz,1F);HRMS m/z(ESI) 计算值C20H26F2NO4 [M+H]+:382.1825,实测值:382.1822。
产物3e:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.21(d, J=2.2 Hz,1H),7.55(dd, J=8.4,2.3 Hz,1H),7.33(d, J=8.5 Hz,1H),4.10~3.92(m,4H),3.27(ddd, J=18.7,15.2,11.3 Hz,1H),2.82(dd, J=32.3,16.2 Hz,1H),1.60(s,3H),1.58~1.53(m,2H),1.36(dq, J=14.8,7.4 Hz,2H),1.21(t, J=7.2 Hz,3H),0.93(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:174.1,163.2(t, J=30.3 Hz,—CF2—CO2—),162.4,139.1,134.2,133.5,128.8,127.7,126.2,114.4(t, J=252.5 Hz,—CF2—),63.2,44.5(t, J=20.2 Hz,—CH2—CF2—),43.4,40.8,31.6,30.9,29.5,20.2,13.7;19F NMR(376 MHz,CDCl3), δ:-100.8(d, JF-F=266.6 Hz,1F),-103.6(d, JF-F=266.6 Hz,1F);HRMS m/z(ESI) 计算值C19H23ClF2NO4 [M+H]+:402.1279,实测值:402.1281。
产物3f:微黄色油状物。1H NMR(500 MHz,CDCl3), δ:8.31(dd, J=8.8,5.9 Hz,1H),7.17(ddd, J=8.7,8.0,2.4 Hz,1H),7.10(dd, J=9.4,2.4 Hz,1H),4.17~3.93(m,4H),3.34(ddd, J=18.8,15.2,11.3 Hz,1H),2.83(dd, J=31.9,16.5 Hz,1H),1.68~1.56(m,5H),1.46~1.35(m,2H),1.27(t, J=7.2 Hz,3H),0.97(t, J=7.4 Hz,3H);13C NMR(126 MHz,CDCl3), δ:174.1,165.9(d, J=255.4 Hz,F—Ar),163.1(t, J=32.1 Hz,—CF2—CO2Et),162.6,143.8,132.3,121.1,115.8(d, J=250.0 Hz,—CF2—),112.8(d, J=23.2 Hz),63.2,44.5(t, J=20.7 Hz,—CH2—CF2—),43.8,40.6,31.7,29.5,20.2,13.8,13.7;19F NMR(376 MHz,CDCl3), δ:-100.3(d, JF-F=266.9 Hz,1F),-103.5(s,1F),-103.6(d, JF-F=266.9 Hz,1F);HRMS m/z(ESI)计算值C19H23F3NO4 [M+H]+:386.1574,实测值:386.1576。
产物3g:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.38(d, J=8.2 Hz,1H),7.69(d, J=8.3 Hz,1H),7.63(s,1H),4.07~3.95(m,4H),3.34(ddd, J=19.2,15.3,11.2 Hz,1H),2.87(q, J=16.3 Hz,1H),1.65(s,3H),1.58(dd, J=15.4,7.9 Hz,2H),1.42~1.32(m,2H),1.21(t, J=7.2 Hz,3H),0.93(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:173.9,163.0(t, J=30.3 Hz,—CF2—CO2Et),162.4,141.6,134.8(q, J=30.3 Hz,CF3—Ar),130.1,127.6,124.6,124.5(q, J=272.8 Hz,—CF3) 123.1,114.3~111.7(m),63.2,44.4(t, J=20.2 Hz,—CH2—CF2—),43.7,40.8,31.6,30.9,29.5,20.2,13.7;19F NMR(376 MHz,CDCl3), δ:-63.2(s,3F),-100.4(d, JF-F=266.3 Hz,1F),-103.1(d, JF-F=266.5 Hz,1F);HRMS m/z(ESI)计算值C20H23F5NO4 [M+H]+:436.1542,实测值:436.1539。
产物3h:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.21(d, J=2.2 Hz,1H),7.55(dd, J=8.5,2.3 Hz,1H),7.33(d, J=8.5 Hz,1H),4.16~3.78(m,4H),3.27(ddd, J=18.8,15.2,11.3 Hz,1H),2.82(dd, J=32.3,16.1 Hz,1H),1.60(s,3H),1.58~1.53(m,2H),1.36(dd, J=15.1,7.5 Hz,2H),1.20(t, J=7.1 Hz,3H),0.93(t, J=7.3 Hz,3H);13C NMR(101 MHz,CDCl3), δ:174.1,163.3(t, J=10.1 Hz,—CF2—CO2Et),162.4,139.1,134.2,133.5,128.8,127.7,126.2,114.5(t, J=272.7 Hz,—CF2—),63.2,44.5(t, J=20.2 Hz,—CH2—CF2—),40.8,31.6,30.9,29.7,29.5,20.2,13.7,13.7;19F NMR(376 MHz,CDCl3), δ:-100.3(d, JF-F=266.9 Hz,1F),-103.6(d, JF-F=266.9 Hz,1F);HRMS m/z(ESI)计算值C19H23ClF2NO4 [M+H]+:402.1279,实测值:402.1276。
产物3i:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:8.23(d, J=8.8 Hz,1H),7.00(dd, J=8.8,2.4 Hz,1H),6.84(d, J=2.1 Hz,1H),5.22(hept, J=6.9 Hz,1H),3.91(s,3H),3.49~3.31(m,1H),2.76~2.60(m,1H),1.66(s,3H),1.48(dd, J=6.9,2.0 Hz,6H);13C NMR(101 MHz,CDCl3), δ:174.5,163.7,142.8,131.7,119.5~109.8(m,—CF2CF2CF3),117.7,113.5,111.0,110.9,55.6,45.5,43.7,40.3(t, J=20.2 Hz,—CH2—CF2),32.0,19.3,19.3;19F NMR(471 MHz,CDCl3), δ:-80.3(t, J=12.2 Hz,3F),-108.5(d, JF-F=342.8 Hz,1F),-113.6(d, JF-F=342.4 Hz,1F),-127.2~-129.1(m,2F);HRMS m/z(ESI)计算值C18H19F7NO3 [M+H]+:430.1248,实测值:430.1246。
产物3j:微黄色油状物。1H NMR(400 MHz,CDCl3), δ:7.48(t, J=7.7 Hz,1H),7.28(t, J=6.6 Hz,2H),5.19(hept, J=6.9 Hz,1H),3.49~3.31(m,1H),2.83~2.62(m,4H),1.67(s,3H),1.49(dd, J=6.9,1.2 Hz,6H);13C NMR(101 MHz,CDCl3), δ:174.0,164.4,142.8,141.8,132.2,132.0,123.9,123.2,119.2-109.8(m,—CF2CF2CF2CF3),45.7,43.6,40.5(t, J=20.2 Hz,—CH2—CF2—),32.2,24.1,19.4,19.3;19F NMR(471 MHz,CDCl3), δ:-80.3(t, J=12.2Hz,3F),-108.6(d, JF-F=341.9 Hz,1F),-113.5(d, JF-F=341.9 Hz,1F),-126.6~-129.0(m,2F);HRMS m/z(ESI)计算值C18H19F7NO2 [M+H]+:414.1299,实测值:414.1297。
产物4a:微黄色油状物。1H NMR(500 MHz,CDCl3), δ:7.07(d, J=7.5 Hz,1H),6.85(d, J=7.5 Hz,1H),6.70(s,1H),4.10~3.87(m,2H),3.71(ddt, J=61.0,14.5,7.4 Hz,2H),2.90~2.67(m,2H),2.40(s,3H),1.73~1.60(m,2H),1.48~1.33(m,5H),1.20(t, J=7.1 Hz,3H),0.99(t, J=7.3 Hz,3H);13C NMR(126 MHz,CDCl3), δ:179.0,163.6(t, J=32.3 Hz,—CF2—CO2—),143.0,138.5,128.0,123.7,122.4,116.7,114.7(t, J=252.6 Hz,—CF2—),109.5,62.8,44.1(d, J=22.7 Hz,—CH2—CF2—),39.9,29.3,25.8,21.8,20.1,13.8,13.6;19F NMR(376 MHz,CDCl3), δ:-100.8(d, JF-F=266.5 Hz,1F),-103.6(d, JF-F=266.6 Hz,1F);HRMS m/z(ESI)计算值C19H26F2NO3 [M+H]+:354.1876,实测值:354.1877。
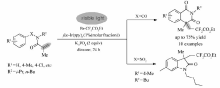
最佳反应条件筛选以 N-丁基- N-甲基丙烯酰基苯甲酰胺(1a)与二氟溴乙酸乙酯(2a)的环化反应为模板反应,探索最佳反应条件(表1)。 使用1%(摩尔分数) fac-Ir(ppy)3作为光催化剂,DMF( N, N-二甲基甲酰胺)作为溶剂,K2CO3作为碱,并使用N2气保护,在5 W蓝色LED灯照射下反应生成3a,且产率达到39%(entry 1)。 为了提高产率,尝试了几种典型的光催化剂[17],如Ru(bpy)3Cl2、Ru(bpy)3Cl2·6H2O和Eosin Y。 令人失望的是,它们的催化效果明显不如 fac-Ir(ppy)3(entries 2~4)。 根据文献[14]报道,在此类光催化反应中,碱的使用对反应影响较大。 所以接着我们考察了几种常见的无机碱,实验结果表明K3PO4的效果最佳,顺利提高产率至57%(entry 5)。 而其它几种无机碱的使用,如CsCO3、K2CO3、NaOAc,反应一般得到更低的产率(entries 6~8)。 接下来的溶剂筛选发现二氧六环作为溶剂反应效果更好(75%;entries 9~12)。 最后,两个控制实验显示不使用光催化剂 fac-Ir(ppy)或者暗反应条件下反应均不能进行(entries 13和14)。
综上所述,最佳反应条件为:化合物1a(0.3 mmol),BrCF2CO2Et(2倍化学计量), fac-Ir(ppy)3(1%摩尔分数),K3PO4(2倍化学计量),二氧六环为溶剂,N2气保护,5 W LED蓝光灯照射下反应24 h。
表1 优化反应条件 Table 1 Screening of optimal reaction conditions a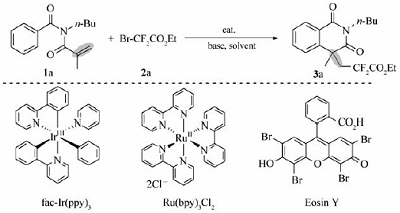 |
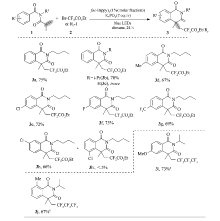
得到最佳反应条件后,考察了反应底物的适用范围(Scheme 2)。 底物丙烯酰基苯甲酰胺的 N-原子上取代基团对此环化反应有明显的影响,例如,N原子上 n-Bu及 i-Pr与优化反应条件是相容的,反应后分别以72%和70%的产率得到目标产物3a和3b,但N原子未保护的丙烯酰基苯甲酰胺(R2=H)反应后几乎不能得到目标产物,主要生成一些无法辨识的副产物。 考察了底物苯环上各种取代基对反应条件的兼容性,结果表明,这些取代基团无论推电子或者拉电子基团(4-Me,4-Cl,4-F,4-CF3)均对该反应条件表现较好的兼容性,以中等以上的产率得到相应的目标产物。 间位氯取代的底物也能顺利参加反应,以优秀的区域选择性主要得到氯取代基对位环化的产物3h,而另一种异构体3h'产率少于5%。 特别值得一提的是,对此优化条件进行改变,将溶剂变换为DMF还可以在异喹啉二酮骨架中引入全氟烷基基团。 例如,分别以C4F9I和C3F7I作为氟源,在改变后的优化条件下,烯烃1i和1j能成功进行相似的串联自由基插入反应/C-H环化,最后生成全氟烷基化的产物3i和3j。
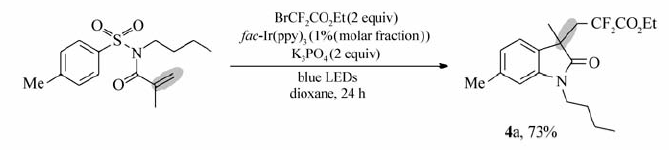
本文研究了 N-正丁基- N-甲基丙烯酰基苯磺酰胺对上述反应最佳条件的兼容性。 与文献[14,15]报道的情况相似,反应经过串联自由基插入烯烃/脱磺酰反应,最终以73%的产率得到相应的吲哚酮4a(Eq.1)。
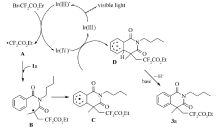
基于上述实验结果和相关的文献报道[6,7,8,9,10],提出以下可能的反应机理过程,如Scheme 3所示:光催化剂 fac-Ir(ppy)3在LED蓝光灯照射下转化为其激发态
本文发展了一种可见光诱导的活泼烯烃与二氟溴乙酸乙酯自由基环化合成含氟异喹啉二酮的反应。 在可见光诱导下,多种 N-烷基 -N-甲基丙烯酰基苯甲酰胺与二氟溴乙酸乙酯发生自由基串联环化反应,以67%~75%的产率合成了一系列的潜在生理活性的氟取代异喹啉二酮。 此工作为潜在药用价值的氟取代异喹啉二酮提供了一条高效、条件温和、绿色的新途径。此方法底物适应范围广,反应操作简单、原料易得,为合成含氟异喹啉二酮,提供了一条高效、简单的新途径。
辅助材料(Supporting Information)[部分原料合成和1H NMR表征]。这些材料可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|