以4-羟基苯甲酸乙酯为原料,经烃化、水解、缩合、脱保护、磺酰化反应,合成了6个含有磺酰基取代的4-苯氧基- N-(4-哌啶基)苯甲酰胺衍生物。 其结构经1H NMR、13C NMR和MS谱等技术手段进行了表征,并以索拉非尼为阳性对照药对HepG2细胞株进行了初步体外抗肝癌细胞增殖活性的评价。 实验发现,4-苯氧基- N-(1-甲磺酰基哌啶-4-基)苯甲酰胺的体外抗肝癌生物活性优于索拉非尼,IC50值为8.42 μmol/L。 研究结果表明,新结构4-苯氧基- N-(4-哌啶基)苯甲酰胺类化合物具有良好的抗肝癌活性。
Six benzamide derivatives were synthesized from 4-hydroxybenzoic acid via alkylation, hydrolysis and condensation reactions. The structure was confirmed by1H NMR,13C NMR and MS. The antitumor activity of all the newly synthesized compounds was evaluated on the in vitro growth of HepG2 cell line using sorafeinb as positive control. The anti-hepatoma biological activity in vitro of N-(1-(methylsulfonyl)piperidin-4-yl)-4-phenoxybenzamide is better than that of sorafeinb with an IC50 value of 8.42 μmol/L. The results show that the derivatives of N-(piperidin-4-yl)-4-phenoxybenzamide have good anti-hepatoma activity.
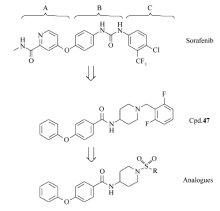
肝细胞癌(Hepatocellular carcinoma,HCC)是全球最常见的癌症之一,每年全球肝癌新发率有超过70万[1]。 在我国,肝癌是危害居民生命健康的前三位最主要恶性肿瘤之一[2]。 由于缺乏能将效果、选择性和毒性达到良好平衡的抗肝癌药物,所以目前对于肝癌的药物研究仍然有很大的进步空间[3]。 索拉非尼(Sorafenib)于2005年和2007年分别被美国FDA批准用于治疗晚期肾癌和中期肝癌药物[4,5]。 本课题组通过对索拉非尼的结构改造进行了一系列探索研究,发现了化合物47等多个具有抗肿瘤活性的新化合物[6,7]。
近年来有大量的磺酰胺类抗肿瘤药物的研究发表,Lobb等[8]将已有的抑制血管生成的磺酰胺类药物LY32262和LY33169结构进行改造,获得了抗肿瘤活性更强的新化合物,Bouchain等[9]参照高效组蛋白去乙酰酶(histone deacetylase,HDAC)抑制剂—天然产物曲古抑菌素A(trichostatin A,TSA)及其类似物Zolinza(suberoylanilide hydroxamic acid,SAHA)等的结构,设计合成了对HDAC具有抑制作用的强苯磺酰胺类化合物。 此外,刘菲等[10]设计合成的一系列磺酰脒化合物也具有良好的抗人肺癌、肝癌、结肠癌的作用。 以此为基础,我们发现磺酰基是具有特殊生物潜力并且脂水分配系数理想的取代基,因此本文以前期实验较活性最好的化合物47为先导化合物,引入磺酰基团取代原有的2,6-二氟苄基,再经优化ABC药效基团设计出了磺酰基上的烷基以及苯环取代,合成了6个结构新颖的磺酰基取代的4-苯氧基- N-(4-哌啶基)苯甲酰胺衍生物。 其先导化合物及设计的目标化合物结构如图1所示。 所合成的化合物采用四甲基偶氮唑蓝法(MTT)、体外增殖及细胞克隆形成等实验,初步评价了其对HepG2肝癌细胞的体外抗肿瘤活性。
AVⅡ型600 MHz核磁共振谱仪(TMS为内标,瑞士Bruker公司);AB3200Q型TRAP-MS质谱仪(美国AB公司);Q-Excative型质谱仪(美国Thermo Fisher公司);Victor3 V型多功能酶标仪(美国Perkin-Elmer公司);WRS-1B型数字熔点仪(上海申光仪器仪表有限公司)。 细胞株HepG2为人源肝细胞癌细胞系(中国科学院典型培养物保藏委员会细胞库),实验室自行传代培养。 硅胶薄层色谱柱所用溶剂均为市售化学纯试剂,其它试剂均为市售分析纯。
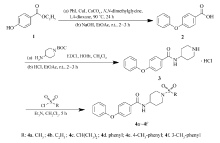
目标化合物按照Scheme 1依次进行合成。 首先将对羟基苯甲酸乙酯(化合物1)与碘苯溶解于1,4-二氧六环中,在碘化亚铜、碳酸铯和 N, N-二甲基甘氨酸的催化下经乌尔曼偶联反应再经由强碱氢氧化钠水解酯得到中间体2[11]。 中间体2与4-氨基-1-叔丁氧羰基哌啶溶解于二氯甲烷,在冰浴下依次加入催化剂1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(EDCI)和1-羟基苯并三唑(HOBt)5 min后,恢复室温搅拌过夜完成酰胺缩合反应。 将所得产物溶于乙酸乙酯用盐酸脱去BOC保护基,得到中间体3。 中间体3溶于二氯甲烷后缓慢加入相应的磺酰氯试剂及适量三乙胺,室温搅拌2~3 h获得目标化合物4a~4f。
1.3.1 4-苯氧基苯甲酸(2)的合成 将1.00 mL(8.9 mmol)碘苯、2.23 g(13.4 mmol)对羟基苯甲酸乙酯、170 mg(0.9 mmol)CuI、276 mg(2.7 mmol) N, N-二甲基甘氨酸和5.81 g(17.8 mmol)Cs2CO3溶解在25 mL 1,4-二氧六环中,Ar气保护下90 ℃加热搅拌24 h。 反应完毕,减压蒸除溶剂,加水、乙酸乙酯萃取3次,有机层用饱和盐水洗涤,无水硫酸钠干燥。 除去溶剂,硅胶柱层析( V(乙酸乙酯): V(正己烷)=1:30)分离得黄色液体1.64 g。 将黄色液体用8 mL乙醇和8 mL水溶解,加入2.76 g(6.9 mmol)氢氧化钠,加热回流3 h。 反应完毕,冷却,减压蒸除溶剂,加50 mL水,2 mol/L HCl酸化,二氯甲烷萃取,有机层用饱和盐水洗涤,无水硫酸镁干燥,减压抽滤。 除去溶剂,得到淡黄色固体1.34 g,收率69.7%,mp 164.1~165.4 ℃(文献[11]值:159 ℃)。1H NMR(CDCl3,600 MHz), δ:12.18(br s,1H),8.08(dd, J=9.0,2.2 Hz,2H),7.41(td, J=7.5,2.0 Hz,2H),7.21(t, J=7.4 Hz,1H),7.09(d, J=7.7 Hz,2H),7.01(dd, J=9.0,2.0 Hz,2H);ESI-MS,C13H10O3,实测值(计算值), m/z:215.1(215.1)[M+H]+。
1.3.2 4-苯氧基- N-(哌啶-4-基)苯甲酰胺盐酸盐(3)的合成 将1.00 g(4.6 mmol)4-苯氧基苯甲酸(2)和4-氨基-1-叔丁氧羰基哌啶1.10 g(5.5 mmol)溶解于8 mL二氯甲烷中,在冰浴下,依次加入1.00 g(5.1 mmol)1-乙基-( 3-二甲基氨基丙基)碳化二亚胺盐酸盐(EDCI)、688.50 mg(5.1 mmol)1-羟基苯并三唑(HOBt),冰浴搅拌10 min后恢复至室温搅拌过夜。 反应后,加入50 mL水,用30 mL二氯甲烷萃取2~3次,二氯甲烷层再分别用1 mol/L HCl水溶液、饱和NaHCO3水溶液、纯水和饱和食盐水洗涤1次,无水硫酸钠干燥,减压抽滤。 减压除去溶剂,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:3)分离得白色固体1.64 g。 将白色固体溶于乙酸乙酯,加入1.5 mL浓盐酸,室温搅拌2~3 h脱Boc保护基,减压除去溶剂。 通过硅胶层析柱( V(甲醇): V(二氯甲烷)=1:6)分离得到白色固体1.20 g,收率78.0%,mp 243.3~244.6 ℃。1H NMR(DMSO-d6,600 MHz), δ:8.82(br s,1H),8.45(d, J=7.3 Hz,1H),7.91(d, J=8.8 Hz,2H),7.44(td, J=7.5,2.0 Hz,2H),7.21(t, J=7.3 Hz,1H),7.08(d, J=8.7 Hz,2H),7.04(d, J=8.8 Hz,2H),4.05(m,1H),3.28~3.32(m,2H),3.00(td, J=12.3,2.5 Hz,2H),1.96(d, J=10.8 Hz,2H),1.78(qd, J=12.0,3.5 Hz,2H);ESI-MS,C18H20N2O2,实测值(计算值), m/z:297.2(297.2)[M+H]+。
1.3.3 N-[1-(甲基磺酰基)-4-哌啶基]-4-苯氧基苯甲酰胺(4a)的合成 将0.10 g(0.34 mmol)4-苯氧基- N-(4-哌啶基)苯甲酰胺盐酸盐(3)混悬于于4 mL二氯甲烷中,加入40 μL(0.51mmol)甲磺酰氯,再缓慢滴加141 μL(1.02 mmol)三乙胺,室温搅拌3 h。 反应结束后减压除去溶剂,加20 mL水,用20 mL乙酸乙酯萃取2次,乙酸乙酯层依次用纯水和饱和食盐水萃取1次,无水硫酸钠干燥,抽滤除去溶剂。 用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体108 mg,收率85.3%,mp 249.8~250.6 ℃。1H NMR(DMSO-d6,600 MHz), δ:8.29(d, J=7.7 Hz,1H),7.88(dt, J=7.0,1.8 Hz,2H),7.44(td, J=7.9,2.2 Hz,2H),7.21(t, J=7.4 Hz,1H),7.08(d, J=8.6 Hz,2H),7.04(d, J=8.6 Hz,2H),3.91(m,1H),3.57(d, J=12.1 Hz,2H),2.88(s,3H),2.85(td, J=12.1,2.2 Hz,2H),1.91(dd, J=13.2,3.3 Hz,2H),1.61(qd, J=12.3,3.2 Hz,2H);13C NMR(DMSO-d6,151 MHz), δ:165.5,159.8,156.2,130.7,130.0,129.8,124.7,119.8,117.9,46.4,45.2,34.7,31.3;HRMS,C19H22N2O4S,实测值(计算值), m/z:397.1197(397.1198)[M+Na]+。
1.3.4 N-[1-(乙基磺酰基)-4-哌啶基]-4-苯氧基苯甲酰胺(4b)的合成 将48 μL(0.51 mmol)乙基磺酰氯为反应原料,其它试剂用量和反应条件以及后处理方法与化合物4a相同,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体114 mg,收率86.8%,mp 215.0~216.0 ℃。1H NMR(DMSO-d6,600 MHz), δ:8.28(d, J=7.7 Hz,1H),7.88(dt, J=9.0,2.0 Hz,2H),7.44(td, J=7.7,1.0 Hz,2H),7.21(tt, J=7.7,1.0 Hz,1H),7.08(d, J=7.7 Hz,2H),7.04(d, J=8.6 Hz,2H),3.94(m,1H),3.62(d, J=12.5 Hz,2H),3.06(q, J=7.3 Hz,2H),2.95(td, J=12.2,2.3 Hz,2H),1.88(dd, J=12.7,3.1 Hz,2H),1.57(qd, J=11.7,3.5 Hz,2H),1.23(t, J=7.3 Hz,3H);13C NMR(DMSO-d6,151 MHz), δ:165.4,159.8 ,156.2,130.7,130.0,129.8,124.7,119.8,117.9,46.4,45.0,43.3,40.5,31.7,8.1;ESI-MS,C20H24N2O4S,实测值(计算值), m/z:411.1(411.1)[M+Na]+。
1.3.5 N-[1-(异丙基磺酰基)-4-哌啶基]-4-苯氧基苯甲酰胺(4c)的合成 将57 μL(0.51 mmol)异丙基磺酰氯为反应原料,其它试剂用量和反应条件以及后处理方法与化合物4a相同,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体93 mg,收率68.0%,mp 182.5~183.8 ℃。1H NMR(CDCl3,600 MHz), δ:7.74(dt, J=8.8,1.8 Hz,2H),7.37(td, J=7.7,1.0 Hz,2H),7.17(t, J=7.4 Hz,1H),7.04(d, J=7.7 Hz,2H),7.00(dt, J=8.8,2.0 Hz,2H),6.09(d,J =7.9 Hz,1H),4.15(m,1H),3.89(d, J=13.0 Hz,2H),3.19(q, J=6.8 Hz,1H),3.04(td, J=13.2,2.0 Hz,2H),2.09(dd, J=12.5,2.6 Hz,2H),1.60(qd, J=11.9,4.0 Hz,2H),1.35(d, J=6.8 Hz,6H);13C NMR(CDCl3,151 MHz), δ: 166.2,160.6,156.0,130.0,128.9,128.7,124.3,119.7,117.8,53.5,46.8,45.7,32.7,16.8;ESI-MS,C21H26N2O4S,实测值(计算值), m/z:425.1(425.1)[M+Na]+。
1.3.6 N-[1-(苯磺酰基)-4-哌啶基]-4-苯氧基苯甲酰胺(4d)的合成 将67 μL(0.51 mmol)苯磺酰氯为反应原料,其它试剂用量和反应条件以及后处理方法与化合物4a相同,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体140 mg,收率94.4%,mp 205.9~207.1 ℃。1H NMR(CDCl3,600 MHz), δ:7.77(d, J=7.3 Hz,2H),7.71(dt, J=8.6,2.8 Hz,2H),7.63(t, J=7.4 Hz,1H),7.56(t, J=7.6 Hz,2H),7.36(td, J=7.9,2.0 Hz,2H),7.16(t, J=7.3 Hz,1H),7.02(dd, J=8.5,0.8 Hz,2H),6.97(dt, J=8.6,1.8 Hz,2H),6.10(d, J= 8.1 Hz,1H),3.91(m,1H),3.84(d, J=12.1 Hz,2H),2.44(td, J=12.0,2.2 Hz,2H),2.09(dd, J=12.5,2.8 Hz,2H),1.66(qd, J=12.3,4.2 Hz,2H);13C NMR(CDCl3,151 MHz), δ:166.2,160.5,155.9,135.9,133.0,130.0,129.2,128.9,128.6,127.6,124.3,119.7,117.8,46.4,45.6,31.6;ESI-MS,C24H24N2O4S,实测值(计算值), m/z:458.9(459.1)[M+Na]+。
1.3.7 N-[1-(对甲苯磺酰基)-4-哌啶基]-4-苯氧基苯甲酰胺(4e)的合成 将74 μL(0.51 mmol)对甲苯磺酰氯为反应原料,其它试剂用量和反应条件以及后处理方法与化合物4a相同,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体139 mg,收率90.8%,mp 205.5~206.9 ℃。1H NMR(CDCl3,600 MHz), δ:7.71(dt, J=8.8,2.0 Hz,2H),7.65(d, J=8.3 Hz,2H),7.36(t, J=7.9 Hz,2H),7.34(d, J=7.3 Hz,2H),7.16(t, J=7.4 Hz,1H),7.02(d, J=8.3 Hz,2H),6.97(dt, J=8.8,1.8 Hz,2H),6.09(d, J= 7.9 Hz,1H),3.91(m,1H),3.82(d, J=12.1 Hz,2H),2.45(s,3H),2.42(td, J=12.0,2.2 Hz,2H),2.08(dd, J=12.5,2.2 Hz,2H),1.66(qd, J=12.2,4.2 Hz,2H);13C NMR(CDCl3,151 MHz), δ:166.2,160.5,156.0,143.8,132.8,130.0,129.8,128.8,128.6,127.7,124.3,119.7,117.8,46.4,45.6,31.6,21.6;ESI-MS,C25H26N2O4S,实测值(计算值), m/z:473.1(473.1)[M+Na]+。
1.3.8 N-(1-(间甲苯磺酰基)4-哌啶基)4-苯氧基苯甲酰胺(4f)的合成 将74 μL(0.51 mmol)间甲基苯磺酰氯为反应原料,其它试剂用量和反应条件以及后处理方法与化合物4a相同,用硅胶层析柱( V(乙酸乙酯): V(正己烷)=1:1)分离产物,得到白色固体128 mg,产率83.8%,mp 198.6~199.5 ℃。1H NMR(CDCl3,600 MHz), δ:7.72(dt, J=8.8,1.8 Hz,2H),7.55~7.58(m,2H),7.42~7.45(m,2H),7.36(tt, J=8.1,2.2 Hz,2H),7.16(t, J=7.4 Hz,1H),7.02(dd, J=8.5,1.0 Hz,2H),6.97(dt, J=8.8,2.0 Hz,2H),6.15(d, J=7.9 Hz,1H),3.92(m,1H),3.83(d, J=12.1 Hz,2H),2.45(s,3H),2.43(td, J=11.9,2.6 Hz,2H),2.09(dd, J=12.5,2.4 Hz,2H),1.68(qd, J=12.1,4.2 Hz,2H);13C NMR(CDCl3,151 MHz), δ:166.2,160.5,156.0,139.4,135.6,133.8,130.0,129.0,128.9,128.6,127.9,124.8,124.2,119.7,117.8,46.4,45.6,31.6,21.4;ESI-MS,C25H26N2O4S,实测值(计算值), m/z:473.0(473.1)[M+Na]+。
1.4.1 四甲基偶氮唑蓝法(MTT assay) 将处于对数生长期的HepG2细胞接种于96孔板(5000个/孔),培养24 h后给药,药物浓度梯度设置为0.1、1、10及20 μmmol/L,给药48 h后进行MTT活性检测。
1.4.2 细胞增殖实验 将处于对数生长期的HepG2细胞接种于12孔板(0.5×105个/孔),培养24 h后给药,药物浓度梯度设置为5、10及20 μmmol/L,分别于给药1、2、3 d后进行细胞计数。
1.4.3 细胞克隆形成实验 将处于对数生长期的HepG2细胞接种于6孔板(1000个/孔),培养24h后给药,药物浓度梯度设置为5、10及20 μmmol/L,连续给药7 d(1次/day)后,用1%的结晶紫溶液染色,拍照并计数细胞克隆数。
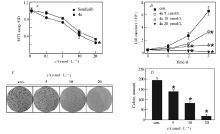
基于我们已报道的二芳醚类化合物抗肿瘤活性的研究结果[6,7],本文设计并合成出了6个含有磺酰基取代的4-苯氧基- N-(4-哌啶基)苯甲酰胺衍生物4a~4f。 采用四甲基偶氮唑蓝(MTT法)测试化合物对HepG2细胞株的体外抑制作用[12]。 将接种于96孔板的HepG2细胞分为实验组、阳性药物对照组、空白对照组,目标化合物及阳性药物浓度梯度处理细胞48 h后,利用四甲基偶氮唑蓝(MTT法)检测HepG2细胞存活率,并以此计算IC50值。 实验重复3次,取平均值,阳性对照药物为索拉非尼(表1)。 在此基础上应用MTT法进一步比较了不同浓度梯度的化合物4a与阳性对照药物索拉菲尼对HepG2细胞存活率的抑制作用,采用细胞计数及克隆形成实验检测了化合物4a对HepG2细胞增殖及克隆形成能力的抑制作用(图2)。
表1 化合物4a~4f对HepG2细胞株的IC50 Table 1 IC50 values of compounds 4a~4f on HepG2 cell line in vitro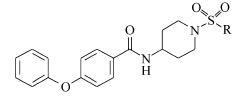 |
结果表明,相较于阳性对照物索拉非尼的抑制率(IC50=9.61 μmol/L)而言,化合物4a、4b、4f均表现较好的抗肝癌活性,其中化合物4a的IC50=8.42 μmol/L尤为突出,且化合物4a可显著降低HepG2细胞的存活率,与阳性对照物索拉菲尼组相比抑制效果更为明显,具有统计学差异。 细胞增殖及克隆形成实验结果表明,化合物4a可显著抑制HepG2细胞的体外增殖及克隆形成的能力,由此说明结构优化是有意义的。 将化合物4a、4b、4c进行对比,可以发现随着磺酰基上连接的烷基数量的增加,其抑制活性出现下降趋势,初步推测有可能是因为烷基的增多导致电子云密度和空间位阻的增大反而降低了其抗肿瘤活性。 化合物4a、4c和4d对比,可以发现甲基取代效果较苯环取代效果好,但是随着烷基取代的碳数增加,活性降低明显反而低于苯环取代的结构。 另外,化合物4d、4e、4f进行对比,则发现连接磺酰的苯环有取代比无取代效果要好,且苯环上甲基的间位取代略优于对位取代,由于化合物数量有限,因此其它取代基对抗肿瘤活性的影响有待于进一步研究。
化合物4a具有良好的抗肿瘤活性,其对人肝癌细胞株HepG2的IC50值为8.42 μmol/L,且能显著抑制肝癌细胞株的恶性增殖及克隆形成能力。 由实验结果可见,以化合物4a为代表的含有磺酰基团的 N-(4-哌啶基)苯甲酰胺类化合物具有较好的抗肝癌潜力,有必要深入挖掘设计新的结构并对这些化合物在抗肿瘤活性和机制方面进行深入研究,目前应用分子生物学克隆形成及体外细胞增殖实验等手段来评价其抗肿瘤活性,并进一步明确抗肿瘤作用可能存在的靶点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|