基于核黄素与2,4,6-三硝基苯酚混合后产生荧光猝灭现象,建立了核黄素作为荧光探针测定2,4,6-三硝基苯酚的新方法。 在0.2 mol/L磷酸盐(NaH2PO4-Na2HPO4)缓冲溶液(pH=6.2)中,响应时间为1 min时,检测2,4,6-三硝基苯酚的线性范围为2.5~1000 μmol/L,相关系数为0.9938,检测限为0.55 μmol/L。 当加入5.00和20.00 μmol/L 2,4,6-三硝基苯酚到水样后,回收率在98.2%~103.5%之间。 方法简便,选择性好,线性范围宽,可用于实际水样中2,4,6-三硝基苯酚的定性定量分析。
A novel method for the determination of 2,4,6-trinitrophenol has been developed based on fluorescent quenching of riboflavin by 2,4,6-trinitrophenol(TNP) in aqueous solutions. The proposed fluorescent quenching method for TNP detection at pH=6.2 using 0.2 mol/L phosphate(NaH2PO4-Na2HPO4) as buffer solution responses within 1 min and with a broad linear relationship from 2.5 to 1000 μmol/L( r=0.9938). The limit of detection for TNP is 0.55 μmol/L. When 5.00 and 20.00 μmol/L TNP is added to different water samples, the recovery ranges from 98.2% to 103.5%. Furthermore, this method is simple, selective, and with wide linear range. Therefore, it can be applied in the determination of 2,4,6-trinitrophenol in real samples.
近年来,随着工业的发展,环境污染问题越来越引起人们的关注,有关硝基酚类有机污染物的高灵敏度和高选择性检测,吸引了科研工作者们极大的研究兴趣[1,2,3]。 2,4,6-三硝基苯酚(又称苦味酸,TNP),是一类重要的硝基酚类有机化合物,在染料、医药、皮革等行业中被大量使用,它也广泛用于烟花、炸药和火箭燃料等的制造[4]。 TNP的广泛使用已使其成为一类重要的环境污染物,对人类造成极大的危害。 人体吸入TNP会影响中枢神经系统,引发呼吸道、胃肠道刺激,导致头晕、头痛、食欲减退、恶心呕吐、腹泻和发热等症状[2,5]。 有时可引发末梢神经炎,心血管、肾脏、泌尿系统和肝脏损害疾病,影响新陈代谢等[6,7]。 因此,发展一种操作简便、响应快速、灵敏高的检测TNP的方法有着重要的现实意义。
目前,已报道的检测TNP的方法有电化学法[8,9]、比色法[10]、荧光法[11,12]、拉曼法[13]和质谱法[14]等。 这些方法均是基于合成出来的纳米材料,作为探针试剂检测TNP,具有操作方法复杂,检测周期长和成本高等缺陷。 本文基于商品化试剂核黄素(Riboflavin)稳定的荧光性能,通过荧光猝灭原理实现TNP的定性定量检测。 核黄素,又称维生素B2,在440~500 nm波长光照射下发生黄绿色荧光,当加入TNP后,体系的荧光被猝灭,基于这种荧光猝灭的信号用来检测TNP。 本方法操作简单,线性范围宽,灵敏度高,能有效实现水样中TNP的快速检测。
F-2700型荧光分光光度计(日本日立公司)用于表征荧光光谱;用PHS-3C型酸度计(上海雷磁仪器公司)调节测量和校正溶液pH;WFH-204B型手提式紫外灯(上海精科实业有限公司);FA2104S型电子分析天平(上海光学仪器厂)。
Na2CO3、NaNO3、K2CO3、Na3PO4、Na2SO4、Hg(NO3)2、AgNO3、CaCl2、CdCl2、CuSO4、FeCl3、BaCl2、CrCl3、NaH2PO4、Na2HPO4和核黄素均购买于国药集团化学试剂有限公司;苯酚(phenol)、三硝基甲苯(TNT)、二硝基甲苯(DNT)、三硝基苯酚(TNP)、硝基苯(NB)购买于阿拉丁试剂有限公司;0.2 mol/L磷酸盐(NaH2PO4-Na2HPO4)缓冲溶液用于调节体系的pH值,所用试剂均为分析纯,实验用水均为去离子水。
于5 mL 塑料离心管中依次加入0.2 mol/L磷酸盐缓冲溶液(pH=6.2)2 mL、2×10-6 g/L核黄素溶液1 mL和不同浓度的TNP、适当体积的水补充总体积至4 mL,均匀混合后在室温(约25 ℃)下进行荧光检测,荧光发射波长为525 nm,激发波长为440 nm,电压400 V。 实验中每个样品都平行测定3次,计算出误差棒(error bar)和相对标准偏差(RSD)。
实验考察了TNP对核黄素的荧光光谱的影响。 如图1所示,在440 nm的激发波长下,核黄素在525 nm处有最大荧光发射,强度为4848.52。 当TNP加入后,核黄素在525 nm处的荧光被明显猝灭,并且随着TNP浓度的增加,核黄素在525 nm处的荧光被猝灭的程度越来越大。 直到加入1000 μmol/L TNP时,荧光强度猝灭到最低值432.03基于TNP加入前后核黄素体系荧光强度的变化,将核黄素作为荧光探针实现对TNP的检测。
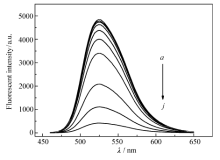 | 图1 TNP加入后核黄素荧光的变化Fig.1 Fluorescence spectra of riboflavin in the presence of TNP c(Riboflavin)=5.0×10-7 g/L; c(TNP)/(μmol·L-1): a~j.0, 2.5, 5, 10, 25, 50, 100, 250, 500, 1000 |
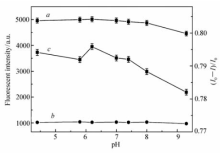
首先考察了体系pH值对检测TNP的影响。 以525 nm处的荧光强度值作为比较的依据。 如图2所示, I0(曲线 a)代表空白体系的荧光强度值; I(曲线 b)代表加入目标物TNP后混合体系的荧光强度值, I0 /I(曲线 c)为TNP对体系荧光的猝灭效率。 在考察的不同pH值范围内,空白体系的荧光强度和加入TNP后混合体系的荧光强度波动不大,说明此方法检测TNP受pH值影响较小。 对荧光猝灭效率 I0/ I进行分析,在pH值为6.2时,荧光猝灭效率 I0 /I最大( I0 /I=4.90),因此,我们确定pH=6.2为检测TNP最佳的检测缓冲条件。
此外考察了TNP检测体系的反应动力学行为,如图3所示,考察了不同时间条件下体系的荧光强度变化情况。 核黄素空白实验荧光强度变化很小,几乎可以忽略,说明核黄素在此实验条件下荧光比较稳定,基本不受时间影响。 当加入TNP后,混合体系的荧光急剧降低,随着时间的变化,荧光强度变化不大,猝灭这说明此方法检测TNP响应快速。 考虑到检测TNP的快速性和稳定性,我们确定最佳检测TNP的时间为1 min。
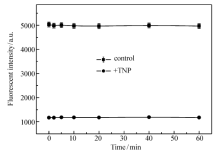 | 图3 检测TNP的反应动力学图Fig.3 Kinetic behaviors of the TNP detection systemTime/min:0, 2, 5, 10, 20, 40, 60; c(Riboflavin)=5×10-7 g/L; c(TNP)=500 μmol/L |
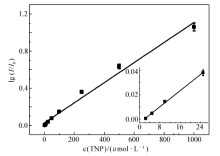
经过条件优化,在最佳实验条件下,基于图1荧光光谱的变化绘制了lg ( I0 /I) -c的线性曲线图,并对525 nm处的荧光强度值进行了线性拟合。 如图4所示,将核黄素空白体系在525 nm处的荧光强度设为 I0,加入TNP后混合体系的荧光强度设为I,二者比值的对数lg ( I0 /I)与TNP的浓度 c在2.5~1000 μmol/L范围内呈现良好的线性关系,线性方程为lg ( I0 /I)=0.022+0.001 c(μmol/L),相关系数为0.9938,检测限(3 σ, n=11)为0.55 μmol/L。
为探讨TNP对核黄素的荧光猝灭机理,进行了荧光寿命的表征。 通过瞬态荧光仪测出来的荧光衰减数据(图5)用双指数拟合得出:核黄素有两个荧光寿命,其中以0.1265 ns为主;加入100 μmol/L TNP后,体系的荧光寿命仍然为两个寿命,其中以0.1463 ns为主。 在误差范围以内,可以认为核黄素荧光体系,在加入TNP前后,荧光寿命变化不大。 因此,我们推测该体系为静态猝灭。
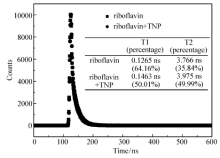 | 图5 TNP的荧光寿命测量Fig.5 The photoluminescence lifetime for TNP detection system using riboflavin c(Riboflavin)=5×10-6 g/L; c(TNP)=100 μmol/L |
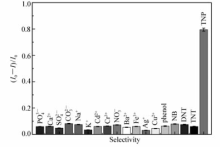
考察了共存无机酸根、金属离子和一些结构相似有机物对体系的影响。 如图6所示,当体系中加入相同浓度的其他物质时,荧光猝灭效率( I0 -I) /I0非常小,说明其它物质加入后基本不改变体系的荧光强度;也只有当加入TNP的样品中时,荧光猝灭效率( I0 -I) /I0明显变大,说明该检测TNP的方法对物质有很好的选择性。 同时,进行了干扰实验,结果列于表1。 可见,浓度放大100倍的Na3PO4、Na2CO3、Na2SO4、NaNO3、NaCl、CaCl2、MgCl2、BaCl2、KCl、FeCl3对TNP的测定实验没有干扰;50倍的CuCl2、CdCl2、AgNO3对实验没有干扰;20倍的硝基苯(NB)、二硝基甲苯(DNT)、三硝基甲苯(TNT)对实验也没有干扰。
| 表1 共存物干扰实验 Table 1 Tolerance of foreign substances |
分别取某印染厂、药厂和医院的水样,经过滤出去杂质后按1.2节试验方法进行测定,采用加标回收法做回收率实验,实验结果列于表2。 从样品分析结果可以看出,当加入5.00和20.00 μmol/L TNP到水样品后,本方法对测定TNP的回收率和RSD分别为98.2%~103.5%和0.6%~1.7%。 故此方法可用于实际水样品中TNP的测定。
| 表2 实际水样品中TNP检测 Table 2 Determination of TNP in different water samples |
基于TNP对核黄素的荧光猝灭作用,建立了核黄素作为荧光探针测定TNP的新方法。 该方法检测TNP的线性范围为2.5~1000 μmol/L,检测限为0.55 μmol/L,响应速度为1 min,线性范围广,灵敏度高,响应迅速,并且操作简单,所需试剂成本低,荧光稳定,对所检测物质具有较好的选择性。 当加入5.00和20.00 μmol/L TNP到水样后,回收率和RSD分别为98.2%~103.5%和0.6%~1.7%。 该方法有望应用于生活和工业污水中TNP的检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|