以酸化蒙脱土/氯化锌作为催化剂,二碳酸二叔丁酯与一系列酚、醇和羧酸类化合物在120 ℃封管条件下反应,合成了叔丁醚和叔丁酯类衍生物,方法简单,经济可靠,环境友好,后处理方便,收率为61%~75%,产物结构经1H NMR,ESI-MS确证。 探讨了溶剂、温度、金属离子等因素对反应收率的影响,并提出了可能的反应机理。 为今后该类化合物的合成提供了一种新的方法。
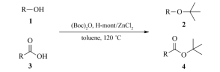
With acid-treated montmorillonite supported zinc chloride(H-mont/ZnCl2) as the catalyst, phenols, alcohols, and carboxylic acid were reacted with di- tert-butyl dicarbonate to give tert-butyl ether and tert-butyl ester derivatives at 120 ℃ in sealed tube with yields ranging from 61% to 75%, which is simple and environmentally friendly. All the compounds synthesized were confirmed by1H NMR and ESI-MS. The effect of solvent, temperature, metal ion and some other factors to the reaction were investigated. A possible mechanism for this reaction was proposed. Provided a new method for this type of synthesis in the future.
叔丁醚和叔丁酯类衍生物是一类重要的化工原料和有机合成中间体,如甲基叔丁基醚是一种高辛烷值汽油添加剂[1];丙烯酸叔丁酯是制造粘合剂和乳化剂的化工原料[2];溴乙酸叔丁酯是合成头孢菌素和受体拮抗剂等药物的有机中间体[3]。 因此,该类化合物的合成一直是有机化学领域的研究热点。 一般而言,叔丁醚类衍生物可以通过传统的Williamson醚合成法合成,该反应用强碱处理醇,形成醇盐,而后与叔丁基卤化物反应[4]。 在大规模工业生产中,醇和酚类化合物在酸性催化剂的作用下与异丁烯反应,制备较为简单的叔丁醚类化合物[5]。 然而,上述叔丁醚类化合物的合成使用了强酸或者强碱条件,而且产生大量废弃物,对环境产生污染。 而叔丁酯类衍生物的合成一般采用传统方法,主要采用缩合剂(如DCC、EDC等)催化羧酸和叔丁醇反应[6];或者酰卤和叔丁醇在碱性条件下反应[7]。 然而,该合成方法使用了大量有毒的卤化物,不利于环境保护。 因此,开发绿色、简便和高效的叔丁醚和叔丁酯的合成新方法具有重要的研究意义。
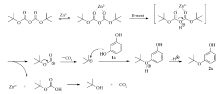
蒙脱土(Montmorillonite)类催化剂作为一种有效的非均相固体酸催化剂在有机合成中越来越受到人们重视[8]。 这类催化剂价廉易得,不污染环境,可重复使用,所催化的反应条件温和、产率和选择性高、后处理简便。 其中,酸化的蒙脱土(H-mont)已经成功用于加成反应[9]、聚合反应[10]、亲核取代反应[11]等。 在前期研究工作中,我们已经实现了H-mont介导的对甲氧基苄基醚和酯的一系列化学反应[12]。 在本文中,以H-mont/ZnCl2作为催化剂,实现了二碳酸二叔丁酯与一系列酚、醇和羧酸类化合物的反应,成功地合成了叔丁醚和叔丁酯类衍生物(见Scheme 1)。
所有试剂为分析纯试剂,其中,蒙脱土K10从Alfa Aesar公司购买。 除注明外,所有反应均在封管条件下进行,溶剂需重蒸后使用。
Bruker ARX-300型核磁共振仪(瑞士布鲁克公司),TMS为内标;Agilent-1100型质谱仪(美国安捷伦科技公司);薄层色谱(TLC)使用的GF254型硅胶,由青岛海洋化工厂生产。
在250 mL圆底烧瓶中,加入蒙脱土K10(9.0 g)和3%HCl(150 mL)水溶液,加热至100 ℃,搅拌24 h。 过滤,滤饼用蒸馏水(500 mL)洗涤,置于烘箱中于120 ℃下活化6 h,放入干燥器中备用。
在10 mL封管反应器中,将酚、醇或羧酸(1.0 mmol)和二碳酸二叔丁酯(2.0 mmol,436 mg)溶于二氯甲烷(3 mL)中,再加入H-mont(100 mg)和ZnCl2(0.1 mmol),(其中100 mg H+-蒙脱土对应大约0.086 mmol的H+[13])加热至120 ℃,反应45 min。 待反应冷却后,打开封管反应器,过滤,滤饼用二氯甲烷洗涤,过滤液真空浓缩,经硅胶层析柱纯化,以不同比例的石油醚/乙酸乙酯为洗脱剂,分离得到叔丁醚类衍生物2a~2d和叔丁酯类衍生物4a~4d。 产物经1H NMR和ESI-MS确证。 产品分析数据如下:
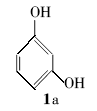
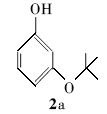
3-(叔丁氧基)苯酚(2a):无色液体。1H NMR(300 MHz,DMSO-d6), δ:7.27(d, J=7.56 Hz,2H),7.09(d, J=7.71 Hz,2H),2.25(s,9H);ESI-MS m/z:167.1{[M+H]+}。
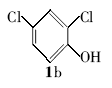
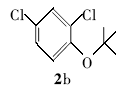
2,4-二氯苯基叔丁醚(2b):无色液体。1H NMR(300 MHz,DMSO-d6), δ:7.67(s,1H),7.29(d, J=8.21 Hz,1H),7.21(d, J=8.01 Hz,1H),1.24(s,9H);ESI-MS m/z:219.2{[M+H]+}。
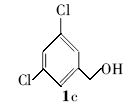
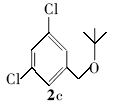
3,5-二氯苄基叔丁醚(2c):微黄色液体。1H NMR(300 MHz,DMSO-d6), δ:7.67(s,1H),7.49(d, J=7.85 Hz,2H),5.08(s,2H),1.33(s,9H);ESI-MS m/z:233.8{[M+H]+}。
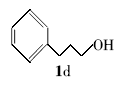
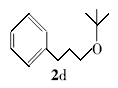
3-苯基丙基叔丁醚(2d):无色液体。1H NMR(300 MHz,DMSO-d6), δ:7.44~7.37(m,2H),7.29~7.23(m,3H),3.59(t, J=7.31 Hz,2H),2.51(t, J=7.41 Hz,2H),1.74~1.66(m,2H),1.14(s,9H);ES-MS m/z:193.8{[M+H]+}。
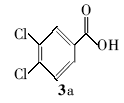
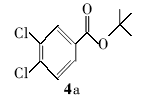
3,4-二氯苯甲酸叔丁酯(4a):淡黄色液体。1H NMR(300 MHz,DMSO-d6), δ:8.01(s,1H),7.86(s,1H),7.78(s,1H),1.55(s,9H);ESI-MS m/z:248.3{[M+H]+}。
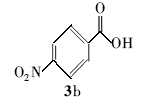
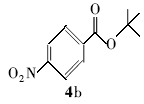
4-硝基苯甲酸叔丁酯(4b):白色固体。1H NMR(300 MHz,CDCl3), δ:8.27(d, J=8.55 Hz,2H),8.15(d, J=8.76 Hz,2H),1.62(s,9H);ESI-MS m/z:224.0{[M+H]+}。
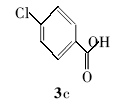
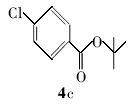
对氯苯甲酸叔丁酯(4c):白色固体。1H NMR(300 MHz,DMSO-d6), δ:7.74(d, J=8.04 Hz,2H),7.28(d, J=8.03 Hz,2H),1.33(s,9H);ESI-MS m/z:213.8{[M+H]+}。
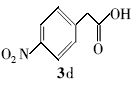
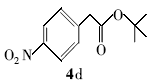
4-硝基苯乙酸叔丁酯(4d):微黄色液体。1H NMR(300 MHz,DMSO-d6), δ:8.20(d, J=8.19 Hz,2H),7.56(d, J=8.28Hz,2H),3.77(s,2H),1.41(s,9H);ESI-MS m/z:238.5{[M+H]+}。
以间苯二酚(1a)和二碳酸二叔丁酯为模型反应,对较佳反应条件进行了筛选(表1),考察了不同溶剂或无溶剂、催化剂、反应时间和反应温度对反应的影响。 从表1可以看出,一般的质子酸如37%HCl、98%H2SO4和三氟乙酸(TFA),在120 ℃的条件下,不能促使反应发生(entries 1~3);而路易斯酸(如FeCl3、AlCl3和ZnCl2)虽然能够催化该反应,但收率只有17%~23%(entries 4~6)。 我们重点考察了非均相的固体酸对该反应的影响,酸性较弱的Mont K10和Mont KSF不能促使反应发生(entries 7~8),但是改良后酸性极强的H-mont实现该反应,收率达到了38%(entry 9)。 并且我们发现, H-mont与ZnCl2之间存在协同作用。由表1(entry 4和9)可知,单用H-mont和ZnCl2,产率并不高,两者合用产率则提高很多。 故二者应一个为酸催化剂,另一个为金属催化剂,合用协同产生作用。
随后,我们考察一些金属无机盐对反应收率的影响(entries 10~13)。 如表1数据所示,在H-mont/二氯甲烷(DCM)/120 ℃反应体系中,加入0.1个化学计量的金属无机盐后,能够有效地促进反应的进行,其中ZnCl2的效果最佳,反应收率达到了75%(entry 13)。 对反应温度和反应时间进行了优化的结果表明,最佳反应温度为120 ℃,最佳反应时间为45 min。
此外,反应溶剂对反应能否发生有重要影响(entries 13~18)。 此反应在非极性溶剂优于其它类型的溶剂,实验证明在非极性溶剂DCM、甲苯和二氯乙烷(DCE)中均有较好的反应收率,而在极性溶剂1,4-二氧六环、 N, N-二甲基甲酰胺(DMF)和二甲基亚砜(DMSO)中,反应不能发生。 通过以上条件筛选实验,较优反应条件是:H-mont/ZnCl2作为催化剂,反应原料(1a和二碳酸二叔丁酯)的物质的量之比为1:2,DCM为溶剂,反应温度为120 ℃,反应时间为45 min。
表1 3-叔丁氧基苯酚的合成条件优化 a Table 1 Optimization of reaction conditions for synthesizing 3-( tert-butoxy)phenol a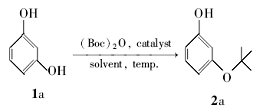 |
利用所得的最优反应条件,对反应底物进行了拓展(见表2),通过改变不同酚或醇(1a~1d)与二碳酸二叔丁酯反应,合成了4种叔丁醚类衍生物2a~2d,反应收率为62%~75%(entries 1~4)。 此外,采用不同羧酸(3a~3d)与二碳酸二叔丁酯在相同的条件下反应,合成了4种叔丁酯类衍生物4a~4d,反应收率为61%~67%(entries 5~8)。
| 表2 叔丁醚和叔丁酯类衍生物的合成 a Table 2 Synthesis of tert-butyl ether and tert-butyl ester derivatives a |
在最优的反应条件下,以间苯二酚和二碳酸二叔丁酯为反应模型,考察了H-mont作为催化剂的重复使用性能。 反应结束后,过滤回收H-mont,3%盐酸洗涤3次,烘干。 如此循环使用2次,且其催化活性没有显著降低,依次为73%和71%。 继续循环使用至第3次后,催化活性有明显下降,仅为50%~60%。 另外,H-mont是一种非均相的固体酸催化剂,其本质上是一种矿石,不溶解于反应溶剂中。 反应结束后,依次通过过滤、洗涤、酸化、烘干,即可回收H-mont,以便再次使用。 基本可以达到100%回收。
以H-mont/ZnCl2催化化合物1a与二碳酸二叔丁酯反应为例说明该反应可能的机理。 二碳酸二叔丁酯具有2个羰基结构,可以与反应体系中的金属离子形成配位键,构建六元环螯合物中间体,有利于二碳酸二叔丁酯分解。 随后,H-mont提供1个质子,打开六元环螯合物,形成不稳定的叔丁氧羧酸和叔丁氧羰基正离子。 叔丁氧羧酸进一步分解成叔丁醇和二氧化碳。 同时,叔丁氧羰基正离子进一步分解,脱去1分子二氧化碳,形成叔丁基正离子。 化合物1a的酚羟基氧原子具有较高的电子云密度,可作为活泼的亲核试剂进攻叔丁基正离子,形成醚键,即生成了叔丁醚2a。 可能的反应过程如Scheme 2所示。
介绍了一种以H-mont/ZnCl2作为催化剂,将一系列酚、醇和羧酸类化合物与二碳酸二叔丁酯反应,合成叔丁醚和叔丁酯类化合物的方法,此方法操作简单、环境友好、后处理方便、催化剂可重复使用。 接着我们通过对不同溶剂、温度和金属离子的对照反应探讨出了可能的反应机理。 我们后续的研究将继续关注该类反应收率的提高以及将其应用于复杂化合物的构建。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|