合成了3种新型结构稳定的烟酰胺腺嘌呤二核苷酸(NAD+)类似物并通过1H NMR、13C NMR、31P NMR和HRMS进行了表征。 NAD+类似物经80 ℃加热24 h后,通过1H NMR确认其结构稳定;通过循环伏安法(CV)测定了其电化学性质,表明其仍然具有良好的氧化还原性能。
Three novel stable nicotinamide adenine dinucleotide(NAD+) analogs were synthesized and characterized by1H NMR,13C NMR,31P NMR and HRMS. The NAD+ analogs show good stability after heating at 80 ℃ for 24 h. Cyclic voltammetry(CV) measurement of the electrochemical properties of NAD+ analogs shows that they remain good redox activities.
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)是NAD+依赖型酶的辅酶,生物体不可缺少的小分子化合物(图1)[1]。 NAD+作为电子载体,在各种氧化还原反应中起着重要的作用。 如在催化制备手性化合物如手性醇[2]、手性胺[3]、羟基酸、氨基酸等具有极大的优势,因此在药物化学、农药等领域具有非常重要的用途,越来越受到人们的重视[4,5,6]。 NAD+分子中烟酰胺单核苷酸(NMN)在氧化还原反应中起到传递电子和氢的作用,吡啶环的C-4位置是NAD+的反应中心,能接受或给出氢负离子。 然而NAD+烟碱环上带有正电荷,与核糖形成糖苷键,C—N键易断裂,稳定性相对较差。 Slama等[7,8]首次将核糖上的氧原子换成碳原子,合成了结构稳定的NAD+类似物(Carba-NAD+)。 Carba-NAD+与NAD+依赖型组蛋白去乙酰化酶Sir2形成晶体结构,模拟NAD+与Sir2结合方式,解析NAD+在组蛋白脱乙酰化过程中的作用机理。 研究还发现采用Carba-NAD+作为乙醇脱氢酶(ADH,来源于酵母)辅酶最大反应速率与NAD+相当[9]。 前期我们合成了一系列保留烟酰胺单核甘酸、改变腺嘌呤环的NAD+类似物[10,11,12,13,14,15],发现部分NAD+类似物能够被野生型乙醇脱氢酶或突变苹果酸酶所识别,并表现出良好的催化活性。 这些类似物烟碱环上仍带有正电荷,稳定性较差。 因此本文拟合成结构相对稳定的NAD+类似物, 同时对合成的NAD+类似物的稳定性及电化学性质进行研究。
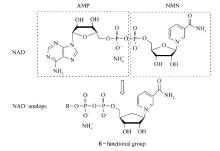 | 图1 吡啶核苷酸辅酶NAD+及其类似物的化学结构Fig.1 Chemical structure of pyridine nucleotide coenzyme NAD+ and NAD+ analogs |
三乙基硼氢化锂四氢呋喃溶液(~1 mol/L,比利时ACROS公司);(1 R,4 S)-2-氮杂二环[2.2.1]庚-5-烯-3-酮(≥98%,美国Sigma公司)、氯化氢甲醇溶液(~3 N,美国Sigma公司);烟碱(≥97%,德国ABCR公司);2,4-二硝基氯苯(98%,阿拉丁试剂有限公司),超干溶剂四氢呋喃购自比利时ACROS公司;所有溶剂均经无水处理;DRX-400型核磁共振波谱仪(德国Bruker公司);LC/Q-TOF-MS型液相色谱-四级杆飞行时间串联质谱仪(英国Manchester公司);CHI 600C型电化学仪、饱和甘汞电极(CHI 150)、Pt电极(CHI 115)、玻碳电极(CHI 104, ϕ=3 mm)均购于上海辰华仪器公司。
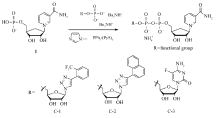
1.2.1 NAD+类似物的合成 目标化合物C-1、C-2、 C-3的合成路线见Scheme 1。 将烟酰胺腺嘌呤单核苷酸核糖环上的氧替换为碳的化合物1参考文献[9,16,17]方法合成,产率为40.3%。
将冻干化合物1(89 mg,0.25 mmol)悬浮于5 mL重蒸二甲基亚砜(DMSO)和1 mL N, N-二甲基甲酰胺(DMF)中,加入甲基咪唑(415 μL,5.2 mmol),2,2'-二硫二吡啶(2,2'-dithiodipyridine,(PyS)2)(286 mg,0.93 mmol)溶于0.8 mL DMF中、PPh3(341 mg,1.3 mmol)溶于0.8 mL DMF中,依次加入到反应体系中,室温搅拌15 min,加入磷酸単酯(0.7 mmol,溶于1.5 mL DMF),室温搅拌9 h。 转移至50 mL离心管中加入30 mL 0.2 mol/L NaI丙酮溶液,有沉淀产生,离心,沉淀加入8 mL水溶解,CH2Cl2(15 mL×3)萃取,浓缩水相,调pH值为2,过二乙氨乙基纤维素DEAE柱,得到目标产物。
C-1的合成:产率为21.5%。1H NMR(D2O,400 MHz), δ:9.23(s,1H),9.01(d, J=6.2 Hz,1H),8.72(d, J=8.2 Hz,1H),8.25(s,1H),8.06(dd, J=6.2,8.2Hz,1H),7.71(d, J=7.8 Hz,1H),7.58~7.54(m,1H),7.50~7.46(m,2H),6.05(d, J=4.8 Hz,1H),4.95(ddd, J=8.7,8.7,8.7 Hz,1H),4.64(dd, J=4.9,4.8 Hz,1H),4.43(dd, J=4.8,4.8 Hz,1H),4.35~4.29(m,2H),4.13~4.04(m,3H),4.02~3.96(m,1H),3.89~3.85(m,1H),2.50(ddd, J=8.7,8.7,13.2 Hz,1H),2.27~2.25(m,1H),2.06~2.01(m,1H);13C NMR(D2O,100.6 MHz), δ:165.2,145.5,144.9,142.7,133.8,132.4,131.9,129.4,128.6,127.6,126.5,126.4,125.1,123.3,92.1,84.2(d, J=8.7 Hz),77.1,75.8,74.9,72.1,70.4,66.6,65.5,42.9(d, J=8.3 Hz),28.6;31P NMR(D2O,162 MHz), δ:-10.5(d, J=19.3 Hz),-10.8(d, J=19.3 Hz);HRMS(ESI)计算值(C26H29F3N5O13P2)- requires m/z 738.1195,实测值 m/z 738.1198。
C-2的合成:产率为38.6%。1H NMR(D2O,400 MHz), δ:8.94(s,1H),8.71(d, J=6.0 Hz,1H),8.50(s,1H),8.34(d, J=8.9 Hz,1H),7.99(m,1H),7.82~7.80(m,2H),7.74~7.70(m,1H),7.57~7.55(m,1H),7.45~7.41(m,3H),6.15(d, J=4.9 Hz,1H),4.74(ddd, J=8.7,8.7,8.7 Hz,1H),4.65(dd, J=4.9,4.9 Hz,1H),4.48(dd, J=4.9,4.9 Hz,1H),4.35~4.33(m,1H),4.19~4.16(m,1H),4.12~4.08(m,2H),3.95~3.90(m,2H),3.80~3.78(m,1H),2.22~2.15(m,2H),1.86~1.80(m,1H);13C NMR(D2O,100.6 MHz), δ:164.5,146.4,144.8,144.2,142.0,133.2,132.9,129.8,129.4,128.5,128.0,127.6,127.2,126.5,126.1,125.6,124.6,122.9,92.2,84.3(d, J=9.2 Hz),76.9,75.4,75.0,71.8,70.6,66.5,65.5,43.0(d, J=7.9Hz),28.1;31P NMR(D2O,162 MHz), δ:-11.2(d, J=20.4 Hz),-10.8(d, J=20.4 Hz);HRMS(ESI)计算值(C29H32N5O13P2)- requires m/z 720.1477,实测值 m/z 720.1459。
C-3的合成:产率为36.0%。1H NMR(D2O,400 MHz), δ:9.26(s,1H),9.04(d, J=6.2 Hz,1H),8.82(d, J=8.1 Hz,1H),8.13(dd, J=6.2,8.1 Hz,1H),7.86(d, J=6.4 Hz,1H),5.71(d, J=3.9 Hz,1H),4.97(ddd, J=9.4,9.4,9.4 Hz,1H),4.38(dd, J=5.6,9.4 Hz,1H),4.16~4.00(m,7H),3.99~3.89(m,1H),2.60(ddd, J=9.4,9.4,13.3 Hz,1H),2.32~2.30(m,1H),2.05~2.02(m,1H);13C NMR(D2O,100.6 MHz), δ:165.4,158.2(d, J=14.9 Hz),155.6,145.5,145.0,142.9,138.6(d, J=243.4 Hz),133.9,128.7,125.7(d, J=32.9 Hz),89.6,82.6(d, J=8.5 Hz),76.8,75.7,74.1,71.9,69.1,66.6,64.7,43.1(d, J=8.0 Hz),28.8;31P NMR(D2O,162 MHz), δ:-10.5(d, J=19.4 Hz),-11.0(d, J=19.4 Hz);19F NMR(D2O,376.5 MHz), δ:-161.7;HRMS(ESI)计算值(C21H27FN5O14P2)- requires m/z 654.1019,实测值 m/z 654.1009。
1.2.2 电化学实验 本实验中循环伏安法实验条件如下:饱和甘汞电极(CHI 150)为参比电极,Pt电极(CHI 115)为辅助(对)电极,玻碳电极(CHI 104, ϕ=3 mm)为工作电极。 为保证实验的准确性和可重复性,电极预处理如下:将电极用蒸馏水洗涤,分别用0.3和0.05 μm氧化铝粉末抛光,超声清洗1 min,蒸馏水清洗,后在0.5 M硫酸中以-1.0~1.0 V扫描,循环40次,在0.2 mol/L KCl中,扫描 1 mmol/L K3Fe(CN)6,峰电位差低于80 mV,完成电极活化。
CHI 600C型电化学工作站参数:扫描速度100 mV/s,扫描范围(方向)-0.6~-1.4 V,循环次数为4次,取样间隔为0.01 V,静止时间为2 s,灵敏度为10-5 A/V。 在N2气保护下,测定温度为298 K,将类似物溶解在5 mL(浓度为0.5 mmol/L)电解液中,反复充N2气除去电解槽内的O2气,扫描方向为-1.4~-0.6 V,得氧化峰曲线,然后再从-0.6~-1.4 V,得到还原曲线,得出化合物在该实验条件下的氧化还原峰电位。
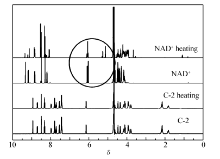
辅酶稳定性是限制NAD+利用的一个重要因素,为了考察合成的NAD+类似物(C-1、C-2、C-3)的稳定性,将NAD+类似物80 ℃加热24 h,测定其氢谱,以NAD+为对照。 NAD+在80 ℃加热24 h与未加热前相比1H NMR中 δ 9.4处比例降低, δ 6.1左右一个峰消失,同时在 δ 5.1和 δ 5.2出现两个新的峰,说明与烟碱环相连的糖苷键断裂被羟基取代,水解后与羟基相连的氢化学位移向高场移动,同时由于水解后存在顺反异构体,所以在 δ 5.1和 δ 5.2出现两个新峰(图2)。 NAD+类似物(C-1、C-2、C-3)在相同的条件下1H NMR没有变化,保持稳定。 这是由于把五元糖环上的氧原子换成了碳原子,糖苷键消失增强了其稳定性。
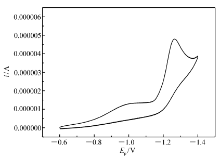
辅酶稳定性是限制NAD+利用的一个重要因素,合成的NAD+类似物(C-1、C-2、C-3)稳定性增强,保留了NAD+分子的催化中心,为了考察其具有氧化还原活性。 通过循环伏安法(Cyclic voltammetry,CV),测定类似物氧化还原电势( Ep),对其氧化还原能力进行评价,能够为催化体系的建立提供理论和实验支持。 因此,有必要研究NAD+类似物的电化学性质。
NAD+类似物C-1的循环伏安曲线如图3所示。NAD+及NAD+类似物C-2和C-3得到相似的循环伏安曲线。在图3中,阴极上还原峰清晰可见,由此说明NAD+类似物仍然具有氧化还原性。而阳极上氧化峰很弱。因此在此实验条件下,NAD+及其类似物的电极反应是不可逆过程。NAD+及其类似物峰电位如表1。NAD+类似物的的还原电位要比NAD+负80 mV,说明还原NAD+类似物要比NAD难;NAD+类似物的还原电位接近,说明改变的腺嘌呤环部分对还原电位没有影响。
| 表1 NAD+及其类似物峰电位( Ep) Table 1 Peak potential of NAD+and NAD+ analogs |
本文成功合成了3种新型的结构比较稳定的NAD+类似物,并通过核磁共振氢谱、碳谱和质谱进行了表征。 80 ℃加热24 h后NAD+类似物结构能够稳定存在,而天然NAD+分子分解,表明3种类似物的比天然的NAD+分子稳定;同时由于保留了氧化还原中心,仍然具有良好的氧化还原活性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|