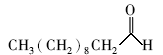选择芦笋( Asparagus Officinalis L)新鲜茎块和两种干燥茎块为代表性植物组织样品,建立了一种直接检测芦笋中多种化学成分的内部萃取电喷雾电离质谱(iEESI-MS)分析方法。在正离子检测模式下,选择甲醇(CH3OH)作萃取溶剂,在无需样品预处理的条件下对芦笋组织样品进行直接质谱分析,获得了组织样品在 m/z 50~1000范围内的化学指纹谱图,并通过目标离子的碰撞诱导解离(CID)实验,鉴定了对药物和自然产品研发具有重要意义的糖类、氨基酸、生物碱以及芦丁等多种代表性的营养成分。 本方法具有无需样品预处理、样品耗量少、操作简便、分析速度快(单个样品的分析时间少于1 min)等优点,为食源性植物组织样品的快速分析提供了一种质谱分析新方法。
Rapid analysis chemical composition of plant samples was achieved using internal extractive electrospray ionization mass spectrometry(iEESI-MS) without any sample pretreatment. In this study, fresh asparagus tubers together with two kinds of dry asparagus tubers were treated as representative samples for the iEESI-MS analysis. Choosing methanol as an iEESI extractant, various chemical composition in asparagus tissue samples was profiled in mass scan range of m/z 50~1000 under the positive ion detection mode, and through collision-induced dissociation(CID) experiments, nutrient and medicinal components including sugars, amino acids, alkaloids, and rutin were identified, which play an significant role in development of pharmaceutical drugs, natural product research and understanding of primary and secondary metabolites. Our experimental results demonstrate that iEESI-MS makes rapid recognition of chemical composition differences in different asparagus. Such information renders the nutritious and medicinal assessment of plant natural products possible. The merits of iEESI-MS include no sample pretreatment, high-throughput(less than 1 min per sample), low sample consumption, simplicity, as well as good specificity, showing potential applications in phytochemicals analysis.
芦笋( Asparagus Officinalis L)学名石刁柏,俗称芦笋、龙须菜,为百合科天门冬属多年生宿根草本植物,是一种营养价值极高、药食两用的优良植物,在世界上大部分地区销量大、受欢迎[1,2]。 一方面,由于芦笋中存在多酚氧化酶和过氧化酶,使得其保鲜时间短、极不耐储藏,采摘24 h后须做相应的处理;另一方面,芦笋作为高档蔬菜,一般只摘取其嫩茎部分食用,导致在鲜销和深加工过程中产生大量的根茎,基本都以废弃物的形式进行了处理,而其里面有些活性成分的含量甚至高于嫩茎。 利用根茎加工制得的干燥茎块(如芦笋茶),感官品质良好、营养成分丰富,长期食用具有消除疲劳、抗衰老、减肥、利尿、清火解热、预防和治疗多种癌症等特殊功效[3]。 这种开发不仅实现了变废为宝,提高了芦笋的经济价值,更改善了人们的饮食健康。
芦笋作为一种化学物质种类十分丰富的植物,其里面的某些提取物如黄酮、寡糖、氨基酸及其衍生物以及甾体皂苷等具有一些特定的生理活性,包括抗真菌、抗诱变、抗发炎和利尿等;芦笋提取物还可以通过改善胰岛细胞的分泌和 β细胞在由链脲霉素引发的2型糖尿病中的功能而起到抗糖尿病的效果;同时它们在保护肝脏免受多种损害的治疗方面也可发挥一定的作用[4,5,6,7];另外,芦笋组织中含有的大量酚类化合物也赋予了它一定的抗氧化性能。 其中,芦笋中特有的芦丁,它既是一种重要的黄酮类物质,又是维生素P的重要组成部分,具有抗心血管系统活性、抗菌或抗病毒活性、抗肿瘤活性、抗炎镇痛活性和抗肝活性等生物学活性[8]。 通常,为了得到这些生物活性成分并对其结构进行表征,传统分析方法在检测之前,通常都需要经过称量、研磨、萃取、超声、分离等繁琐的样品预处理过程。 此过程不仅耗时低效,而且不可避免地会使组织样品中一些含量极低的物质因丢失而检测不到,在一定程度上影响检测结果的准确度和分析方法的灵敏度。
常压质谱分析(ambient ionization mass spectrometry)可以在无需样品预处理的条件下快速获得复杂基体样品中特定组分的气态离子,为植物组织样品的直接快速分析提供了新的途径[9]。 近年来,为满足不同形态复杂基体样品快速分析的要求,国内外开发出几十种新型的不同直接电离技术,根据不同直接离子化技术的进样特点,常见的对样品表面物质进行直接电离的技术,如微波等离子体炬(MPT)[10]、低温等离子体探针(LTP)[11]、实时在线分析(DART)[12]、表面解吸常压化学电离(SDAPCI)[13]、激光消融电喷雾电离(LAESI)[14]、电喷雾解吸电离(DESI)[15]、空气动力辅助电离(AFAI)[[16]等可以直接对植物样品表面的待测物进行分析;电喷雾萃取电离(EESI)[17]、纸喷雾(paper spray)[18]等可以直接分析植物组织的萃取液样品。 但对于固态或块状的组织样品(如本文中的芦笋组织)内部的化学组分,受采样方式及电离效率等的限制,通常需要对固态或块状的组织样品进行破碎、萃取、离心分离等繁杂的样品预处理步骤,无法实现直接质谱分析。 更重要地是,在样品预处理中,样品中的有效物质均暴露在空气中,一些具有生物活性的物质容易发生降解、失活,且目标分析组分易受到污染,对分析结果带来影响。
近期报道的内部萃取电喷雾电离质谱法(iEESI-MS)[19,20]利用萃取剂直接对样品内部组分进行萃取并在样品的表面形成电喷雾,可以对整体样品内部的化学成分进行直接质谱分析。 本文采用iEESI-MS,在无需任何样品预处理的前提下对芦笋新鲜茎块和干燥茎块进行直接质谱分析。 实验发现:iEESI-MS可以快速识别不同芦笋组织中的特异性化学成分;还可以高通量地同时检测并鉴定组织样品中的糖类、氨基酸、生物碱类以及芦丁等多种代表性的营养成分,为食源性植物组织样品的快速分析提供了一种质谱分析新方法。
内部萃取电喷雾电离源(iEESI)为实验室自制;LTQ-XL线性离子阱质谱仪并配有Xcalibur数据处理系统(美国Thermo Scientific公司);石英毛细管(内径0.10 mm,外径0.19 mm,美国Agilent Technologies公司);甲醇(色谱纯,美国ROE公司);实验用水为二次蒸馏水。
质谱仪设置为正离子检测模式,质量扫描范围为 m/z 50~1000,电离电压3.5 kV,离子传输管温度为150 ℃,离子传输管电压为80 V,透镜电压为65 V;在进行串联质谱时,母离子隔离宽度是1.5 Da,设置碰撞能量为10%~30%,碰撞时间为30~50 ms;其它检测参数由LTQ-Tune系统自动优化得到。
新鲜芦笋和两种干燥茎块均由兴国县博苑农业开发有限公司提供,实验前所有样品均冷藏于冰箱。 选取长势相近的新鲜芦笋,用蒸馏水清洗干净、晾干,再无需其他样品预处理;将每根芦笋从底端到顶端,依次平均分为A段、B段、C段和D段共4段,在每段的中心部位各切取一块三角形的皮下和表皮组织直接用于iEESI-MS检测;为便于将毛细管插入外观形状相接近的干燥茎块中,实验前先用二次蒸馏水将干燥茎块稍微浸泡(少于1 min)后再进行质谱检测。
在iEESI-MS中,加有一定电压的萃取溶剂作为能荷转移的载体,通过石英毛细管以一定的流速注入到一块三角形的被分析组织样品内部。 溶剂对组织样品中的多种化学成分进行选择性地萃取,然后在电场作用下萃取剂携带着组织样品内部的化学成分向质谱口移动,并在样品尖端形成载有待测组分的电喷雾,所形成的微小带电液滴中的待测物去溶剂化后,在电场的作用下,进入质谱仪获得检测。 本实验以甲醇(CH3OH)为萃取剂,流速为3~5 μL/min,在每根芦笋相同的部位切取一块三角形的皮下和表皮组织用于实验。 平行插入组织样品内部的毛细管前端距离样品尖端约2 mm,样品尖端距离质谱入口约5 mm。 实验原理示意图,如图1所示。
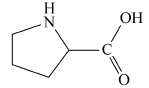
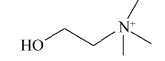
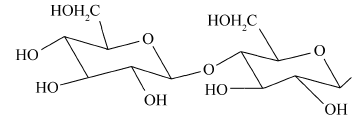
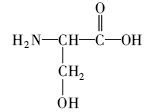
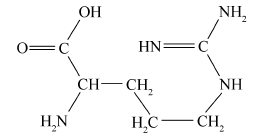
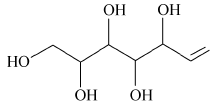
分别对新鲜芦笋不同部位茎块的皮下组织进行iEESI-MS分析,得到化学指纹谱图,如图2所示,图(2 A)、(2B)、(2C)和(2D)依次为从底端到顶端,在A段、B段、C段和D段处皮下组织的化学指纹谱图。 由于在iEESI-MS中萃取溶剂直接萃取一定体积芦笋组织样品且电喷雾产生于组织样品的尖端,组织中含有的大量无机离子(如K+、Na+)均会参与电离反应,得到多种形态的离子化产物,如[M + K]+、[M + Na]+等[20]。 选择/隔离目标离子进行碰撞诱导解离(CID)实验,分析目标离子得到的子离子信息并通过查阅相关文献,证实iEESI-MS可以检测到芦笋组织中丰富的营养成分,包括由葡萄糖/果糖(glucose/fructose,MW:180)或蔗糖(sucrose,MW:342)离子化得到的糖类物质,如 m/z 219 [glucose/fructose + K]+、 m/z 381 [sucrose + K]+、 m/z 399 [sucrose+K+H2O]+、 m/z 561 [glucose/fructose+sucrose+K]+、 m/z 707 [2sucrose+Na]+等[21];同时也检测到皮下组织中的部分氨基酸(如 m/z 175 [arginine+H]+)、生物碱(如m/z 104 [choline]+)及一些挥发性风味成分十一醛(MW:170) m/z 171[undecanal+H]+和十二醛(MW:184) m/z 185[lauraldehyde+H]+[3]等特征离子。
从新鲜芦笋不同部位茎块皮下组织的iEESI-MS谱图可以看出,虽然在同一样品的各个部位均可以检测到基本相同的物质,其中包括由葡萄糖/果糖(glucose/fructose,MW:180)或蔗糖(sucrose,MW:342)得到的糖类成分分子离子,如 m/z 219 [glucose/fructose+K]+、 m/z 381 [sucrose+K]+、 m/z 399 [sucrose+K+H2O]+、 m/z 561 [glucose/fructose+sucrose+K]+等;此外,还有生物碱 m/z 104 [choline]+以及一些挥发性风味成分 m/z 171[undecanal+H]+和 m/z 185[lauraldehyde+H]+。 但是,相比较而言,同一种物质分子离子峰的相对丰度在不同部位存在一定的差异,这可能是由于同一物质在组织样品的不同部位,本身浓度分布就不均一,因而导致它们的含量不同。
图3为新鲜芦笋不同部位茎块表皮组织的iEESI-MS化学指纹谱图,与皮下组织一样,图(3 A)、(3 B)、(3 C)和(3 D)依次为从底端到顶端,在A段、B段、C段和D段处表皮组织的化学指纹谱图。 对比同一部位皮下组织的指纹谱图我们可以发现,iEESI-MS在表皮组织中检测到部分与皮下组织中相同的物质,如糖类成分( m/z 219 [glucose/fructose+K]+、 m/z 381 [sucrose+K]+、 m/z 399 [sucrose+K+H2O]+);部分氨基酸 m/z 175 [arginine+H]+、生物碱 m/z 104 [choline]+以及一些挥发性风味成分 m/z 171[undecanal+H]+和 m/z 185[lauraldehyde+H]+等。 相比皮下组织,表皮组织中检测到的挥发性成分的含量相对较低,但在表皮组织检测到的一些化学成分如 m/z 649、814等,在皮下组织并没有明显的分子离子峰。
对表皮和皮下组织中分子离子峰较低的 m/z 976进行CID分析,得到子离子 m/z 814,它们两者正好相差一个葡萄糖单元(-162Da),由此可以推断 m/z 976的结构中可能含有一个葡萄糖基。 通过查找相关文献分析得出, m/z 649可能为芦丁(rutin,MW:610)的[M+K]+分子离子[5],它既是芦笋组织中含有的一种重要黄酮类物质,又是维生素P的重要组成部分;具有抗心血管系统活性、抗菌或抗病毒活性、抗肿瘤活性、抗炎镇痛活性和抗肝活性等生物学活性。 另外,比较表皮组织与皮下组织的化学指纹谱图数据发现,芦丁在表皮组织中的含量要高于其在皮下组织中的含量。 以上这些数据既进一步突显出芦笋是一种药食兼有的优良植物,同时又表明芦笋同一部位的皮下组织与表皮组织在物质构成上既具有相似性,也具有特异性。
两种干燥茎块的iEESI-MS化学指纹谱图,如图4所示,图4 A、4 B分别为干燥茎块1(以芦笋根茎为原料制备)和干燥茎块2(以芦笋尖为原料制备)的化学指纹谱图。 由于干燥茎块以芦笋新鲜茎块为原料制备并保留了芦笋组织原有的化学成分,因此,它们在质谱图上表现出很多相同的分子离子峰(如质谱峰 m/z 104、171、185、219、381、399、797、821和976)等。 但是,从指纹谱图来看,芦笋新鲜茎块中含有的一些糖类物质如 m/z 219 [glucose/fructose+K]+和 m/z 399 [sucrose+K+H2O]+的含量明显要高于干燥茎块;导致 m/z 399 [sucrose+K+H2O]+含量偏低的原因可能是因为干燥茎块中水分的含量极低,使得 m/z 381 [sucrose+K]+与水分子(H2O)的结合受到了影响。
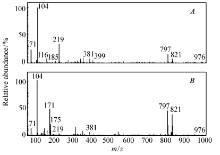 | 图4 两种干燥茎块的iEESI-MS化学指纹谱图Fig.4 iEESI-MS spectra of two types of dry asparagus tubers A.rhizome; B.stem tip |
与芦笋新鲜茎块皮下组织和表皮组织的化学指纹谱图对比发现,两种干燥茎块在 m/z 700~900范围内检测到的部分物质如 m/z 797、821分子离子峰的相对丰度也比皮下组织和表皮组织中的要高。 通过CID实验和查阅有关文献证实,它们分别为磷脂类物质[PC(34:2)+K]+和[PC(36:4)+K]+[22],由此可以推断干燥茎块中部分磷脂类物质的含量也要高于其在芦笋新鲜茎块中的含量。 此外,在干燥茎块中检测到的氨基酸种类要多于芦笋新鲜茎块,除了在干燥茎块2中检测到 m/z 175 [arginine+H]+之外,在干燥茎块1还检测到相对丰度较低的 m/z 116 [proline+H]+。 然而,它们均有一个共同的特征:在所有实验样品中, m/z 104 [choline]+离子的含量普遍都相对较高。 ( m/z 104)胆碱是卵磷脂和鞘磷脂的重要组成部分,广泛存在于动植物体内,具有促进脑发育和提高记忆力、保证信息传递、调控细胞凋亡等多种生理功能。 此外,从指纹谱图还可以发现,在干燥茎块中检测到的挥发性香气成分 m/z 171 [undecanal+H]+和 m/z 185 [lauraldehyde+H]+的含量也要高于芦笋新鲜茎块,这可能也是干燥茎块味道比芦笋新鲜茎块醇香的原因。
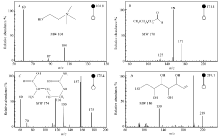
图5为组织样品中离子化的胆碱( A)、十一醛( B)、精氨酸( C)和葡萄糖( D)的MS2(CID)谱图。 m/z 104 [choline]+的特征子离子是 m/z 87和60,分别由母离子丢失(—OH)和(CHOH—CH2)所获得(图5 A); m/z 171 [undecanal + H]+的特征子离子是 m/z 154和127,分别是由母离子丢失(—OH)和(—CH2CH2O—)得到(图5 B); m/z 175 [arginine+H]+的主要特征离子是 m/z 158、157、130、116和60,分别是由母离子丢失NH3(17)、H2O(18)、(—COOH—)(45)和(NH=C(NH2)2)(59)所得(图5 C),这与文献报道相一致[23]; m/z 219 [glucose+K]+的主要特征离子是 m/z 201和130,分别是由母离子失去H2O(18)和(—C3H5O3—)得到的(图5 D)。 对芦笋新鲜茎块及干燥茎块中部分主要物质的MS2(CID)谱结果及其子离子进行总结,结果如表1所示。 从表1可以直接观察到各物质的碎裂规律及其在组织样品中的离子化形式。
| 表1 芦笋组织中部分主要物质的iEESI-MS/MS谱结果及其子离子信息 Table 1 The characteristic product ions of iEESI-MS/MS from asparagus tissue |
与近年报道的主要植物组织直接进样质谱分析方法如SDAPCI-MS[13]、LAESI-MS[14]、Leaf spray-MS[21]技术相比较,iEESI-MS最大的特点是利用萃取剂对样品内部进行三维空间内地萃取,并在样品的外表面形成携带样品组分的电喷雾,进而得到质谱分析。 前期研究表明,iEESI的技术特点使其相比表面电离技术(如DESI、SDAPCI等)得到更丰富的样品组分信号,且有利于直接分析组织样品内部易于分解的活性成分(如大蒜组织中的蒜氨酸)[23,24]。 另外,除了分析新鲜的植物组织样品,iEESI-MS方法也可以较好地适用于干燥植物组织样品的分析。 这是由于在干燥植物组织样品中,一方面其水分的含量极低,降低了萃取溶剂的表面张力,从而提高了带电液滴产生的效率。 因此,本文使用此方法对芦笋干燥茎块也进行了检测,并获得了多种代表性的营养成分的信息。 另外,前期研究报道,iEESI-MS除了应用在食品的质量控制与安全保障中,在临床医学等方面也具有广阔的应用前景[19]。
内部萃取电喷雾电离质谱技术(iEESI-MS),可在无需样品预处理的条件下对植物组织样品进行直接质谱分析。 本方法具有样品耗量少、操作简便、分析速度快(单个样品的分析时间少于1 min)等优点,为食源性植物组织样品的快速分析提供一种质谱分析新方法的同时,也有望应用于植物组织中一些对药物和自然产品研发具有重要价值化合物的检测和结构鉴定,进一步为研究工作者更好地探究这些化合物在植物体内分布及代谢过程奠定了一定的基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|