合成系列假1,2-二苯乙烯型偶氮苯,利用FT-IR、NMR、ESI-MS和元素分析等技术手段确定目标化合物结构,并通过UV-Vis光谱研究其光致变色性能,测定其溶液态光致顺反异构速率常数,同时考察其在聚甲基丙烯酸甲酯掺杂薄膜中抗疲劳性能,结果表明,目标化合物在乙酸乙酯中π-π*能级低于n-π*能级,且两个能级出现重叠,异构转变速率常数数量级10-1~100 s-1,反→顺异构转变速率常数 kt受到偶极-偶极作用力和空间位阻效应影响,偶极-偶极作用力对单溴代物的 kt影响比二溴代物大,空间位阻效应对二溴代物的 kt影响比单溴代物大,顺→反异构转变速率常数 kc与 kt大小顺序相反,在聚甲基丙烯酸甲酯掺杂薄膜中有良好的抗疲劳性能。
A series of novel pseudostilbene azobenzenes was synthesized and their structures were characterized by FT-IR, NMR, MS(ESI) and elemental analysis. The photoisomerization properties and reversible cis/trans isomerization rate constants in solvent were measured via UV-Vis spectroscopy, as well as the fatigue resistance property in polymethyl methacrylate(PMMA) film was performed. The azobenzenes in ethyl acetate have the two bands of π-π* and n-π* inverted on the energy scale and π-π* and n-π* bands are practically superimposed. The isomerization rate constants range from 10-1 to 100 s-1. The trans to cis isomerization rate constants depend on the dipole-dipole interactions and molecular steric hindrance, with the dipole-dipole interactions having larger impact on monobromo-azobenzenes than dibromo-azobenzenes, and a reverse impact from molecular steric hindrances. The faster trans to cis transformation corresponds to the slower cis to trans transformation. The azobenzene has a good fatigue resistance to some extent in PMMA film.
偶氮苯分子具有平面共轭结构的生色团,在光作用下会发生可逆顺反异构反应,从而产生光致变色、光致各向异性和光致相变等效应,偶氮苯独特的性能已引起了广泛关注,如在非线性光学材料[1,2,3]、液晶材料[4,5,6,7,8,9]、自组装材料[10,11,12,13]、生物分子活性光调控[14,15,16]、分子开关[17,18,19]、主客体化学[20,21]和高密度数据存储材料[22]等领域倍受国内外科研工作者的青睐。 近年来,偶氮苯合成与光致变色性能是研究热点之一,但从定量角度系统研究结构与光致变色速率的关系鲜有报道[23,24,25]。 本文合成了系列尚未见报道的假1,2-二苯乙烯型偶氮苯,利用NMR、ESI-MS等手段进行结构表征,并通过UV-Vis光谱测定系列目标化合物在溶液中异构速率常数,探讨假1,2-二苯乙烯型偶氮苯分子结构对异构速率常数的影响,为偶氮苯分子的结构设计提供理论依据。
WRS-2A型微机熔点仪(上海精密科学仪器有限公司);Nicolet 6700型傅里叶变换红外光谱仪(美国赛默飞世尔公司);Varian DRX 400型核磁共振仪(美国瓦里安公司);Perkin Elmer 2400Ⅱ型元素分析仪(美国珀金埃尔默公司);Thermo LCQ DECA XP MAX型质谱仪(美国热电公司);Agilent 8453型紫外-可见分光光度计(美国安捷伦公司);LC8型Hg-Xe弧灯(日本滨松公司);(405±10) nm、(365±10) nm滤光片(深圳激埃特光电有限公司);Alpha Step D-100型台阶仪(美国KLA-Tencor公司);KW-4A型台式匀胶机(中国科学院微电子研究所)。 3-溴苯胺(98%)、2-甲基苯胺(>99%)、2-甲氧基苯胺(>98%)、2,6-二甲基苯胺(99%)、2,6-二甲氧基苯胺(97%)、多聚甲醛(分析纯)购自上海晶纯试剂有限公司;4-氨基硝基苯、苯胺、液溴、亚硝酸钠和二氯亚锡二水合物均为分析纯,购自国药集团化学试剂有限公司。
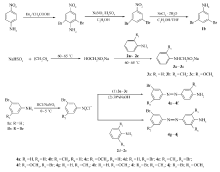
参考文献[26-27]合成方法,以4-氨基硝基苯为起始原料,通过溴代、重氮去氨基、硝基还原合成中间体3,5-二溴苯胺1b。 目标化合物的合成路线如Scheme 1所示。
1.2.1 化合物1a~1b的重氮盐制备 100 mL烧杯中加入20 mmol化合物1a或1b和8 mL 20%盐酸,冰浴条件下往上述悬浊液中缓慢滴加1.5211 g(22 mmol)NaNO2(溶解于5 mL去离子水)的溶液,反应后加入适量尿素消耗过量亚硝酸,再用醋酸钠固体调节pH值至5,澄清液置冰水中备用。
1.2.2 目标化合物4a~4f的制备 50 mL圆底烧瓶中加入10 mL水和2.3503 g(22 mmol)NaHSO3,NaHSO3完全溶解后,加入0.7250 g(24 mmol)多聚甲醛,60 ℃反应35 min后,逐步滴入化合物2a,60 ℃搅拌2 h后停止反应,得苯胺基甲磺酸钠3a,同样的制备方法得到甲基苯胺基甲磺酸钠3b和甲氧基苯胺基甲磺酸钠3c。 冷却至室温后,剧烈搅拌下将化合物3a缓慢滴入到化合物1a的重氮盐中,澄清重氮盐溶液逐渐变暗红粘稠液,控温在0~5 ℃反应6 h后结束反应。 加入50 mL 30%NaOH水溶液,暗红粘稠液变为黄色浑浊液,N2气保护下40~50 ℃搅拌反应7 h,用盐酸调节pH值约为8,固体粗产品经薄层色谱分离,得化合物4a,改变底物,通过相同的方法制备化合物4b~4f。
1.2.3 目标化合物4g~4j的制备 剧烈搅拌下将20 mmol化合物2d缓慢滴加入化合物1a的重氮盐溶液中,溶液颜色由黄-红-棕-褐色变化,有细小颗粒析出,整个反应过程控温0~5 ℃,TLC跟踪反应至原料点消失后停止反应,减压抽滤得固体粗产物,粗产物经薄层层析得固体化合物4g,改变底物,通过同样的方法制备化合物4h~4j。
3'-溴-4-胺基偶氮苯(4a):棕褐色固体, 收率33.1%, mp 133.3~134.5 ℃;C12H10BrN3元素分析实测值(计算值)/%:C 52.39(52.20),H 3.88(3.65),N 14.82(15.22); IR(KBr),σ/cm-1:3421(N—H),3381(N—H),3057(苯环C—H),1599(苯环骨架C=C和N=N),1510(苯环骨架C=C),1430(苯环骨架C=C),1302(C—N),1234(C—N),826(苯环1,4-二取代),783(苯环1,3-二取代),677(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:4.06(s,2H,NH2),6.66~6.70(m,2H,ArH),7.29~7.34(m,1H,ArH),7.44~7.49(m,1H,ArH),7.74~7.78(m,3H,ArH),7.90~7.97(m,1H,ArH);13C NMR(CDCl3,100 MHz), δ:14.6,122.4,123.0,124.1,125.4,130.3,132.3,145.2,150.1,153.9;ESI-MS m/z:316.69[M+H2O+Na+]。
3'-溴-3-甲基-4-胺基偶氮苯(4b):粘稠固体,收率30.5%,C13H12BrN3元素分析实测值(计算值)/%:C 53.55(53.81),H 4.02(4.17),N 14.61(14.48);IR(KBr), σ/cm-1:3438(N—H),3394(N—H),3059(苯环C—H),2926(甲基C—H),1619(N=N),1601(苯环骨架C=C),1576(苯环骨架C=C),1505(苯环骨架C=C),1441(苯环骨架C=C),1305(C—N),1256(C—N),898(苯环1,2,4-三取代),784(苯环1,3-二取代),681(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:2.23(s,3H,CH3),4.05(s,2H,ArH),6.73(d, J=8.0 Hz,2H,ArH),7.34(t, J=12.0 Hz,1H,ArH),7.45(d, J=8.0 Hz,2H,ArH),7.69(d, J=12.0 Hz,2H,ArH),7.74~7.79(m,2H,ArH),7.98(s,1H,ArH);13C NMR(CDCl3,100 MHz), δ:17.3,109.7,114.3,122.0,122.4,123.0,124.1,125.4,130.3,132.2,145.2,148.5,154.0;ESI-MS m/z:290.28[M+H+]。
3'-溴-3-甲氧基-4-胺基偶氮苯(4c):橙黄色固体,收率21.3%,mp 85.8~86.6 ℃;C13H12BrN3O元素分析实测值(计算值)/%:C 50.64(51.00),H 3.70(3.95),N 13.93(13.72);IR(KBr), σ/cm-1:3457(N—H),3324(N—H),3062(苯环C—H),2920(甲氧基C—H),2850(甲氧基C—H),1614(N=N和苯环骨架C=C),1509(苯环骨架C=C),1460(苯环骨架C=C),1421(苯环骨架C=C),1298(C—N),1280(Ar—O—C),1234(C—N),872(苯环1,2,4-三取代),779(苯环1,3-二取代),675(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:3.88(s,3H,OCH3),4.29(s,2H,NH2),6.71(d, J=8.0 Hz,1H,ArH),7.32(d, J=8.0 Hz,1H,ArH),7.41(s,1H,ArH),7.47~7.5(m,2H,ArH),7.78(d, J=8.0 Hz,1H,ArH),7.99(s,1H,ArH);13C NMR(CDCl3,100 MHz), δ:55.6,101.2,113.1,122.3,122.9,123.0,124.1,130.3,132.2,140.9,145.1,147.2,154.0;ESI-MS m/z:306.24[M+H+]。
3',5'-二溴-4-胺基偶氮苯(4d):橙黄色固体,收率32.0%,mp 138.4~139.2 ℃;C12H8Br2N3元素分析实测值(计算值)/%:C 40.29(40.60),H 2.74(2.56),N 11.67(11.84);IR(KBr), σ/cm-1:3427(N—H),3089(苯环C—H),1587(N=N和苯环骨架C=C),1558(苯环骨架C=C),1500(苯环骨架C=C),1467(苯环骨架C=C),1248(C—N),1226(C—N),837(苯环1,4-二取代),744(苯环1,3,5-三取代),682(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:4.17(s,2H,NH2),6.74(d, J=8.0 Hz,2H,ArH),7.67(s,1H,ArH),7.80(d, J=8.0 Hz,2H,ArH),7.92(s,2H,ArH);13C NMR(CDCl3,100 MHz), δ:114.5,123.2,124.3,125.8,134.3,145.0,150.5,154.4;ESI-MS m/z:357.38[M+H+]。
3',5'-二溴-3-甲基-4-胺基偶氮苯(4e):橙黄色固体,收率30.2%,mp 87.5~89.1 ℃;C13H10Br2N3元素分析实测值(计算值)/%:C 42.47(42.31),H 2.69(3.00),N 11.53(11.39);IR(KBr), σ/cm-1:3481(N—H),3381(N—H),3058(苯环C—H),2923(甲基C—H),2852(甲基C—H),1619(N=N),1571(苯环骨架C=C),1499(苯环骨架C=C),1436(苯环骨架C=C),1302(C—N),1232(C—N),826(苯环1,2,4-三取代),789(苯环1,3,5-三取代),680(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:2.20(s,3H,CH3),4.09(s,1H,NH2),6.68~6.70(m,2H,ArH),7.63(t, J=4.0 Hz,1H,ArH),7.66~7.67(m,2H,ArH),7.89(d, J=4.0 Hz,2H,ArH);13C NMR(CDCl3,100 MHz), δ:17.3,114.3,116.5,121.9,123.2,124.3,125.8,134.2,145.0,149.0,154.5;ESI-MS m/z:369.01[M+H+]。
3',5'-二溴-3-甲氧基-4-胺基偶氮苯(4f):橙黄色固体,收率29.3%,mp 111.2~112.4 ℃;C13H10Br2N3O元素分析实测值(计算值)/%:C 40.34(40.55),H 2.53(2.88),N 11.18(10.91);IR(KBr), σ/cm-1:3463(N—H),3364(N—H),3067(苯环C—H),2924(甲氧基C—H),2852(甲氧基C—H),1614(N=N),1556(苯环骨架C=C),1508(苯环骨架C=C),1299(C—N),1275(Ar—O—C),1243(C—N),852(苯环1,2,4-三取代),741(苯环1,3,5-三取代),670(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:3.89(s,1H,OCH3),4.35(s,1H,NH2),6.71~6.74(m,1H,ArH),7.37~7.38(s,1H,ArH),7.50(t, J=12.0 Hz,1H,ArH),7.62~7.63(s,1H,ArH),7.90(s,2H,ArH);13C NMR(CDCl3,100 MHz), δ:56.6,101.0,113.0,116.5,123.2,123.7,124.3,134.1,141.3,144.9,147.2,154.4;ESI-MS m/z:385.25 [M+]。
3'-溴-3,5-二甲基-4-胺基偶氮苯(4g):棕红色固体,收率81.5%,mp 99.2~108.3 ℃;C14H14BrN3元素分析实测值(计算值)/%:C 55.07(55.28),H 4.93(4.64),N 13.64(13.81);IR(KBr), σ/cm-1:3427(N—H),3341(N—H),3060(苯环C—H),2930(甲基C—H),2858(甲基C—H),1632(N=N),1591(苯环骨架C=C),1479(苯环骨架C=C),1304(C—N),1266(C—N),890(苯环1,2,3,5-四取代),782(苯环1,3-二取代),678(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:2.25(s,6H,2CH3),4.04(s,1H,NH2),7.35(t, J=12.0 Hz,1H,ArH),7.50(d, J=8.0 Hz,1H,ArH),7.62(s,2H,ArH),7.78(d, J=4.0 Hz,1H,ArH),7.98(s,1H,ArH);13C NMR(CDCl3,100 MHz), δ:17.6,121.4,122.4,123.0,124.0,124.2,130.3,132.1,144.5,146.9,154.1;ESI-MS m/z:303.94[M+H+]。
3'-溴-3,5-二甲氧基-4-胺基偶氮苯(4h):橙黄色固体,收率78.1%,mp 157.5~158.9 ℃;C14H14BrN3O2元素分析实测值(计算值)/%:C 49.81(50.02),H 4.05(4.20),N 12.82(12.50);IR(KBr), σ/cm-1:3483(N—H),3348(N—H),3077(苯环C—H),2925(甲氧基C—H),2830(甲氧基C—H),1619(N=N),1580(苯环骨架C=C),1512(苯环骨架C=C),1463(苯环骨架C=C),1305(C—N),1255(Ar—O—C),1233(C—N),875(苯环1,2,3,5-四取代),778(苯环1,3-二取代),677(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:3.88(s,3H,OCH3),3.96(s,3H,OCH3),4.45(s,2H,NH2),6.36(s,1H,ArH),7.32(t, J=16 Hz,1H,ArH),7.37(s,1H,ArH),7.46(d, J=8.0 Hz,1H,ArH),7.77(d, J=8.0 Hz,1H,ArH),7.97(s,1H,ArH);13C NMR(CDCl3,100 MHz), δ:55.8,56.8,97.8,98.0,122.2,123.0,124.1,130.2,131.6,133.3,141.8,142.9,154.5,155.0;ESI-MS m/z:335.70[M+H+]。
3',5'-二溴-3,5-二甲基-4-胺基偶氮苯(4i):橙黄色固体,收率80.0%,mp 157.2~158.9 ℃;C14H12Br2N3元素分析实测值(计算值)/%:C 44.13(43.89),H 3.24(3.42),N 10.66(10.97);IR(KBr), σ/cm-1:3449(N—H),3343(N—H),3083(苯环C—H),2914(甲基C—H),2840(甲基C—H),1620(N=N),1598(苯环骨架C=C),1573(苯环骨架C=C),1480(苯环骨架C=C),1449(苯环骨架C=C),1299(C—N),1287(C—N), 854(苯环1,2,3,5-四取代),743(苯环1,3,5-三取代),669(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:2.25(s,6H,2CH3),4.10(s,2H,NH2),7.60(s,2H,ArH),7.64(s,1H,ArH),7.91(s,2H,ArH);13C NMR(CDCl3,100 MHz), δ:17.6,104.5,116.5,121.3,123.2,124.3,124.5,134.1,144.3,147.4,154.6;ESI-MS m/z:383.03[M+H+]。
3',5'-二溴-3,5-二甲氧基-4-胺基偶氮苯(4j):橙黄色固体,收率72.8%,mp 195.4~196.6 ℃,C14H12Br2N3O2元素分析实测值(计算值)/%:C 40.14(40.51),H 3.35(3.16),N 9.86(10.12);IR(KBr), σ/cm-1:3471(N—H),3350(N—H),3067(苯环C—H),2926(甲氧基C—H),2830(甲氧基C—H),1625(N=N),1552(苯环骨架C=C),1514(苯环骨架C=C),1457(苯环骨架C=C),1305(C—N),1287(Ar—O—C),1251(C—N),843(苯环1,2,3,5-四取代),740(苯环1,3,5-三取代),666(C—Br);1H NMR(CDCl3-TMS,400 MHz), δ:3.88(s,3H,OCH3),3.97(s,3H,OCH3),4.52(s,2H,NH2),6.34(s,1H,ArH),7.35(s,1H,ArH),7.60(s,1H,ArH),7.90(s,2H,ArH);13C NMR(CDCl3,100 MHz), δ:55.8,56.7,97.4,97.8,123.1,124.2,133.2,133.6,141.8,143.6,155.1,155.5;ESI-MS m/z:415.32[M+H+]。
1.0011 g聚甲基丙烯酸甲酯(PMMA)加入20 mL锥形瓶中,加入10 mL四氢呋喃,放置过夜,次日加入0.0106 g合成的3',5'-二溴-4-胺基偶氮苯并超声振荡1 h,用0.45 μm滤膜过滤。 石英片先用清水冲洗,再用 N, N-二甲基甲酰胺浸泡,最后用去离子水反复冲洗后干燥。 利用匀胶机将偶氮苯化合物、PMMA和四氢呋喃混合溶液旋涂在预先清洗干净的石英基底上成膜,24 h室温避光挥发干溶剂,得到表面光洁的薄膜,利用台阶仪测得薄膜厚度为1.7656 μm。
取适量6.0×10-5 mol/L偶氮苯乙酸乙酯溶液于10 mm×10 mm带磨口塞石英比色皿中,Hg-Xe点光源的白光经(405±10) nm滤光片取得窄谱带的光为激发光源,照射比色皿中的偶氮苯溶液,或者石英片上的偶氮苯/PMMA薄膜,光照后立即测定其紫外-可见吸收光谱,如此交替直至光稳态,再用Hg-Xe点光源的白光经(365±10) nm滤光片取得窄谱带的光为激发光源照射溶液样品,光照后立即测定其紫外-可见吸收光谱,如此交替直至光稳态,薄膜样品通过避光回复,并在不同时刻测定其紫外-可见吸收光谱,直至稳态,整个实验过程完全避开自然光照射。
测定1.4节制备出的偶氮苯化合物/PMMA掺杂薄膜紫外-可见吸收光谱,以Hg-Xe点光源的白光经(405±10) nm滤光片取得窄谱带的光为激发光源,照射薄膜1 min,并立即测定光照后的紫外-可见吸收光谱,避光1 h后测定其回复的紫外-可见吸收光谱,继而循环重复上述操作5次,取每次测得的紫外-可见吸收光谱最大吸收波长处的吸收值对循环次数作图。
2.1.1 偶合反应 文献[28,29]报道氨基偶氮苯衍生物合成绝大多数是重氮盐直接与苯胺偶合,但实验发现,化合物1a或1b的重氮盐和苯胺直接偶合反应时,目标产物产率很低(分离产率低于3%),与2-甲基苯胺和2-甲氧基苯胺直接偶合反应时,根本得不到预期产物,可能因为该重氮盐是一种很弱的亲电试剂,直接偶合通常会得到重氮基团偶合到芳香胺氮原子上的产物,所以合成化合物4a~4f时,先通过类Mannich反应将苯胺或2-甲基苯胺或2-甲氧基苯胺的氨基保护起来,再与重氮盐进行偶合反应,最后水解脱保护基,按照此方法进行的偶合反应效果比直接偶合反应大大提高,水解后得到的偶氮苯产物分离产率可达21.3%~33.1%。 而对于2,6-二甲基苯胺或2,6-二甲氧基苯胺,直接偶合反应便可得到产率较高的预期产物,这是因为一方面氨基两个邻位同时被取代基占据,空间位阻抑制重氮基团偶合到芳香胺氮原子上反应的发生,另一方面,取代基为给电子基,活化了苯环,从而有利苯胺衍生物氨基对位碳原子与重氮盐发生偶合反应。
2.1.2 氨基保护和脱保护 氨基保护对目标化合物产率有很大影响,用37%甲醛水溶液、亚硫酸氢钠与芳香胺类Mannich反应保护氨基,产率一直不高,故用多聚甲醛来替代37%甲醛水溶液,最终产物的产率提高了约4倍,可能是37%甲醛水溶液在60~65 ℃反应时会有部分甲醛挥发,甲醛用量不足导致保护不彻底,进而影响到最终产物的产率。在水解脱保护基反应中,水解温度很关键,当水解温度70 ℃以上时会出现红黑色黏稠状物质包裹着磁力搅拌转子上,水解反应难以进行完全,水解适宜温度控制在40~55 ℃,且根据产物的结构差异,水解温度稍微有变化,重氮结构苯环上吸电子效应较强的化合物,水解的温度适当高些,反之低些。
根据偶氮苯化合物光化学行为差异可分为三类:偶氮苯型、氨基偶氮苯型和假1,2-二苯乙烯型化合物。 第一类偶氮苯型分子的n-π*能级与π-π*能级不发生重叠,且n-π*能级低于π-π*能级,顺式构型在室温下较稳定,松弛回反式构型的速度较慢。 第二类氨基偶氮苯型分子的π-π*能级与n-π*能级往往发生交叠,顺式构型在室温下较不稳定。 第三类假1,2-二苯乙烯型(带有推/拉电子基团)分子的π-π*能级低于n-π*能级,顺式构型在室温下很不稳定,π-π*能级与n-π*能级出现重叠,激发反→顺异构所用的光,往往同时激发顺→反异构,同一激发光能同时加快两者之间的异构速度[23]。
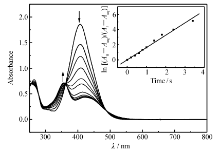
偶氮苯存在顺、反两种异构体,顺式构型两个苯环间斥力较大,不够稳定,而反式构型由于两个苯环距离较远,斥力较小而较稳定,为优势构型。室温下,偶氮苯分子大都以稳定的反式态存在,经一定波长的光照射,偶氮苯化合物能发生构型转变。图1为化合物4d乙酸乙酯稀溶液经(405±10) nm光照射各个时刻紫外-可见吸收光谱图。 光照前 λmax=407 nm强吸收峰为π-π*和n-π*两个能级重叠的吸收峰,(405±10) nm光照射后,π-π*跃迁峰吸光度迅速减小, t=0.6 s时,波长355 nm处出现一个新吸收峰,为n-π*跃迁吸收峰,随后407 nm处吸光度继续减小,355 nm处的峰吸光度稍微增加,累计光照时间大于5.4 s光谱不再变化,即 t=5.4 s时达到光稳态,两个等吸点分别在362、488 nm处。 参考偶氮苯的光化学反应[30],分别测定250~600 nm区间内的紫外-可见吸收曲线及其407 nm的吸光度值,根据一级动力学反应公式ln [( A0 -Aeq)/( At-Aeq)]= ktt,作ln [( A0 -Aeq)/( At-Aeq)]~ t图,直线斜率为化合物4d反→顺光异构速率常数 kt。
偶氮苯化合物顺反异构速率常数的大小取决于分子偶极矩、取代空间效应和溶剂等因素共同作用的结果。 从表1数据可知,偶合组份相同时, kt-一溴代> kt-二溴代,说明偶氮苯苯环上取代基数目愈多,体积愈大, kt愈小。 一溴代物 kt顺序为 kt-4a> kt-4b> kt-4g> kt-4c> kt-4h, kt随取代基为—H、—CH3、—OCH3依次变小,偶合组分苯环上取代基为—CH3或—OCH3时,取代基数目多者较少者 kt大。 二溴代物 kt顺序为 kt-4d> kt-4e> kt-4f> kt-4i> kt-4j,偶合组分环上引入供电子基少者较多者 kt大,取代基数目相同时, kt随取代—H、—CH3、—OCH3依次变小。 此外,如果仅考虑偶氮苯分子的偶极矩因素,理论上 kt顺序为 kt-4a> kt-4b> kt-4g> kt-4c> kt-4h, kt-4d> kt-4e> kt-4i> kt-4f> kt-4j( μ4h> μ4c> μ4g> μ4b> μ4a, μ4j> μ4f> μ4i> μ4e> μ4d),一溴代物 kt实验与理论大小顺序完全一致,二溴代物 kt实验与理论大小顺序并不完全吻合,说明偶氮苯 kt同时受到偶极 -偶极作用力和空间位阻效应影响,偶极 -偶极作用力对一溴代物 kt影响比二溴代物 kt大,空间位阻效应对二溴代物 kt影响比一溴代物 kt大。
| 表1 目标化合物光致异构速率常数 Table 1 Photoisomerization rate constants of the target compounds |
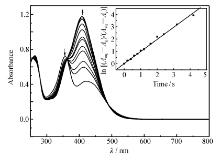
用(365±10) nm的光进行回复,分别测定回复各时刻紫外-可见吸收曲线(图2)。 π-π*跃迁峰吸光度迅速上升并出现蓝移,n-π*跃迁峰吸光度下降并发生红移,当 t=2.0 s时,355 nm处吸收峰与407 nm处吸收峰完全重叠。 对比图1和图2的结果可知,化合物4d在407 nm处的吸光度在经过光致反→顺异构和顺→反光回复之后,吸光值有大约0.6的损失,可能的原因是化合物4d分子π-π*能级与n-π*能级非常相近,出现部分重叠,且π-π*能级小于n-π*能级,在以(365±10) nm的光为激发光源进行顺→反回复时,同时也能激发反→顺异构,在这种条件下难于实现100%光回复。
在(365±10) nm光回复 t时刻,测 λmax=407 nm的吸光度值,代入一级动力学反应公式ln [( Aeq- A0)/( Aeq- At)] =kc t,作ln [( Aeq- A0)/( Aeq- At)] ~t图,直线斜率为化合物4d顺→反光异构速率常数 kc(表1)。 偶合组份相同时, kc-二溴代> kc-一溴代,一溴代物和二溴代物 kc顺序为: kc-4a(H)< kc-4g(2CH3)≈ kc-4b(CH3)< kc-4c(OCH3)< kc-4h(2OCH3), kc-6d(H)< kc-4i(2CH3)< kc-4e(CH3)< kc-4f(OCH3)< kc-4j(2OCH3),两个系列化合物的 kc大小顺序一致,除了化合物4i外,其它化合物的 kc与 kt大小顺序恰好相反,说明了已经由反式构型转变为顺式构型的偶氮苯,取代基数目愈多、体积愈大,分子斥力就愈大,愈容易向反式构型转变。
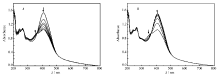
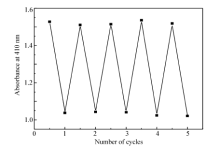
图3 A为3',5'-二溴-4-胺基偶氮苯(4d)/PMMA掺杂薄膜经波长为(405±10) nm的激发光照射 t时刻的各吸收曲线,图3 B为薄膜经(405±10) nm的激发光照射至稳态后,避光回复 t时刻的各吸收曲线。 化合物4d的PMMA掺杂薄膜吸收峰的峰形和吸光度变化趋势与溶液态基本一致,薄膜中最大吸收峰为410 nm,比乙酸乙酯溶液中的最大吸收峰红移了3 nm。 在薄膜中反→顺异构转化比溶液中慢一些。 撤销激发光源,避光条件下顺→反异构就可以较快地发生,1 h后回复到原来的99%,与溶液态光回复相比,化合物4d在受限的固体环境中暗回复的回复程度更大些。 以上现象说明了化合物4d的分子在受限的PMMA掺杂薄膜中也能顺利进行顺反异构转化。循环测定反→顺异构和顺→反异构两个过程5次,回复率均达到98%以上(图4),体现了化合物4d具有良好的抗疲劳性能,有望用于蓝光光盘存储介质。
以溴代苯胺为重氮组分,含不同取代基苯胺衍生物为偶合组分,通过简便的重氮偶合反应合成系列假1,2-二苯乙烯型偶氮苯衍生物,合成路线简单,反应条件温和,系列偶氮苯最大吸收波长在405 nm左右,且光致变色性能显著(异构速率常数数量级为10-1~100 s-1),与405 nm蓝光激光器匹配,且在PMMA掺杂薄膜中抗疲劳性能良好,因此,可望用作蓝光光盘存储介质。 其次,通过系列偶氮苯结构与异构转化速率关系得出,异构转化速率取决于化合物分子偶极-偶极作用力和空间位阻效应共同作用的结果,这将为偶氮苯分子结构设计提供一定的实验依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|