设计并合成了基于苯并吡喃腈为母体单元的近红外激活型荧光探针( E)-2-(苯并吡喃腈基)乙烯基-5-(二乙氨基)丙烯酸苯酯(DCM-AC),其结构中的丙烯酰酯键作为氨基酸激活反应的响应基团。 研究结果表明,探针分子DCM-AC对半胱氨酸具有高灵敏、选择性光谱响应,不仅能观察到明显的颜色变化,而且探针在710 nm处的荧光发射强度显著增强,相应的荧光增强比值与半胱氨酸的浓度(1.0~8.0 μmol/L)呈现良好的线性关系。 探针DCM-AC对半胱氨酸的检出限为2.8×10-7 mol/L,能选择性检测半胱氨酸区别于结构类似的高半胱氨酸和谷胱甘肽,且不受其它氨基酸物质干扰。 通过质谱、核磁和紫外吸收光谱研究了DCM-AC检测半胱氨酸的反应激活机理:半胱氨酸先通过巯基与DCM-AC上的丙烯酰酯双键发生亲核加成,然后环化脱除内酰胺环状化合物。
A benzopyran-based turn-on near-infrared probe ( E)-2-(benzopyran)ethenyl-5-(diethylamino)phenyl acrylate(DCM-AC) has been successfully synthesized. Acrylate bond is specifically designed for the response units of amino acid. The results show that the spectral response of DCM-AC towards cysteine is highly sensitivity and selectivity. With increasing the concentration(1.0~8.0 μmol/L) of cysteine, a significant color change can be observed and the fluorescent intensity of DCM-AC at 710 nm increases gradually, showing a good linear relationship with concentration. The limit of detection of DCM-AC for cysteine is determined as 2.8×10-7 mol/L. DCM-AC exhibits a highly selective probe for cysteine over homocysteine and glutathione, with no interference of other substances. The recognition mechanism of the DCM-AC to cysteine is verified by mass spectrum,1H NMR titration and absorption spectra, indicating that cysteine thiol groups attack at acrylate double bond of DCM-AC by addition reaction, and finally removed as the cyclic lactam compound.
生物硫醇,如半胱氨酸、高半胱氨酸、谷胱甘肽,在维持细胞的氧化还原进程中起着重要的作用[1,2],水平异常的生物硫醇会导致各种各样的疾病[3]。 虽然这些生物硫醇具有相似的化学结构,但却表现出截然不同的生物功能特性[4]。 半胱氨酸的缺乏与许多代谢性疾病,如造血功能下降、儿童生长缓慢、脱发等[5]。 血浆中高半胱氨酸浓度的增加会损坏内皮细胞和诱导血管损伤[6],而谷胱甘肽的浓度则与艾滋病、白细胞损失、肝损伤、癌症和神经性疾病等相关[7]。 因此,发展新的检测方法用于鉴别这些重要的生物硫醇具有重要的意义。
近年来,检测硫醇的方法得到了快速的发展。 其中,反应型荧光探针,因具有高专一性、高灵敏度、操作简便的特点而被人们持续关注[8]。 生物硫醇的巯基具有很强的亲核性,所以检测硫醇的反应型探针通常都利用了此性质,例如迈克尔加成反应[9,10,11]、与醛基的环化加成反应[12,13]、磺酰胺或磺酸酯键的裂解反应[14,15]以及二硫键断裂反应[16,17,18]等。 为了提高反应型探针对结构类似的生物硫醇的选择性,利用生物硫醇端位的氨基活性,基于串联反应的分子设计策略日益受到关注[19,20]。 另一方面,近红外荧光探针(发射波长范围650~900 nm)对生物体损害小、穿透能力强、背景荧光干扰小,在生物荧光成像方面独具优势[21,22]。 目前,文献报道的生物硫醇荧光探针主要有BODIPY[23,24]、香豆素[25,26,27]、荧光素[28,29]、罗丹明[30]、菁染料[31,32]等类化合物。 其中,虽然有报道近红外花菁类荧光探针[20]可以特异性地检测半胱氨酸,但是由于菁类染料的光稳定性和化学稳定性较差,它们在实际应用中受到了限制。
作为典型激光染料,苯并吡喃腈的衍生物[33,34,35]光稳定性较好、量子效率高,特别适合应用于生物样本检测[36]。 因此,本文利用苯并吡喃腈作为荧光母体,通过在苯并吡喃腈单元上共价连接强给电子基团4-(二乙氨基)水杨醛,增大共轭体系,使其荧光发射位于近红外区。 又利用生物硫醇的巯基具有强的亲核特性及其端位氨基活性不同,以与4-(二乙氨基)水杨醛连接的丙烯酰氯作为氨基酸激活反应的响应基团,基于串联反应,设计开发了新型近红外生物硫醇探针( E)-2-(苯并吡喃腈基)乙烯基-5-(二乙氨基)丙烯酸苯酯(DCM-AC)(Scheme 1)。 通过质谱、核磁和紫外吸收光谱进一步研究了DCM-AC检测半胱氨酸的反应激活机理。
Bruker Avance 400型核磁共振仪(德国Bruker公司);Waters LCT Premier XE TOF型高分辨质谱仪(美国Waters公司);Agilent Cary 60型紫外-可见分光光度计(美国Agilent公司);棱光F97Pro型荧光分光光度计(上海棱光技术有限公司);LAKECORE-S040D型超纯水器(上海涞科仪器有限公司)。
2-羟基苯乙酮和丙烯酰氯(纯度98%,上海安耐吉化学有限公司);4-(二乙氨基)水杨醛(纯度99%,上海安耐吉化学有限公司);罗丹明6G(纯度99%,上海阿达玛斯试剂有限公司);甲苯(分析纯,上海凌峰化学试剂有限公司),使用前经烘干的分子筛干燥处理;其它试剂均为分析纯,未经进一步纯化;不同pH的PBS缓冲溶液是以浓度为0.2 mol/L的磷酸二氢钠和磷酸氢二钠的母液按照不同比例混合稀释,用pH计实时测量而得。 紫外-可见吸收光谱和荧光发射光谱均采用 V(二甲亚砜): V(PBS)=50:50的缓冲液作为测试体系,在37 ℃下进行测试。
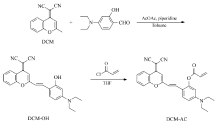
1.2.1 中间体DCM-OH的合成及表征 在100 mL单口烧瓶中,依次加入苯并吡喃腈(1.04 g,5.0 mmol),4-(二乙氨基)水杨醛(1.45 g,7.5 mmol),50 mL无水甲苯,1 mL哌啶,0.5 mL冰醋酸,搅拌,Ar气保护下加热至回流,反应12 h,停止加热,自然冷却至室温(25 ℃),旋转蒸发除去溶剂,湿法上样进行柱层析( V(二氯甲烷): V(甲醇)=50:0~50:1)梯度洗脱分离,得到绿色固体DCM-OH 450 mg,产率23.1%[37]。1H NMR(400 MHz,DMSO-d6), δ: 8.69(d, J=8.3 Hz,1 H,Ph—H),7.96(d, J=15.8 Hz,1H,alkene—H),7.84(t, J=7.5 Hz,1H,Ph—H),7.74(d, J=8.5 Hz,1H,Ph—H),7.53(m,2H,Ph—H),7.00(d, J=15.8 Hz,1H,alkene—H),6.75(s,1H,Ph—H),6.28(dd, J=10.8 Hz,1.8 Hz,alkene—H),6.18(d, J=8.5 Hz,1H,Ph—H),3.37(s,4H,—CH2—),1.13(t, J=6.9 Hz,6H,—CH3);13C NMR(100 MHz,DMSO-d6), δ:160.56,159.20,152.21,152.05,151.17,135.94,134.76,130.14,125.73,124.46,118.80,118.13,117.31,116.78,110.82,110.17,104.80,104.04,96.98,55.81,43.99,12.62;HRMS(ESI-MS)计算值C24H22N3O2 [M+H]+:384.1712,实测值:384.1718。
1.2.2 DCM-AC的合成及表征 在100 mL单口瓶中,加入DCM-OH(77 mg,0.2 mmol)、20 mL无水四氢呋喃,滴加 N, N-二异丙基乙胺0.5 mL(3.0 mmol),冰浴下搅拌。将丙烯酰氯(180 mg,2.0 mmol) 溶于10 mL无水四氢呋喃,用恒压滴液漏斗逐滴滴入上述溶液中,继续在冰浴下搅拌。 待丙烯酰氯滴加完毕后,将反应混合物移至室温(25 ℃)搅拌8 h,反应液由不透明紫红色变为透明大红色。 加水20 mL,除去过量丙烯酰氯,旋转蒸发除去四氢呋喃,加入二氯甲烷进行萃取(20 mL×3),有机相干燥、过滤、浓缩后,以硅胶为固定相,二氯甲烷为洗脱剂进行柱层析分离,得绿色固体53 mg,产率60.6%[20]。1H NMR(400 MHz,DMSO-d6), δ:8.72(d, J= 8.3 Hz,1H),7.89(t, J=7.8 Hz,1H),7.81(d, J=9.0 Hz,1H),7.62~7.57(m,2H),7.52(d, J=15.8 Hz,alkene—H),7.18(d, J=15.8 Hz,alkene—H),6.90(s,1H),6.72(dd, J=9.1,1.0 Hz,alkene—H),6.65~6.60(m,2H,alkene—H),6.52(d, J=2.5 Hz,1H),6.28(dd, J=9.8,1.8 Hz,alkene—H),3.43(q, J=6.9 Hz,4H),1.13(t, J=7.0 Hz,6H);13C NMR(100 MHz,DMSO-d6), δ:164.17,159.00,152.47,151.81,151.28,150.37,135.09,134.05,132.08,128.66,127.41,125.92,124.54,118.64,117.58,117.12,116.23,113.88,113.49,109.97,105.28,104.64,58.11,44.00,12.43;HRMS(ESI-MS)计算值C27H24N3O3 [M+H]+:438.1818;实测值:438.1818。
如Scheme 1所示,化合物DCM-OH是通过苯并吡喃腈与4-(二乙氨基)水杨醛发生Knoevenagel缩合[38]反应得到的。 苯并吡喃腈在哌啶的催化下,甲基成为稳定的碳负离子,首先进攻羰基碳原子发生亲核加成,然后脱水得到热力学稳定的反式烯烃产物DCM-OH。 合成DCM-AC的反应中, N, N-二异丙基乙胺提供碱性环境,DCM-OH成为氧负离子DCM-O-,对丙烯酰氯进行亲核加成,酯化生成最终产物DCM-AC。 DCM-OH和DCM-AC均通过1H NMR、13C NMR以及HRMS证明了化合物结构的正确性。 需指出的是,在低场化学位移处DCM-OH和DCM-AC的乙烯氢耦合常数均为15.8 Hz,表明该类苯并吡喃腈衍生物中的桥连双键为反式结构。
检测环境的pH值是影响DCM-AC和DCM-OH荧光强度的重要因素,因此在测试中考察了pH值对DCM-AC和DCM-OH荧光强度的影响(图1)。 首先从图1 A不同pH值下DCM-OH的紫外吸收光谱中可以看出,当pH值由3.2变为10.7的过程中,DCM-OH的最大吸收峰从560 nm逐渐红移至650 nm处,说明DCM-OH的去质子化程度随pH值的增大而增大。而实验中,不同pH值下,DCM-AC的最大吸收峰则无明显红移现象。图1 B中,当pH值由3.2变为10.7的过程中,DCM-AC在710 nm处的荧光发射始终微弱,而DCM-OH在pH>6.5时,710 nm处的荧光发射强度陡然增加,在pH=8.2时,荧光发射强度达到最大。 在生理pH值范围内(如图1 A箭头所示),DCM-AC与半胱氨酸反应后的产物DCM-OH并未完全去质子化,而是DCM-O-和DCM-OH共存的状态,但是已表现出明显的荧光增强,荧光值十分接近最大值的平台。 相反地,在此pH值范围内,DCM-AC却始终保持微弱的荧光强度,说明DCM-AC可作为探针应用于半胱氨酸的检测。 另外虽然在pH>8.2时,DCM-AC和DCM-OH 的荧光发射强度差别最大,但考虑到人体体液的pH值维持在7.4左右,故在后续实验中选取pH=7.4的缓冲溶液进行测试。
在温度为37 ℃,pH=7.4的 V(DMSO): V(PBS)=50:50(37 ℃)缓冲溶液中进行紫外滴定实验(图2 A)。 探针DCM-AC在530 nm处有强烈的紫外吸收,随着不同浓度半胱氨酸的加入,530 nm处的吸收不断降低,650 nm处有新的吸收峰出现,红移120 nm。 另外,在加入半胱氨酸后的几分钟内,肉眼可以清晰地观察到溶液的颜色从紫红色变成蓝紫色,表明半胱氨酸与DCM-AC的丙烯酰酯双键反应生成稳定的七元环结构,并最终从荧光团上消除,释放的苯氧负离子化合物DCM-O-供电子性更强,导致吸收红移。
在图2 B中可以进一步看出,探针DCM-AC在650 nm波长激发下,发射荧光很弱。当不同浓度的半胱氨酸加入后,具有亲核性的巯基和烯烃的双键发生加成反应,继而环化脱除内酰胺环状化合物,使得DCM-O-释放,具有显著的分子内电荷转移(ICT)效应,探针在710 nm处的荧光显著增强(图2 B)。 以罗丹明6G作为参比物,测得DCM-OH的荧光量子产率为5.1%。 从图2 B中DCM-AC对半胱氨酸的浓度滴定曲线可以看出,在710 nm 处的荧光增强比与1~8 μmol/L浓度的半胱氨酸呈现明显的线性相关,线性拟合方程为 y=A+kx,经过线性计算,拟合直线的斜率 k=402.23459,线性相关系数为0.9953。 测量10次DCM-AC的初始荧光值,计算得到仪器标准偏差 σ=38.0,继而得到在本文测试条件下,DCM-AC对半胱氨酸的检出限LOD=3 σ/k=2.8×10-7 mol/L,说明DCM-AC是高灵敏的半胱氨酸探针。
在荧光增强比-时间的实验中,比较了DCM-AC对半胱氨酸、高半胱氨酸和谷胱甘肽的选择性。 从图3 A中可以发现探针DCM-AC与半胱氨酸、高半胱氨酸反应后的荧光增强倍数基本相同,分别为6倍和5倍,而谷胱甘肽只观察到微弱的荧光增强,远小于半胱氨酸和高半胱氨酸。 探针DCM-AC与三者响应的差别还体现在响应时间上,DCM-AC在3 min内就可以与半胱氨酸反应完全达到平衡,而高半胱氨酸和谷胱甘肽的响应则需要30 min才能基本达到平衡。图3 B对荧光-时间曲线进行了线性拟合,通过计算直线的斜率可以得到探针DCM-AC与半胱氨酸的反应速率是高半胱氨酸的21倍,谷胱甘肽的147倍。 这是因为丙烯酰酯键与半胱氨酸环化反应的中间体是七元环,较高半胱氨酸的八元环更易形成,故反应速度更快,二者在成环动力学上具有差异,丙烯酰酯键可用来专一性地检测半胱氨酸。 因此,DCM-AC与3种硫醇在荧光增强的倍数和反应速率上具有显著的差异,DCM-AC可以区别测定半胱氨酸、高半胱氨酸和谷胱甘肽。
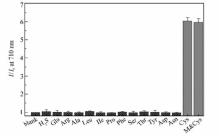
采用生物体内另一重要含硫化合物硫化氢(H2S)及其它常见的氨基酸作为干扰物,考察探针DCM-AC的抗干扰能力。
在DCM-AC(10 μmol/L)的DMSO-PBS(pH= 7.4,50/50,体积比)缓冲液中,分别加入50.0 化学计量(500 μmol/L)的硫化氢(H2S)、谷氨酸(Glu)、精氨酸(Arg)、丙氨酸(Ala)、亮氨酸(Leu)、异亮氨酸(Ile)、脯氨酸(Pro)、苯丙氨酸(Phe)、丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、天冬氨酸(Asp)、天冬酰胺(Asn)。 如图4所示,在50倍化学计量(500 μmol/L)半胱氨酸的存在下,探针DCM-AC的荧光有明显的增强;而在硫化氢或其它氨基酸的存在下,相同条件测试时,探针DCM-AC的荧光没有明显的增强。 由此可说明探针DCM-AC对半胱氨酸具有专一的识别能力。图4右侧2列灰色柱状图的竞争试验进一步表明:在测试体系中同时存在半胱氨酸和硫化氢/氨基酸干扰物时,探针DCM-AC仍然有明显的荧光响应,即探针DCM-AC对半胱氨酸的检测具有良好的抗干扰能力。
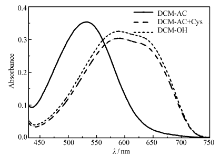
为了进一步研究DCM-AC与半胱氨酸的反应机理,首先对比DCM-AC与DCM-OH的紫外吸收光谱。 如图5所示,在pH=7.4的DMSO-PBS(50:50,体积比)缓冲液中,DCM-AC(10 μmol/L)的最大吸收峰出现在530 nm处,加入Cys 5.0倍化学计量(50 μmol/L)反应10 min后的DCM-AC+Cys的最大吸收峰红移至650 nm,和DCM-OH在pH=7.4的DMSO-PBS(50:50,体积比)缓冲液中的吸收光谱十分吻合。
利用质谱和核磁来进一步分析反应前后的产物。 在图6中,图6 A是DCM-AC的质谱图,438.1818对应的是其加氢离子峰[C27H24N3
 | 图6 DCM-AC滴加半胱氨酸前( A)、后( B)的质谱图Fig.6 Mass spectra of probe DCM-AC before( A) and after( B) addition of Cys |
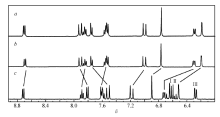 | 图7 DCM-AC滴加半胱氨酸后在DMSO-d6中的1H NMR谱图Fig.7 Partial1H NMR spectra of probe DCM-AC upon addition of Cys in DMSO-d6 a.the isolated aggregates after DCM-AC reacted with Cys; b.DCM-OH; c.DCM-AC |
设计并合成了基于苯并吡喃腈的检测半胱氨酸的近红外激活型荧光探针DCM-AC。 荧光激活的机制是DCM-AC的丙烯酰酯基团与半胱氨酸加成消除,从而释放苯并吡喃腈荧光团,荧光发射强度增加。 探针对半胱氨酸的检测具有专一性、高灵敏度、抗干扰的优点。 在加入半胱氨酸后,探针DCM-AC显示从紫红色到蓝紫色的颜色变化,因而可以作为半胱氨酸的“裸眼”探针。 由于基于苯并吡喃腈荧光团制备容易且具有长发射波长、良好的选择性及高光稳定性的优点,这将成为应用于生物探针的选择之一。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|