以荧光素酰肼与5-溴水杨醛反应合成了一种新型荧光素衍生物5-溴水杨醛荧光素腙(BSFH),采用红外、核磁、质谱、元素分析等技术手段对其进行了表征。 通过吸收光谱考察了在水溶液中BSFH对常见金属离子的选择性响应,发现BSFH在可见光区几乎无吸收,当加入常见金属离子时,吸收光谱上除了Cu2+之外的其它金属离子在496 nm处出现非常弱的吸收,而当Cu2+存在时,可以裸眼看到溶液颜色迅速从无色变为黄色,吸收光谱上在496 nm处出现了相对很强的吸收峰,并且随着Cu2+浓度的增加溶液的吸收强度不断增强,说明在水溶液中BSFH对Cu2+有很好的选择性。 实验结果表明,该化合物与Cu2+的化学计量比为1:1,Cu2+浓度线性范围为0.30~10 μmol/L,许多常见的金属离子不干扰Cu2+的测定,检测限为0.30 μmol/L,说明在水溶液中BSFH对铜离子具有很高的灵敏度。 据此,BSFH可以简单、快速、灵敏地在水溶液中识别和检测低浓度的铜离子。
A novel fluorescein derivative, 5-bromosalicylicaldehyde fluorescein hydrazone(BSFH), has been synthesized by reacting fluorescein hydrazine with 5-bromosalicylicaldehyde and characterized by IR, NMR, MS, elemental analysis. The selectivity of BSFH to common metal ions in aqueous solution was investigated by absorption spectroscopy. BSFH has almost no absorption in visible region and very low absorption at 496 nm with addition of other metal ions except Cu2+. However, in the presence of Cu2+, a rapid color change of BSFH from colorless to yellow along with a very obvious absorption appears at 496 nm in the absorption spectrum. The absorbance of BSFH at 496 nm increases gradually with the increase of Cu2+. The selective binding of BSFH to Cu2+ over other metal ions is remarkably high in the aqueous solution. Experimental results indicate that the chemical stoichiometric ratio between BSFH and Cu2+ is 1:1, the linear range of detecting Cu2+ concentration is 0.30~10 μmol/L, common metal ions do not show any interference on the determination of Cu2+, the detection limit is 0.30 μmol/L, and BSFH is highly sensitive to Cu2+ in the aqueous solution. Therefore, BSFH can be utilized to detect Cu2+ at low concentration with simple, rapid and sensitive method.
荧光素及其衍生物属于螺环化合物,具有独特的结构优点,碱性条件下一般为闭环结构,溶液颜色为无色,荧光也十分的微弱,但若有金属离子或其它离子与其反应结合后可能会将其螺环打开,产生明显的颜色变化,并伴随有大的刚性共轭体系,有极好的光谱特性,如长的吸收和发射波长,高的荧光量子产率,大的消光系数和对光的稳定性[1,2,3]。 因此,近几年来,荧光素及其衍生物常被用作不同目标分子的光学传感[4,5,6,7,8],尤其是金属离子,如Hg2+ [9]、Cu2+ [10,11,12,13]、Zn2+ [14]等。
铜离子是人体内除了铁和锌之外的第3种必需元素,它在各种生理过程中起着主要的作用,如骨骼的形成、细胞呼吸、造血功能、心血管疾病的预防、促进结缔组织形成等;也是几种金属酶的催化因子,如细胞色素c氧化酶、超氧化物歧化酶和酪氨酸酶等[15]。 它在人体中的含量对人类健康十分重要,通常,婴儿每天需要铜的量是0.4~0.6 mg,儿童需要1.5~2.5 mg,成人需要1.5~3 mg[16]。 若人体细胞中的铜离子平衡失调,可能会引起许多神经退行性疾病,如老年痴呆症、朊病毒病、帕金森氏病、威尔逊氏病、肌肉萎缩性侧索硬化症等[17]。 另外,利用重金属离子可以使蛋白质变性的原理,铜离子可以用于配制瓜果蔬菜等植物的杀菌剂-波尔多液,还可作为木质或皮质材料的防腐剂[18]。 目前报道的荧光素类探针测定铜离子的方法中,有些测定需要有机溶剂[2,19],有些涉及复杂昂贵的仪器设备[11],这样限制了它们的分析应用。 因此,研制适合于水相中简单快速检测铜离子的荧光素类探针在环境和生命科学等领域具有十分重要的意义。
本文采用荧光素为基体,以荧光素酰肼与5-溴水杨醛反应制备了新型荧光素衍生物5-溴水杨醛荧光素腙(BSFH),对其结构进行了表征。采用吸收光谱考察了BSFH在水溶液中对常见金属离子的响应,发现BSFH对Cu2+有很高的选择性响应,进而建立了水相中灵敏、简便、快速测定Cu2+的比色分析方法,具有一定的分析应用潜力。
TU-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司);TenSorII型傅里叶变换红外光谱仪(德国Bruker optics公司);Avance-300MHz型核磁共振谱仪(德国Bruker公司);Maldi-Tof-MS型质谱仪(德国Bruker公司);Vario EL cube型元素分析仪(德国Elementar公司);WRS系列微机熔点仪(上海索光光电技术有限公司)。
荧光素(C20H12O5,阿拉丁试剂有限公司),水合肼(N2H4·H2O,80%,上海迈瑞尔化学技术有限公司),5-溴水杨醛(C7H5O2Br,上海迈瑞尔化学技术有限公司),无水乙醇(99.7%,分析纯,天津市北辰方正试剂厂),各种金属离子盐等其它试剂均为分析纯,缓冲溶液用0.01 mol/L的磷酸盐缓冲液(PBS),实验用水为二次蒸馏水。
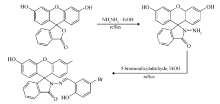
1.2.1 荧光素酰肼的合成 参考文献[15],称取1.00 g荧光素置于100 mL圆底烧瓶中,加入30 mL无水乙醇使其溶解,然后向其中滴加3.0 mL水合肼,搅拌回流8 h,停止反应并冷却,经旋蒸去除溶剂,再用甲醇重结晶,干燥后得灰白色固体粉末0.74 g,产率71%。
1.2.2 荧光素衍生物BSFH 的合成 称取0.35 g荧光素酰肼置于100 mL圆底烧瓶中,加入20 mL无水乙醇使其溶解,然后加入溶有5-溴水杨醛(0.22 g)的10 mL无水乙醇溶液,搅拌回流4 h,停止反应,冷却后旋蒸,再经甲醇重结晶,干燥后得暗黄色固体粉末0.37 g,产率70%(见Scheme 1)。 用无水乙醇将其配成1.0 mmol/L的BSFH储备液,备用。
将含有0.020 g CuCl2·2H2O的5 mL乙醇溶液滴加到含有0.053 g BSFH的10 mL乙醇溶液中,搅拌反应30 min后,过滤,干燥后得到BSFH-Cu(Ⅱ)化合物的粉末。
分别移取100 μL BSFH(1.0 mmol/L)储备液于一系列10 mL的比色管里,分别加入不同体积的Cu2+(1.0 mmol/L)的标准储备液,用PBS(pH=9.0)缓冲液定容至10 mL满刻度,在紫外-可见分光光度计上进行吸收光谱的扫描。
化合物BSFH,灰白色固体粉末mp >270 ℃。1H NMR(300 MHz,DMSO-d6), δ:10.46(s,1H),9.97(s,2H),9.06(s,1H),7.96(d, J=7.5 Hz,1H),7.64(d, J=9.1 Hz,1H),7.60(s,1H),7.53(s,1H),7.34(d, J=8.8 Hz,1H),7.14(d, J=7.5 Hz,1H),6.76(d, J=8.8 Hz,1H),6.67(s,2H),6.50(q, J=9.1 Hz,4H);13C NMR(75 MHz,DMSO-d6), δ:18.24,64.92(Cspiro),102.23,109.13,110.22,112.19,118.30,121.40,122.99,123.50,127.66,128.14,128.89,129.09,133.58,133.93,145.90,150.23,151.80,155.80,158.38,163.31;FT-IR(KBr), σ/cm-1:3357(—OH),1702(C=O),1612(C=N)。 元素分析C27H17O5N2Br实验值(计算值)/%:C 60.25(61.26),H 3.83(3.21),N 4.93(5.29),O 15.73(15.13);MS(Maldi-Tof): m/z,529.5[M+H]+,与实际相对分子质量相符合。
分别移取100 μL BSFH(1.0 mmol/L)储备液置于10 mL比色管里,然后向其中分别加入100 μL,1.0 mmol/L的不同金属离子(Ca2+、Al3+、Zn2+、Ag+、Hg2+、Cd2+、Pb2+、Ni2+、Mn2+、Co2+、Fe3+、Fe2+和 Cu2+)溶液,最后用PBS缓冲液(pH=9.0) 定容至10 mL满刻度,摇匀后静置10 s,在紫外-可见分光光度计上进行吸收光谱的扫描,结果见图1 A。 由图1 A可知,BSFH在可见光区几乎无吸收,当加入上述金属离子时,BSFH的吸收光谱发生了变化,除了Cu2+之外的其它金属离子加入后在496 nm处出现了很弱的吸收,而当Cu2+存在时,496 nm处出现了相对很强的吸收峰,说明BSFH对Cu2+有很好的选择性。
图1 B显示了3种不同溶液(BSFH溶液、合成的BSFH-Cu(Ⅱ)化合物溶液和BSFH+Cu2+的溶液)的吸收光谱。 从图1 B可以看出,BSFH溶液在496 nm处无吸收,当有Cu2+出现时496 nm处出现了很强的新吸收峰,正好与合成的BSFH-Cu(Ⅱ)化合物溶液的最大吸收峰的位置相同,说明在溶液中BSFH与Cu2+发生了反应,生成BSFH-Cu(Ⅱ)化合物。 为了进一步考证BSFH-Cu(Ⅱ)化合物的生成,对其进行了质谱测试,结果见图1 C。 从图1 C可以看出,在 m/z 610.53处出现了明显的峰与[BSFH-Cu2+-H2O+H]+正好相吻合,说明化合物BSFH-Cu(Ⅱ)的形成,荧光素类探针与Cu2+结合形成含有水的化合物与文献[16]报道相符合。
考察了BSFH和Cu2+相互作用的荧光光谱,结果见图1 D。 从图1 D可以看出,BSFH有微弱的荧光,这是因为BSFH结构中的荧光素基团处于闭环状态,当加入Cu2+后使得BSFH的荧光减弱,这可能是由于Cu2+是 d9结构的顺磁性离子造成的[20]。 但由于体系的荧光信号较弱,所以后续试验主要采用吸收法对体系进行研究。
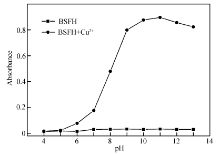
考察了pH值对BSFH及BSFH+Cu2+的影响,结果见图2。 由图中数据可以看出,pH值对BSFH基本没有影响,而对BSFH+Cu2+的影响比较明显,当pH值在4.0~9.0时BSFH+Cu2+的溶液吸光度随pH值的升高而增强,在pH值为9.0~13.0时溶液的吸收达到较高点,说明在碱性条件下有利于BSFH与Cu2+的反应。 虽然pH=11.0时溶液吸光度达最大,但根据Cu(OH)2的 Ksp计算得知在pH值越大的条件下,更易生成Cu(OH)2沉淀,并且pH=9.0时BSFH与Cu2+已经基本达到完全反应,所以,选择pH=9.0进行后续试验。
考察了在乙醇、乙腈、二甲基亚砜和水溶液(pH=9.0 PBS缓冲液)这4种不同溶剂体系中BSFH(10 μmol/L)对Cu2+(10 μmol/L)的响应,结果见图3 A。 从图中可以看出,在PBS缓冲液中吸光度达最高,说明在水溶液中BSFH对Cu2+的识别响应较好,扩大了该体系的分析应用范围。
固定BSFH的浓度为10 μmol/L,向其中加入0.33~10 μmol/L Cu2+的标准溶液后吸收光谱的变化见图3 B。 BSFH溶液的颜色为无色,当Cu2+存在时,溶液的颜色在10 s内很快变为浅黄色,并且随着Cu2+浓度的不断增加,496 nm处的吸收强度也不断增强,在一定范围内体系吸光度的变化与Cu2+的浓度呈良好的线性关系,线性方程为 y=0 .09006 x+0.01767,相关系数 R2=0.9966。 通过IUPAC确定的检出限的定义公式DL=3 Sb/ m[21],对空白进行了21次的平行测定,计算得到BSFH对Cu2+的检出限为0.30 μmol/L,与其它荧光素类探针检测Cu2+时的检测限作了比较,结果见表1,数据显示本探针对Cu2+的检测限还是较低的,说明BSFH对Cu2+有很高的灵敏度,可以用来在水溶液中检测低浓度的Cu2+。
| 表1 检测铜离子的不同荧光素类探针的比较 Table 1 Comparison of fluorescein-based probe for the detection of Cu2+ |
固定BSFH和Cu2+的总浓度为10 μmol/L,改变BSFH和Cu2+的相对比例,在紫外-可见光度计上测定每个比例溶液在496 nm处的吸光度值,以吸光度值为纵坐标,Cu2+在二者总浓度中所占比例为横坐标做Job's plot工作曲线[2],结果见图4。 从图4可以看出,当Cu2+在二者总浓度中所占比例为0.5时溶液的吸光度达到最大,说明Cu2+和BSFH反应的化学计量比为1:1。
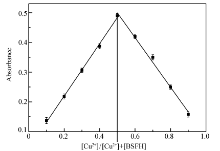 | 图4 BSFH与Cu2+的job's plot工作曲线(BSFH和Cu2+总浓度为10 μmol/L)Fig.4 Job's plot of BSFH with Cu2+([BSFH]+[Cu2+]=10 μmol/L) |
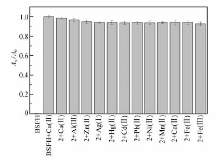
分别将300 μL,1.0 mmol/L Ca2+、Al3+、Zn2+、Ag+、Hg2+、Cd2+、Pb2+、Ni2+、Mn2+、Co2+、Fe3+或Fe2+加到含有Cu2+(10 μmol/L)和BSFH(10 μmol/L)的10 mL溶液中,测定其496 nm处的吸光度值,以单独Cu2+存在时的吸光度为 A0,加有其它金属离子溶液的吸光度为 Ax,以 Ax/ A0为总坐标作图,结果见图5。 由图5可知,BSFH在496 nm处无吸收,加入Cu2+时496 nm处吸收相对很强,当再加入其他金属离子后体系的吸光度变化均不大,说明其它金属离子对测定Cu2+基本没有干扰。
本文以荧光素酰肼和5-溴水杨醛为原料合成了一种新型的荧光素衍生物BSFH,并对其结构进行了表征。 通过紫外吸收光谱发现,在水溶液中,当Cu2+存在时,BSFH溶液颜色很快由无色变成浅黄色,在吸收光谱上496 nm处出现新的相对很强的吸收峰,而加入其它常见金属离子时BSFH吸收光谱变化不大,随着Cu2+浓度的不断增加,溶液496 nm处的吸收强度不断增强,其它常见金属离子对其测定基本没有干扰,说明BSFH对金属离子Cu2+有很好的选择性。 BSFH与Cu2+的摩尔比为1:1, Cu2+浓度线性范围为0.30~10 μmol/L,并且利用该方法测定Cu2+的检测限为0.30 μmol/L,与已报道的相关探针比较检测限较低,说明BSFH对Cu2+的测定具有较高的灵敏度。
该衍生物合成路线简单,产物易得,对Cu2+响应快、选择性好、灵敏度高,可在水溶液中简单、灵敏、快速地检测低浓度的铜离子,为在水溶液中对低浓度的Cu2+的识别和检测提供了理论依据,增添了一种新的荧光素类探针,具有潜在的应用价值,期望进一步应用于生物和环境等体系中Cu2+的检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|