利用双功能离子液体萃取剂三辛基甲基氯化铵2-乙基己基磷酸2-乙基己基酯盐([A336][P507])在HCl和HNO3介质中对Sc(Ⅲ)的萃取和分离。 研究表明,萃取剂在低酸度条件下,对Sc(Ⅲ)有较好的萃取能力;但是当水相酸度从0.5 mol/L增加到4 mol/L,Sc(Ⅲ)的萃取率有较大程度的下降。 并且讨论了在HCl介质和HNO3介质中,[A336][P507]萃取Sc(Ⅲ)的机理,由于Sc(Ⅲ)的半径最小,而且在萃取过程中存在P=O与P—O的竞争作用,使得其萃合物结构与轻稀土不同。 水相中加入盐析剂NaCl或NaNO3对Sc(Ⅲ)的萃取有一定的促进作用;萃取过程的热力学参数的结果表明,萃取反应是放热反应。 还研究了混合稀土中Sc(Ⅲ)和其它稀土离子的分离,在较低酸度的条件下萃取剂[A336][P507]对其它稀土离子的萃取可以忽略不计,因此该萃取体系对Sc(Ⅲ)和其它稀土离子有较好的分离效果,显示了本研究潜在的应用价值。
Extraction of Sc(Ⅲ) from HNO3 medium and HCl medium using a bifunctional ionic liquid extractant [A336][P507] was investigated. The results show that the extractability of Sc(Ⅲ) by [A336][P507] is high at low acidity. The extraction efficiency of Sc(Ⅲ) decreases when the aqueous phase acidity increases from 0.5 mol/L to 4 mol/L. The extraction mechanism was investigated. The extracted complex of Sc(Ⅲ) is different from light REs due to the smaller radius of Sc(Ⅲ) and the competitive effect of P—O and P=O. The extraction efficiency of Sc(Ⅲ) is enhanced with the increase concentration of NaCl or NaNO3 in the aqueous phase. Thermodynamic functions of the extraction reaction demonstrate that the extraction of Sc(Ⅲ) is an exothermic process. Extraction of other rare earth ions at low acidity by the extractant is negligible suggesting that [A336][P507] has potential in industrial applications of Sc(Ⅲ) extraction and separation over other rare earth ions.
钪与镧系元素性质相似,属于17种稀土元素之一。 由于钪及其化合物具有许多优异的性能,如熔点高、比重低,因此被广泛应用于航空航天、点光源、电子工业、核技术、超导技术等重要领域。 钪在自然界中极其分散,但并不稀少,地壳中钪的丰度为5×10-4~6×10-4。 目前全世界的钪储量约为2000 kt,其中90%~95%赋存在铝土矿、磷块岩及铁硅矿中,少数分布在铀、钍、钨、稀土(RE)矿石中[1]。 我国钪资源储量居世界第一,已知的含钪矿物种类多达800多种[2]。 我国含钪的矿床有铝土矿和磷块岩矿床、华南稀土矿、内蒙古白云鄂博稀土铁矿床、四川攀枝花钒钛磁铁矿床等[3,4,5]。 由于钪原料组成复杂和品位低的特点,导致钪的分离和提取工艺过程复杂,钪的产量低,价格昂贵,因此深入研究钪的提取意义重大。
溶剂萃取法具有操作简便、成本低、分离效果好等优点,广泛地应用于稀土和稀有金属分离。 钪与镧系元素性质相似,所以钪的萃取机理与其它稀土离子类似。 但其离子半径在稀土元素中最小(0.068 nm),电子结构最为简单,使得其萃合物与其它半径较大的轻稀土又有些不同。 一系列的萃取剂已应用于钪的萃取。 二(2-乙基己基)磷酸(D2EHPA,P204)是萃取钪最常用的试剂之一,在盐酸介质中可将钪与大量共存离子分离[6]。 磷酸三丁脂(TBP)可以从盐酸或硝酸溶液中萃取钪,使其与其它稀土元素、铝、锆和钍等分离。 100%的TBP在6 mol/L的盐酸介质中对钪的萃取率可达99%以上[7]。 甲基膦酸二甲庚酯(P350)的萃取能力比TBP大,选择性高,对于许多杂质元素来说,分离效果优于TBP。 Cyanex 923和Cyanex 925也被用于从H2SO4和HCl介质中萃取和分离Sc(Ⅲ)、Zr(Ⅳ)、Ti(Ⅳ)、Th(Ⅳ)、Fe(Ⅲ)和Lu(Ⅲ)。 并且与Cyanex 925相比,Cyanex 923有更好的萃取和分离Sc(Ⅲ)的能力[8]。
离子液体也称室温离子液体(RTIL)或低温熔融盐,通常是指熔点低于100 ℃,全部由阴、阳两种离子组成的有机类离子化合物。 离子液体已广泛应用于稀土元素的萃取分离[9,10]。 孙晓琦等[11]以季铵盐Aliquat 336为阳离子合成了一类双功能离子液体,如[A336][P507]、[A336][P204]、[A336][C272]、[A336][C302]、[A336][CA-12]、[A336][CA-100],并对这类离子液体萃取金属的性质进行研究,发现它们萃取金属的机理属于中性络合机理。 在萃取稀土离子的过程中,表现出了较高的萃取能力和选择性,并且界面现象良好,酸碱消耗少[12,13,14]。 本文研究了离子液体[A336][P507]分别在HCl和HNO3介质中对Sc(Ⅲ)的萃取,考察了水相酸度、萃取剂和盐析剂浓度等因素对Sc(Ⅲ)萃取性能的影响,进一步完善了[A336][P507]萃取稀土的机理,并为发展从混合稀土中分离Sc(Ⅲ)的研究提供了理论基础。
iCAP 6000型电感耦合等离子体原子发射光谱仪(ICP-AES,美国Thermo公司);三辛基甲基氯化铵(Aliquat 336,分析纯,美国Aldrich公司);萃取剂2-乙基己基磷酸2-乙基己基酯(P507)(洛阳奥达有限公司);实验用水为去离子水;RE(Ⅲ)储备液的配制:将RE2O3(纯度>99.9%)溶于浓HCl或浓HNO3中,赶酸,再经去离子水稀释后定容。
按照文献[11]方法制备离子液体[A336][P507]:取112.36 g Aliquat 336溶于500 mL经蒸馏过的异丙醇,使其完全溶解。 圆底烧瓶中加入6.39 g金属钠,再加入125 mL经蒸馏过的异丙醇,在50 ℃反应3 h制备醇钠。 将上述溶液混合,于50 ℃搅拌4 h,制备[A336][OR](OR:(CH3)2CHO-)。将所得溶液在4000 r/min的条件下离心10 min,除掉氯化钠沉淀。 在滤液中加入500 mL去离子水,振荡30 min,进行水解制备[A336][OH]。在[A336][OH]中加入62.48 g P507(其中 n([A336][OH]): n(P507)=1.1:1),将溶液在50 ℃下回流搅拌12 h,将所得溶液静置分相后,舍去下相,将上相于80 ℃,2000 Pa下旋出所含异丙醇及水,得到[A336][P507]。
Sc(Ⅲ)的萃取:分别取1 mL溶于正庚烷的[A336][P507]与4 mL的含有Sc(Ⅲ)的水相于平衡管中,将平衡管放入恒温振荡器中预热20 min,然后振荡30 min,离心3 min,使其充分分相,取一定体积的水相分析其浓度,再用差减法计算得到有机相中稀土离子的浓度。 分配比( D)和萃取率( E/%)的计算公式如下:
式中, ci表示萃取前溶液中稀土离子的起始浓度(mol/L), ce表示萃取后溶液中稀土离子的平衡浓度(mol/L), Va表示水相体积, Vo表示有机相体积。
在萃取实验中,探讨了HCl和HNO3浓度对Sc(Ⅲ)的萃取率的影响,从图1可以看出,在[A336][P507]萃取体系中,随着HCl或HNO3浓度的增加,Sc(Ⅲ)的萃取率都有显著下降,产生这一结果的原因可能是在[A336][P507]萃取体系中存在着Sc(Ⅲ)与HCl或HNO3的萃取竞争[14]。 随着HCl或HNO3浓度的增加,有更多的酸被萃到有机相中,而Sc(Ⅲ)仍然被留到水中,导致Sc(Ⅲ)的分配比随着酸度的增加而下降。 从图1可以观察到,在[H+]>1 mol/L时,Sc(Ⅲ)在HNO3介质中的萃取率要略高于在HCl介质中的萃取率,Cl-和N
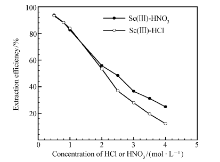 | 图1 HCl和HNO3浓度对萃取Sc(Ⅲ)的影响Fig.1 Effect of the HCl or HNO3 concentration on the extraction of Sc(Ⅲ) c([A336][P507])=0.02 mol/L ci(Sc(Ⅲ))=5.08×10-4 mol/L |
为了更好的解释[A336][P507]萃取体系的机理,用传统的斜率分析方法进行分析。图3中显示了Sc(Ⅲ)的分配比与萃取剂浓度的关系。 随着萃取剂浓度的增大,Sc(Ⅲ)的分配比也增大。 在HCl和HNO3体系中,Sc(Ⅲ)的lg D对lg c([A336][P507])的直线的斜率均为2.8。 说明在两个萃取体系中,[A336][P507]和Sc(Ⅲ)的
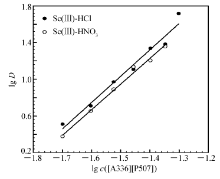 | 图3 萃取剂浓度对萃取Sc(Ⅲ)的影响Fig.3 Effect of the extractant concentration on the extraction of Sc(Ⅲ) c ([A336][P507])=0.02 mol/L, c(HCl)=2.4 mol/L, c(HNO3)=2.7 mol/L, ci(Sc(Ⅲ))=5.08×10-4 mol/L |
化学计量比约为3:1。 这与孙晓琦[15]研究的用离子液体[A336][P204]在HNO3介质中萃取Eu(Ⅲ)的化学计量比是一致的。 虽然孙晓琦的文章中已经提出[A336][P204]萃取Eu(Ⅲ)的过程主要是萃取剂的P=O与Eu(NO3)3发生络合作用,并且得出水相HNO3的浓度为0.006 mol/L时,萃合物中的Eu(Ⅲ)就可以被完全反萃下来。 但是从本实验中可以观察到有机相中的Sc(Ⅲ)很难用高浓度的HCl或HNO3完全反萃下来。 这可能是因为Sc(Ⅲ)在所有稀土元素中离子半径最小,更容易与[A336][P507]中的配位基团相结合,使得其萃合物结构与半径较大的轻稀土有所不同,在萃取过程中可能会形成新的配合物Sc(Cl)3- n[P507] n·(3- n)[A336][P507]( n=1,2或3),与Guo等[12]提出的重稀土的萃合物结构一致。 在萃取过程中,[A336][P507]中的P=O与P—O相互竞争与Sc(Ⅲ)发生作用,既存在P=O与Sc(Ⅲ)的作用(P=O≡Sc也存在P—O与Sc(Ⅲ)相互作用(P—O••••Sc),与 P=O••••Sc相比, P—O••••Sc的作用使得形成的萃合物更加稳定,这是导致Sc(Ⅲ)很难被反萃下来的主要原因。
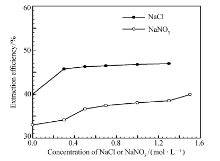
在萃取过程中,盐析剂对萃取有重要的影响,因此,本文还分别研究了在HCl介质中加入不同浓度的NaCl以及在HNO3介质中加入不同浓度的NaNO3对[A336][P507]萃取Sc(Ⅲ)的影响,结果如图4所示。 在HCl介质中未加入NaCl时, c(HCl)=2.4 mol/L,Sc(Ⅲ)的萃取率约为40%,从图4可以看出,加入NaCl以后,Sc(Ⅲ)的萃取率都大于40%;在HNO3介质中未加入NaNO3时, c(HNO3)=3.2 mol/L,Sc(Ⅲ)的萃取率约为33%,加入NaNO3以后,Sc(Ⅲ)的萃取率均大于33%。 当盐析剂的浓度增大时,两种介质中Sc(Ⅲ)的萃取率都略有增大,这说明盐析剂在本实验中对萃取过程有一定的促进作用。 随着盐析剂浓度的增加,它对Sc(Ⅲ)萃取的影响与Zhang等[13]提出的盐析剂对其它稀土离子的影响是一致的。
在固定的水相酸度,萃取剂浓度的条件下,研究了温度对萃取的影响,测定了不同温度(298~323 K)下的 D值,以lg D对1000/ T作图,结果如图5所示。 随着温度的增加,Sc(Ⅲ)的分配比降低。萃取过程中的焓变Δ H可由van't Hoff方程求得,反应过程的吉布斯自由能Δ G和熵变Δ S可由方程(4)和(5)计算而得:
式中, R为气体常数(J/(mol·K)), C为常数,自由能(Δ G)与(Δ S)分别定义为:
求得的热力学常数列于表1中,[A336][P507]在对Sc(Ⅲ)的萃取过程中Δ H<0,这说明整个萃取过程属于放热反应,表明在低温下更适合萃取反应的进行。
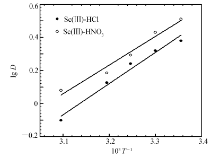 | 图5 温度对萃取Sc的影响Fig.5 Effect of temperature on the extraction of Sc(Ⅲ) c([A336][P507])=0.02 mol/L, c(HNO3)=2.52 mol/L, ci(Sc(Ⅲ))=5.08×10-4 mol/L, c(HCl)=2.45 mol/L |
| 表1 萃取Sc(Ⅲ)的热力学参数 Table 1 Thermodynamic functions of Sc(Ⅲ) |
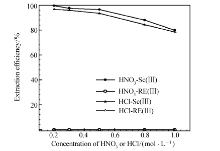
本文研究了离子液体[A336][P507]在HCl和HNO3介质中对Sc(Ⅲ)和其它稀土离子的选择性。 萃取有机相是0.02 mol/L的[A336][P507],水相是5.08×10-4 mol/L的Sc(Ⅲ)、La(Ⅲ)、Nd(Ⅲ)、Eu(Ⅲ)、Y(Ⅲ)、Yb(Ⅲ)和Lu(Ⅲ)的混合物,相比O/A=1:4。 从图6可以得出,对于[A336][P507],随着HNO3浓度从0.2 mol/L增大到1 mol/L,Sc(Ⅲ)的萃取率从99.5%下降到79.9%,而在这个酸度范围内,萃取剂对其它稀土离子的萃取率均为0;随着HCl浓度从0.2 mol/L增大到1 mol/L,Sc(Ⅲ)的萃取率从96.8%降低到78.5%,而对其它稀土离子的萃取基本可以忽略不计。 从图6可以得出,酸度越低,Sc(Ⅲ)与其它稀土的分离效果越好,所以在Sc(Ⅲ)与其它稀土的分离过程中,酸的消耗比较少。
本文系统地研究了在HCl或HNO3介质中离子液体萃取剂[A336][P507]对Sc(Ⅲ)的萃取。 在低酸度条件下,对Sc(Ⅲ)的萃取能力比较高,酸的消耗少。 酸度对萃取的影响表明,随着水相酸度的增大,对Sc(Ⅲ)的萃取能力降低。 由于Sc(Ⅲ)在所有稀土元素中的特殊性,进一步讨论了[A336][P507]在HCl或HNO3介质中的萃取Sc(Ⅲ)的机理,得到其萃合物结构与其它轻稀土有所不同。 计算了萃取反应的热力学参数,得出萃取反应是放热反应。 盐析剂浓度对萃取的影响表明,在[A336][P507]萃取体系中,盐析剂NaCl和NaNO3的加入对Sc(Ⅲ)的萃取有一定的促进作用。 在分离Sc(Ⅲ)和其它稀土离子的实验结果表明,在低酸度条件下,萃取剂对Sc(Ⅲ)和其它稀土离子有较好的分离效果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|