共同通讯联系人:吕国军,副研究员; Tel/Fax: 0411-84379139; E-mail:lgj1802@dicp.ac.cn; 研究方向:生物医学转化
通过载体聚乙烯吡咯烷酮(PVPk29/32)和羟丙基甲基纤维素(HPMC),采用溶剂法制备白藜芦醇(Res)二元及三元固体分散体。 用傅里叶变换红外光谱(FTIR)、调制式差示扫描量热(MDSC)和X射线粉末衍射(XRD)等技术手段来表征Res二元和三元固体分散体并考察其溶出度。 FTIR结果显示,Res与PVPk29/32及HPMC均存在氢键相互作用;溶出结果表明,二元和三元固体分散体均能提高药物的溶出度。 而XRD和MDSC结果表明,三元固体分散体的相容性优于二元固体分散体;3个月的加速实验(40 ℃,75%RH(relative humidity))中,XRD、MDSC及体外溶出结果表明,Res三元固体分散体的稳定性优于Res二元固体分散体。 HPMC的加入可以改善Res三元固体分散体的溶出及稳定性。
Co-corresponding author:LYU Guojun, associate professor; Tel/Fax:0411-84379139; E-mail:lgj1802@dicp.ac.cn; Research interests:transformation of biomedical
Resveratrol(Res) binary and ternary solid dispersions solid dispersions with poly(vinylpyrrolidone)(PVP) and hydroxypropylmethylcellulose(HPMC) were prepared by the solvent evaporation. Solid dispersions were characterized by Fourier transform infrared spectroscopy(FTIR), X-ray powder diffraction(XRD) and modulated differential scanning calorimetry(MDSC), and the release profiles were also invested. FTIR results reveal hydrogen bonding formed between Res and polymers. The release profiles of both Res solid dispersions are enhanced. However, XRD and MDSC results show that the miscibility of ternary solid dispersions is better than that of its binary solid dispersions. Under accelerated testing condition(40 ℃, 75%RH(relative humity)) for 3 months, XRD, MDSC and the release profiles indicate that Res ternary solid dispersions are more stable than that of its binary solid dispersions. The release profiles and stability of Res ternary solid dispersions are improved with the addition of HPMC.
口服制剂由于稳定性好、顺应性强和生产成本低等优点一直以来是药物传递体系的首选。 然而提高难溶性药物——尤其是生物药剂学分类系统II类(Bio-pharmaceutic Classification System Class II,BCS-II)药物的溶解度和溶出度仍然是口服给药的难题[1,2,3]。 药物由于溶出度和溶解度低很难被胃肠道吸收,从而导致个体差异大、生物利用度低等问题。 白藜芦醇(resveratrol,Res)是虎杖、花生和葡萄等植物中含量较高的多酚物质。 具有广泛的生物学性能,如抗肿瘤、保护心脏和抗炎活性[4,5,6]等。 但是由于水溶性差,生物利用度低等缺点,极大地限制了它在预防和治疗中的应用[7,8]。
目前用于提高难溶性药物溶解度和溶出度的增溶技术有:减小粒径、成盐、络合物、制成前体药物、纳米混悬剂、胶束、微乳和固体分散体等。 与其它增溶技术相比,固体分散体看似非常简单,但却具有普适性。 固体分散技术是提高水难溶性药物溶出速率和溶解度、增加其口服生物利用度的有效方法之一[9,10,11,12]。 固体分散技术是指将药物以无定形、微晶以及分子状态等多种形态高度均匀地分散在固体载体材料中的制剂技术。 其中无定形固体分散体能大大提高难溶性晶体药物的溶出度,这是由于晶体药物的粒径显著减小,甚至以分子态均匀分散在水溶性载体材料中,形成分子固体溶液;水溶性载体材料能显著提高药物的润湿性;并且无定形态药物具有较高的混乱度(较高的自由能),因此,不需要额外的能量来破坏晶体结构[13]。但是,无定形态(非晶态)是一种亚稳态,在存储的过程中容易出现硬度增加、晶体析出或结晶粗化,因而药物溶出速率下降、最终导致生物利用度降低,发生这种现象在药剂学上称之为老化。 玻璃化转变温度( Tg)是无定形高分子的一个重要的物理性质,在 Tg以下,高分子处于玻璃态,分子链和支链均不能运动;而在 Tg以上时,支链开始运动,表现出高弹态的性质;如果温度进一步升高,达到粘流态温度,就可以使整个分子链运动。 高分子载体通常有很高的 Tg值,能提高无定形固体分散体体系的 Tg,在室温的存储条件下分子运动受限,因此能提高无定形固体分散体系统的物理稳定性。 此外,很多载体高分子聚合物有特征性官能团,如聚乙烯吡咯烷酮(PVP)内酰胺环上的羰基(—C=O),它可以作为质子受体与质子供体(药物)形成氢键。 分子间相互作用的存在能增加无定型系统的相容性,从而体系不易发生相分离而重结晶,达到维持无定形体系的稳定性的目的。 然而,环境中的水分可以破坏药物和聚合物间相对较弱的分子间相互作用,使药物发生聚集,甚至结晶,产生相分离;温度能提高分子运动速率,加速相分离。聚乙烯吡咯烷酮(Polyvinyl Pyrrolidone,PVP)和羟丙基甲基纤维素(Hydroxy propyl methyl cellulose,HPMC)均为无定形水溶性高分子,常用来制备二元固体分散体。 虽然药物-PVP制备的二元固体分散体有良好的速释效果,PVP较高的 Tg(120~174 ℃)在短时间内也可以提高二元固体分散体的稳定性。 但PVP的吸湿性很强,容易引进水分,使药物-PVP体系产生相分离。 HPMC具有很高的 Tg(170~210 ℃),并且含有可以发生相互作用的官能团,能提高无定形固体分散体系统的物理稳定性。 本研究采用联合载体技术制备Res固体分散体(二元和三元固体分散体),第一和第二载体分别为PVP和HPMC。 PVP含有—C=O是质子受体,HPMC和Res均含有羟基(—OH)质子供体,两种无定形高分子载体理论上均可以和Res形成氢键,重点研究氢键对二元和三元固体分散体的溶出速率、相容性和稳定性的影响。
WATERS2695型高效液相色谱仪(美国Waters公司),2998PAD检测器,Alliance COL柱温箱;Sinochrom C18 ODS型色谱柱(大连化学物理研究所);RC806型智能溶出试验仪(天津天大天发有限公司);移液器(德国Eppendorf公司);BS110S型电子分析天平(德国Sartorius公司);真空干燥机(上海一恒科技有限公司);Bruker Vector 22型傅里叶变换红外光谱仪(德国Bruker公司);X'Pert Pro-1型X射线衍射仪(荷兰帕纳科公司);Q1000型调制式差示扫描量热仪(美国TA公司)。
白藜芦醇(Res)原料药(≥98%,南京泽朗医药科技有限公司);Res对照品(中国食品药品检定研究院,批号:111535-200502);PVPk29/32和HPMC(Aladdin Chemistry Co. Ltd );其它试剂均为分析纯;超纯水(Ultrapure water,美国Millipore公司)。
HPLC测定条件:Sinochrom C18 ODS柱(250 mm×4.6 mm,5 μm,柱号:E2012309);流动相 V(甲醇): V(水)=50:50;检测波长308 nm;流速1 mL/min;进样体积20 μL;柱温27 ℃。 采用外标法进行定量测定。
固体分散体的制备:按一定质量比例称取Res、PVP(和HPMC),制备Res质量分数为10%~50%的二元(和三元)固体分散体,并选择临界比例进行研究。 先用无水乙醇将Res原料药在茄形瓶中完全溶解,再加入PVP(和HPMC)使其完全溶解。 超声15 min得到均一溶液,旋转蒸发(45 ℃)除去乙醇,真空干燥除去残留溶剂。 真空干燥后研磨成细粉,过孔径为180 μm的筛网备用,即得二元(和三元)固体分散体。
调制式差示扫描量热仪(MDSC):固体分散体中若有晶体药物,则有吸热峰存在;晶体药物存在越多,吸热峰总面积越大。MDSC分析条件为:样品量,5~10 mg;扫描范围,-10~300 ℃;升温速率:10 ℃/min;扫描环境:N2气气氛。
X射线衍射(XRD):在鉴别固体分散体时,若有晶体药物,则在衍射图上就有这种晶体药物的特征衍射峰,据此可以定性分析固体分散体中药物的存在状态。 XRD分析条件为:Cu/石墨靶单色器;管流20 mA;高压强度40 kV;扫描范围5°~60°;步长0.04°;扫描速率,2 θ角0.04°/s。
傅里叶变换红外光谱(FTIR):采用溴化钾制片法,将样品粉末以质量分数为2%的比例加入到光谱纯溴化钾粉末中,用干燥的琥珀研钵在红外灯照射下充分研磨后压片,在400~4000 cm-1内进行FTIR测定。
药物体外溶出度测定:准确称取含5.00 mg Res的固体分散体,按照国家药典2010年版二部附录XC第二法进行溶出度测定。 以0.20 mol/L盐酸溶液调节pH值至1.2为溶出介质,温度(37±0.50) ℃,搅拌速度(100±1.00) r/min,分别于5、10、20、30、45和60 min取样1.00 mL,并同时补充等量等温的溶出介质。 将所取样品经0.22 μm微孔滤膜过滤后,于308 nm波长处测定峰面积,采用外标法计算Res浓度,并换算为累积溶出百分率。
固体分散体中药物存在形式的稳定性考察:将未经密闭和研磨处理的所有样品贮存在45 ℃、75%RH(relative humudity)条件下,对贮存了3个月样品进行MDSC、XRD和溶出测定。
各测试样品的红外光谱见图1。 比较各样品的FTIR结果(图1 A)可见,Res和PVP形成固体分散体后,Res的—OH吸收峰峰展宽,同时PVP的—C=O伸缩振动峰(1676 cm-1)向低波数位移(1670 cm-1),说明Res和PVP之间发生氢键相互作用,因而Res在PVP中是无定形分散。 而Res/PVP/HPMC三元固体分散体与二元固体分散体相比(图1 B),Res的—OH吸收峰展宽程度增大; —C=O吸收峰展宽,并且向更低的波数位移(1670 cm-1→1656 cm-1),说明HPMC和Res以及PVP间均可以形成氢键相互作用,因此维持Res无定形的作用力增强,有利于维持固体分散体的稳定性。
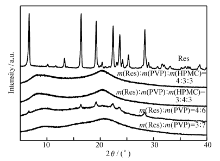
药物和载体间存在氢键相互作用能破坏药物和药物间的氢键,使药物的晶格遭到破坏,因此药物在载体材料中以无定形分散。图2显示,原料药Res的XRD谱图中,有多个尖锐的衍射峰,说明Res是良好的结晶态;而PVP和HPMC的XRD谱图中没有晶体衍射峰,说明二者呈无定形态。 质量分数为30%时,Res二元和三元固体分散体的XRD谱图中,原料药Res的晶体衍射峰消失,表明原料药形成固体分散体后以无定形或分子态高度分散在高分子载体材料中;质量分数为40%时,二元固体分散体出现结晶峰,三元固体分散体仍以无定形分散。 说明HPMC的加入使药物和载体间的相互作用增强,提高了药物在载体中的固体溶解度。
MDSC用来确定药物分子与载体分子的相容性。 如果MDSC结果显示有一个 Tg,表明药物和载体相容性良好;如果出现多个 Tg,表明药物和载体发生相分离。图3显示,质量分数为30%时,Res二元和三元固体分散体只有一个 Tg,说明二者没有发生相分离,药物和载体相容性良好。 但是二元固体分散体的 Tg(115.40 ℃)远远小于三元固体分散体的 Tg(155.23 ℃);质量分数为40%时,二元固体分散体出现两个 Tg值,一个为 Tg1(107.85 ℃)一个接近PVP的 Tg2 (136.44 ℃),说明二元固体分散体发生相分离;而质量分数为40%时,三元固体分散体仍然只有一个 Tg(144.46 ℃),说明三元固体分散体中药物和载体材料的相容性优于二元固体分散体。 这是因为HPMC增加了药物和载体间的相容性并使三元固体分散体的 Tg得到提高。
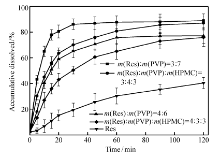
由于药物和载体间存在氢键相互作用,载体对药物具有抑晶性,能阻止已分散的药物再聚集粗化,药物在载体材料中以无定形分散,大大提高了药物的比表面积,并且水溶性载体可提高药物的可润湿性。 因此,由图4可以看出,二元和三元Res固体分散体的溶出度均明显高于原料药Res的溶出度。 药物质量分数相同时,二元和三元Res固体分散体120 min时的累积溶出度无显著差异( P>0.05),只是二元固体分散体的溶出速度大于三元固体分散体,质量分数为30%时,二元固体分散体在30 min便达到溶解平衡,三元固体分散体则需要90 min;这可能是因为三元固体分散体中药物和载体间的相互作用增强,限制了药物的溶出速度。 二元和三元固体分散体随着药物质量分数的增大,累积溶出度都呈现降低的趋势。
高温和水分可以增加分子迁移速率,加速重结晶的过程。 在温度40 ℃,湿度75%的条件下存储3个月,由XRD结果(图5)可知,质量分数为30%时,Res二元和三元固体分散体的分散结构仍为无定形;质量分数为40%时,二元固体分散体结晶粗化,结晶度增加,三元固体分散体仍以无定形分散。 而MDSC结果(图6)显示质量分数为30%时,二元固体分散体发生相分离,出现两个 Tg,一个接近Res的 Tg1(83.70 ℃)一个接近PVP的 Tg2(167.99 ℃);质量分数为40%时,二元固体分散体在170.33 ℃出现熔融峰;说明质量分数为30%和40%时,二元固体分散体已经发生相分离,MDSC的检测灵敏度要高于XRD。 同样加速条件下,质量分数为30%和40%时,三元固体分散体的 Tg相比初始值基本无变化;说明Res在三元固体分散体中仍然以无定形分散,其和高分子载体没有出现相分离,稳定性良好。 溶出度结果(图7)表明,质量分数为30%时,二元固体分散体的累积溶出度与初始相比极显著下降( P<0.01);三元固体分散体的累积溶出度与初始时相比无显著差异( P>0.05),进一步佐证了XRD和MDSC的实验结果。
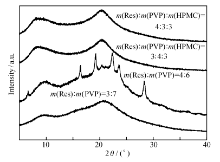 | 图5 加速实验(40 ℃,75%RH)3个月,Res二元和三元固体分散体的XRD图谱Fig.5 X-ray diffraction patterns of Res binary and ternary solid dispersions stored at 40 ℃ and 75%RH after 3 months from day of preparation |
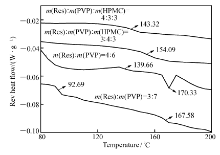 | 图6 加速实验(40 ℃,75%RH)3个月,Res二元和三元固体分散体的MDSC图谱Fig.6 MDSC curves of Res binary and ternary solid dispersions stored at 40 ℃ and 75%RH after 3 months from day of preparation |
'>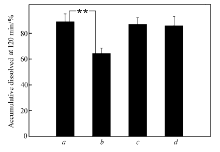 | 图7 加速实验(40 ℃,75%RH)3个月前( a, c)后( b, d),质量分数为30%时Res二元( a, b)和三元( c, d)固体分散体的120 min时的累积溶出度Fig.7 Accumulative dissolution(at 120 min) of Res(mass fraction of 30%) binary( a, b) and ternary( c, d) solid dispersions before( a, c) and after( b, d) storage at 40 ℃ under 75%RH for 3 months' accelerate tests |
稳定性实验结果说明三元固体分散体的稳定性优于二元固体分散体。 这是因为HPMC能提高三元固体分散体的 Tg,并且HPMC和药物存在分子间氢键相互作用,使其分子运动速率降低,提高药物和载体的相容性,使三元固体分散体体系不易产生相分离,药物仍然以无定形分散在高分子载体中,因此能保持稳定的增溶特性。
采用溶剂法制备Res二元和三元固体分散体,HPMC的加入使药物和载体间的氢键作用增强,这种相互作用的强弱与形成无定形的能力成正比,并且有抑晶的作用,有利于维持固体分散体的稳定性。 HPMC还能提高三元固体分散体体系的 Tg,使其分子运动速率降低,提高药物和载体的相容性,使三元固体分散体体系不易产生相分离。 因此三元固体分散体比二元固体分散体的稳定性有所提高。 综合以上说明三元固体分散体更利于II类药物分子的无定形分散以及保持其稳定的增溶性能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|