三链DNA是一种具有众多生理学功能的生物大分子,可用于基因的表达调控,可以作为一种基因疗法的手段控制基因的转录和调节特定基因的表达。 药物小分子与DNA的相互作用对于实现小分子的药理功能并介导相关生理过程都是非常重要的。 在过去的几十年里,科学家们付出了很多努力来研究三链核酸的结合剂,然而报道的比较有效的筛选方法并不多。 本文从提高TC型三链DNA稳定性的策略、三链DNA与结合剂相互作用的研究方法的原理及应用、研究方法的展望三方面展开论述。 主要阐述了平衡透析法、纳米金比色法、多种核酸结构混合变温法、离心超滤法、电喷雾直接进样法、液质联用法和光谱学方法(紫外分光光谱、荧光光谱、圆二色光谱)等几种方法的原理、应用及存在的问题,对小分子配体与三链DNA相互作用的研究具有重要的意义。
Triplex DNA can interfere with gene transcription and expression modulation. It is one kind of important biological macromolecules. The interaction between small molecules and DNA targets plays an important role in the function of drug mediated physiological processes. In the past decades, numerous attempts have been made to screen triplex DNA binders. However, not too many effective methods for screening triplex DNA binders were reported. Basic principles, the screening methods of research and application for the interaction between small ligands and triplex DNA were summarized, including mainly the principle and application of several methods, such as competition dialysis, gold nanoparticle based approach, thermal denaturation method, centrifugal ultrafiltration method, electrospray ionization mass spectroscopy(MS) method, and liquid chromatography-mass spectroscopy(LC-MS) combined method. This review has a general instruction to the research of the interaction between small ligands and triplex DNA.
1957年,Felsenfeld等[1]首次提出三链DNA这种特殊的结构。 1963年,Hoogesteen等[2]详细地描述了这种结构,即在双螺旋结构的基础上,第三条寡聚脱氧核苷酸的碱基可通过Hoogsteen氢键配对的方式结合在双链DNA的大沟区,形成三链DNA,其中形成三链DNA的每条链段必须为全嘌呤序列或全嘧啶序列,结合于目标双链形成三链DNA的寡聚脱氧核苷酸片段被称为TFOs(triplex-forming oligonucleotides)。 三链DNA发现初期,由于没有足够的证据表明三链DNA能够在体内存在,其实际的生物学意义曾一度沉寂,直到Helene等[3,4]证实三链DNA可用于基因的表达调控,研究者们才开始对三链DNA产生浓厚的兴趣。 现在的研究表明,三链DNA可以作为一种基因疗法的手段控制基因的转录和调节特定基因的表达[5]。
根据三链DNA的组成和取向,分子间三链DNA可以分为三类:第一类,TC型三链DNA(C+·GC和T·AT三联体,平行;A为腺嘌呤、G为鸟嘌呤、T胸腺嘧啶、C为胞嘧啶);第二类,GT型三链DNA(G·GC和T·AT三联体,平行或者反平行);第三类,GA型三链DNA(G·GC和A·AT三联体,反平行)[6]。 在目前研究比较多的是TC型,与GT型和GA型相比,其配对形式的多样导致形成三链DNA的特异性较差,另外,富含G的单链DNA在单价阳离子的诱导下会自发形成四链DNA从而抑制了三链DNA的形成。 TC型三链DNA也有自身的问题,在C+·GC碱基三联体中,C需要质子化之后才能通过两个Hoogsteen氢键与G(鸟嘌呤)结合。 胞嘧啶的pH依赖性,使得TC型三链DNA要在远低于生理pH值的条件下(pH 5.0~6.0)才能稳定存在,而在生理条件下的稳定性不佳。 如何提高TC型三链DNA在生理条件下的稳定性一直是三链DNA领域的一个研究热点。 本工作将从提高TC型三链DNA稳定性的策略、三链DNA与结合剂相互作用的研究方法的原理及应用、研究方法的展望三方面展开论述。
虽然分子间的TC型的三链DNA具有优良的特异性可以用于识别特定的双链DNA片段,可以利用这一特性实现众多应用,但这种结构的三链DNA具致命的缺陷就是C+·GC三联体的形成需要酸性条件以形成质子化的C+,而正常的生理条件都是中性的,在此条件下TC型三链DNA的稳定性比较差,基本上很难形成,因而如何提高TC型三链DNA的稳定性是三链DNA研究领域的一个热点,不仅仅有着重要的理论意义还有着广泛的实用意义。 提高TC型三链DNA稳定性的常规策略有两种:1)TFOs的化学修饰;2)利用小分子与三链DNA形成非共价复合物[6]。
TFOs的化学修饰包括碱基修饰、磷酸骨架修饰和糖配体的修饰[7,8,9,10]。 由于TC型三链DNA结构的不稳定性是由质子化的胞嘧啶引起的,因而碱基修饰的研究重点集中在对胞嘧啶的修饰上,通过修饰获得的胞嘧啶类似物有5-甲基胞嘧啶、6-O胞嘧啶、异胞嘧啶、2-氨基吡啶和吡嗪类似物,这些改造的碱基均能在生理条件下形成Hoogsteen的氢键来稳定三链DNA结构。 其它的一些修饰的碱基像胸腺嘧啶则有脱氧尿嘧啶或5-丙炔-脱氧尿嘧啶。 对鸟嘌呤的修饰则有N7-鸟嘌呤。 对磷酸骨架的修饰主要是用磷酸酯、硫代磷酸酯和肽核酸来代替负电荷的磷酸骨架,可以通过降低核酸链之间的静电排斥作用来稳定三链DNA结构。 对糖配体的修饰主要有2'-甲氧基化、2'-氨基化、O2'-O4'甲基连接和O2'-O4'乙基连接。
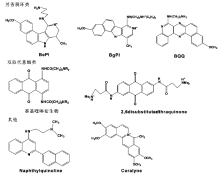
小分子配体与三链DNA形成非共价复合物来提高三链DNA在体内环境下的稳定性对于三链DNA基因调控起重要的作用。 小分子与三链DNA的非共价作用模式主要有3种:外部结合、沟间作用和插入作用。 第一个被研究的是双链DNA的结合剂溴化已锭,虽然它也能与三链DNA结合,但是不具有选择性也无法稳定三链DNA[11,12]。 1992年,Mergny等[13]报道了第一种选择性结合并稳定TC型三链DNA的芳香稠环类化合物BePI(benzo[e]pyridoindole),结构式见图1。 它通过插入模式作用于三链DNA,BePI的母核插入到碱基三联体中通过碱基堆积与DNA相互作用,侧链位于沟间以提供多余的氢键和疏水作用来稳定复合物[14]。 BePI对三链DNA具有选择性的原因是其母核结构的大小和柔度与三链DNA的三联体能够很好地吻合,而对双链DNA的碱基对来说,该母核过大无法进行有效的碱基堆积。 BePI稳定的是T·AT碱基三联体而不是C+·G碱基三联体C,因为质子化的C+与BePI母核上的正电荷存在静电排斥作用[13]。 随后各种BePI的衍生物都被合成出来以研究其与三链DNA的相互作用,其中具有代表性的是BgPI(benzo[g]pyridoindole),相对于BePI来说,BgPI是一个更具有直线构型的小分子,在它与三链DNA的作用机理中碱基堆积不是主要作用,侧链在沟间的静电相互作用才是主要的稳定作用[15,16,17]。 随后又发现了BQQ(benzo[f]quino[3,4-b]quinoxaline衍生物),BQQ是这一系列中对三链DNA稳定性最好的衍生物,最近又出现了BQQ与新霉素的加合物也对三链DNA具有很好的稳定作用[18,19,20]。 到目前为止,BePI及其衍生物是非常有效的三链DNA稳定剂并且也被研究和应用得最广泛。
双取代蒽醌类衍生物[21,22,23]是另外一类主要的三链DNA稳定剂,它与三链DNA的的作用机理是:母核通过插入模式与三链DNA的碱基三联体进行堆积,侧链位于沟间,起到额外的稳定作用。 萘基喹啉衍生物[24,25]也能通过插入作用模式选择性稳定三链DNA结构。 这类化合物的特点是大小适合的芳香族平面能够很好地与碱基三联体堆积,本身母核结构的柔度能更好地吻合碱基三联体,侧链能够提供额外的稳定作用。 另外还有一些稳定剂如甲氧檗因(coralyne)[26]等,经典的三链DNA稳定剂见图1。 由图1可见,三链DNA稳定剂具有如下结构特征:1)含有N;2)共轭结构。中草药是天然的组合化学库,蕴含着丰富的小分子,其中天然的生物碱——小檗碱的化学结构与甲氧檗因的化学结构很接近,并且也被证明能够稳定三链DNA[27]。 这就提示了中药复杂体系中存在能够与三链DNA较稳定结合的小分子配体,主要有生物碱类小分子和其它类的小分子如黄酮、木质素等。 如何将这些潜在的结合剂找出来无疑是一项艰巨的工作。 传统的中药化学研究方法是分离出纯物质进行活性评价,这种方法费时费力,因而建立合适的筛选方法将中草药中潜在的三链DNA结合剂筛选出来将是件很有意义的工作。
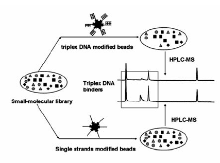
已报道的可用于三链DNA结合剂筛选的方法包括平衡透析法、纳米金比色法、多种核酸结构混合变温法以及电喷雾直接进样法等,下面对这些方法进行简要介绍。
平衡透析法是1999年Ren等[28]基于热力学的方法从Muller和Crothers的方法发展而来的。 该方法的实验设计如图2A所示,将等摩尔的各种结构的DNA如单链DNA、B型DNA、Z型DNA、三链DNA、四链DNA等加入到能截留这些大分子的透析管中,再将透析管放入装有小分子配体溶液的广口瓶中,小分子配体会通过透析管底部的透析膜与管中的DNA结合,待反应足够平衡之后(一般在大于24 h时),取出透析管对其中的小分子进行定量,则可确定该小分子配体对不同DNA结构的选择性。 该研究用平衡透析法评估15种不同配体对三链DNA的结构选择性,结果显示了这是对于结构选择性筛选的一种快速、有效且有利用价值的工具,更主要是通过利用该方法能够清楚的阐明小分子的种类对DNA结构的选择性。 这种方法的优点在于可以评价同一小分子对不同DNA结构的选择性,如图2B显示出溴化乙锭对单链DNA结合很弱,对双链DNA的结合较强。 这种方法的缺点在于费时(>24 h)费力,需要小分子配体的标准品,单次实验中只能测定一种小分子配体对不同结构DNA的选择性。
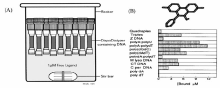 | 图2 平衡透析法的实验策略(A);溴化乙锭对不同DNA结构的选择性(B)[28]Fig.2 The experimental strategy of competition dialysis(A); The selectivity of ethidium bromide for different DNA structures(B)[28] |
2005年,Chaires[29,30]采用平衡透析法方便地分析了小分子配体与三链DNA结构选择性,并能够容易地获得结合常数。 2009年,Holt等[31]利用平衡透析法结合分子对接软件Surflex的新策略来鉴定选择性结合三链DNA(T·AT三联体)的小分子,筛选到了比萘喹啉MHQ-12(迄今为止具有最高选择性和亲和力的三链结合剂)具有更高选择性和亲和力的两个化合物,这种方法可用来鉴定与给定核酸序列具有较高亲和力和选择性结合的新类型小分子。
纳米金比色法是在1996年由Mirkin等[32]首次报道的。 由于纳米金制备简单、易于获得,且比色法的检测对仪器的要求很低,仅需要紫外光谱仪即可或者直接可以用肉眼检测,因而获得了广泛的应用,特别是在DNA各种高级结构的自组装和特定金属离子的检测等方面[33]。
2006年,Mirkin等[34]利用纳米金比色法成功地建立了三链DNA稳定剂的筛选方法,如图3(A)所示,他们的策略是将三链DNA的两条不配对单链DNA分别修饰在不同的纳米金表面,将中间的单链DNA游离在溶液中。 实验中选择的三链DNA在没有稳定剂存在的情况下不能稳定存在,因而纳米金由于修饰的单链DNA的不配对而处于游离状态;而当有稳定剂存在时该三链DNA能够稳定存在,从而导致纳米金从游离状态变成聚集状态,纳米金存在状态的改变导致了整个溶液颜色的改变,即由红色变为蓝色,利用这个简单的实验就可以直接用肉眼判断小分子配体能否稳定三链DNA,他们利用该方法成功地筛选出了两种已知的三链DNA稳定剂BePI和甲氧檗因(图3(B))。 该方法简单可行,但是这种方法也只是用于判定一种小分子配体对三链DNA的稳定作用[35,36,37]。
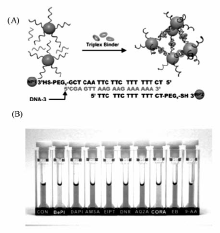 | 图3 纳米金比色法的实验策略(A);不同小分子配体对三链DNA的稳定性差异(B)[34]Fig.3 The experimental strategy of a gold nanoparticle based approach(A); The differences of stability of small molecule ligands on triplex DNA(B)[34] |
利用微阵列技术,Lytton-Jean等[38]建立了芯片结合DNA修饰的金纳米材料的方法来高通量的筛选三链和双链DNA结合剂,但未报道实际样品的结果。 由于金纳米材料为基础的方法简单实用,在诊断应用方面也引起了广泛的关注,已用于抗癌药物/DNA和蛋白质/DNA相互作用的研究[39,40]。
这种方法的操作很简单,即将少量的小分子配体与过量的不同DNA结构混合,直接使用变温紫外检测该小分子配体存在时对不同DNA结构热稳定性的影响。 如果小分子配体选择性地稳定三链DNA,则会观测到三链DNA热转变温度的升高,而双链DNA的热转变温度不变。 该方法需要保证DNA过量而小分子配体少量,这样才能看出小分子配体对DNA结构的选择性,另外各种DNA的热转变温度要有一定的差异才能在热变温曲线上被区分开。 同样地,这种方法只能用于评价一种小分子配体对三链DNA的稳定作用[41,42]。 2006年,Shi等[43]建立了多种DNA结构与小分子配体共紫外变温的方法,用多种结构混合变温法研究了配体与核酸的序列和结构的选择性,表明该方法具有简单、可操作性强、快速等优点。 2010年,Xue等[44]采用混合变温法研究了插入剂-新霉素与三链DNA的相互作用,结果显示,插入剂-新霉素与三链DNA中的poly(dA)3·2poly(dT)片段具有较强的亲和力。
离心超滤技术是一种与透析方法相近的方法,主要是利用亲合原理,将具有潜在活性的小分子化合物与受体混合,得到受体-配体复合物和未结合的小分子,通过超滤薄膜将未结合的小分子滤除后,复合物可以用有机溶剂处理,将小分子配体释放出来,从而实现活性化合物与非活性化合物的分离[45,46,47]。 超滤法结合高效液相-电喷雾质谱技术也被用于筛选三链和双链DNA结合剂[48,49,50]。 Su等[48]从黄连和掌叶大黄提取物中分别筛选到7个和11个DNA结合剂,评价了两个提取物中多种活性成分的DNA序列选择性;Zhou等[49]从金银花提取物中筛选到了结合于小牛胸腺脱氧核糖核酸的4个生物活性物质(芦丁、槲皮素-3- O-葡萄糖苷、木犀草素-3- O-葡萄糖苷和忍冬苷)。 马蕾等[50]采用离心超滤和液相色谱-质谱联用的方法,从红车轴草异黄酮提取物中筛选到10种与DNA具有不同的结合能力的异黄酮成分,为从中药提取物等复杂体系筛选并鉴定DNA结合剂建立了快速的超滤质谱平台。
在电喷雾电离过程中,DNA与小分子的非共价复合物不会受到影响,即不产生非特异的聚集也不会导致复合物的分解,从质谱上获得的结果能正确地反应液相中的状态[51,52]。 利用电喷雾质谱研究三链DNA与小分子复合物是基于双链DNA与小分子复合物的研究手段和策略展开的。 由于三链DNA一直都不是研究的热点,因而利用电喷雾质谱研究三链DNA与小分子非共价复合物的应用文献比较少。 直到2002年,Rosu等[53]才利用电喷雾质谱观测到了三链DNA。 随后,Guittat等[54]报道了白叶藤碱和新白叶藤碱与三链DNA的相互作用,应用电喷雾直接进样法检测了白叶藤碱和新白叶藤碱与双链DNA结构的亲和力,研究结果表明,白叶藤碱和新白叶藤碱更倾向于结合双链DNA中富含GC的序列,并且也能够用该方法识别三链和四链DNA。 我们课题组在这一方面也做了一些工作[55,56,57,58],采用电喷雾质谱法分析了黄酮类化合物与三链DNA的非共价结合的相互作用,结果显示苷元的羟化位置、糖类的位置和数量以及苷元骨架对黄酮类化合物与三链DNA结合的特性起着重要的作用[55];我们也曾利用电喷雾质谱法研究了二价金属离子对嘌呤型三链DNA的稳定性作用[56]以及米托蒽醌和三链DNA的相互作用[57],钴和镍离子有利于三链的形成,仅观察到了摩尔比为1:1三链DNA-米托蒽醌复合物; 利用负离子模式电喷雾串联质谱法对比了乌头碱和双链、三链和四链DNA的相互作用,相比较而言,乌头碱展示了较高的三链DNA结合力[58]。 电喷雾的电离过程非常温和,能将以非共价键形成的DNA与小分子复合物从溶液相中无损地转移到气相中并被质谱检测,真实地反映复合物在溶液中的状态。 除此之外,电喷雾具有节省样品、灵敏度高、快速等优点,在一级质谱中可以直接获得DNA和小分子的亲和力数据以及复合物的化学计量比,由串联质谱可以获得DNA与小分子的结合模式信息[59,60]。
我们课题组[61]采用了链霉亲和素修饰的琼脂糖珠-液质联用技术建立了复杂体系中筛选三链DNA结合剂的方法。 如图4所示,将三链DNA通过链霉亲和素与生物素的相互作用将生物素修饰了的三链DNA固定在琼脂糖珠上,再将修饰了三链DNA的琼脂糖珠与中药提取物孵育反应之后通过离心分离,获得中药提取物再用液质分析。 中草药提取物中与三链DNA相互作用的组分表现为色谱图上对应峰面积的下降,而那些与三链DNA没有相互作用的组分则表现为对应的峰面积不变,然后再通过液质对其中的结合剂进行结构鉴定。 通过两组色谱图的对照则可以判断中草药提取物中哪些组分是三链DNA的结合剂,哪些组分不是。 操作中使用了一种琼脂旋转纯化柱并在琼脂糖珠上有修饰的链霉亲和素。 链霉亲和素是一种相对分子质量为66000的蛋白质,是从链霉菌的细胞提取物中分离获得的,这种蛋白质与生物素的亲和作用很强( Ka=1015 L/mol)而且特异性很好[62]。 链酶亲和素-生物素相互作用是一种使用很广泛的体系,常规的做法是将链酶亲和素固定在固相载体如电极、玻璃、磁珠和琼脂糖珠上而不影响其对生物素的亲和能力,并用其来捕捉生物素化的蛋白、多肽或者单链DNA,借此实现检测或者生物大分子的固定,以方便进一步的实验操作[63,64,65]。 而琼脂旋转纯化柱是由两部分组成的,即一个离心管和一个收集管,在离心管的底部是一个孔径很大的膜,在离心力的作用下,溶液相可以通过膜被收集管所收集,而固体相如琼脂糖珠则没法通过膜,被保留在膜上,这样可以轻松地实现琼脂糖珠与溶液相的分离而不需要额外大量地使用移液器吸取液体,有助于减少实验操作中的系统误差。 建立了一种筛选三链DNA结合剂的简便、可靠方法。
为了获得小分子与DNA相互作用的信息,如是否能够结合、亲和力如何以及通过何种作用模式等,需要利用一系列研究手段对形成的复合物进行研究。 除了电喷雾质谱法外,常规的方法有光谱学方法(紫外分光光谱、荧光光谱、圆二色光谱)、核磁共振法、X衍射法、量热法(差示扫描量热法和等温滴定量热法)以及凝胶电泳法等,下面对这些方法进行简要介绍。
紫外分光光谱是研究小分子与DNA相互作用最简便的仪器,本身仪器便宜且获得的信息也是比较多的。 例如,可以确定小分子是否能够稳定特定结构的DNA,也能对推测小分子与DNA的结合模式提供参考信息[66,67]。
组成DNA的碱基均在260 nm附近有一强吸收峰,通常对于双链DNA、三链DNA和四链DNA,碱基都是配对并被磷酸骨架包裹在内部,所以260 nm处的吸收被抑制,当加热时,随着温度的升高,DNA链段运动剧烈,不断地解链成单链DNA,而单链DNA的碱基是游离的,在紫外光谱上表现为260 nm处的紫外吸收增强,在这里定义DNA链段解旋一半时的温度为热转变温度( Tm)。 以三链DNA为例,通过三链DNA在小分子存在与否时 Tm值变化,可判断该小分子是否对三链DNA具有稳定性,若能提高 Tm值即为三链DNA稳定剂,若降低了 Tm值即为三链DNA去稳定剂[68,69]。
当小分子与DNA相互作用时,也可以导致DNA紫外光谱的变化,或者小分子自身的紫外光谱发生变化,通过这些变化可以获得结合模式的信息。 以双链DNA为例子,若小分子与双链DNA通过插入作用结合,则会产生减色效应和红移现象[70]。
DNA的荧光较弱,直接利用荧光光谱研究小分子配体与DNA的相互作用有一定的限制,一般都是使用配体自身的荧光或者利用荧光探针试剂与DNA作用后产生的荧光进行研究[71,72]。 最近,Chen等[73]报道了吡啶衍生物(DMT)可以作为一种新的荧光试剂,专属灵敏地识别三链DNA,荧光强度可以增加9倍。 有些小分子如溴化乙锭与DNA结合后,会使原本荧光很弱的分子荧光强度增大很多。 有些小分子如阿霉素与DNA结合后,会发生荧光猝灭作用。 小分子与DNA作用后荧光偏振的变化情况是判断小分子是否与DNA发生嵌插作用的又一标准。 通常,当小分子插入到碱基对中时,其转动受阻,荧光偏振会随之变大,而非嵌插作用不会引起荧光偏振的增大[74]。
圆二色光谱(CD)是一种利用平面偏振光研究溶液中DNA的构象随环境条件(如温度、离子强度、pH值、小分子配体存在与否)的改变而变化的检测技术,可以快速且高灵敏地获得在小分子配体作用下的DNA构象变化[75,76,77] 。小分子配体与DNA作用之后,会使DNA的构象发生变化,或通过和DNA碱基的电子跃迁偶极矩间的偶合而产生信号,从而能被检测到,既诱导圆二色光谱(ICD)。 如果观测到ICD的吸收带,即说明小分子配体能与DNA相互作用。 一般来说,根据ICD的不同特征可以判断小分子配体与DNA的可能结合模式,如获得较强的ICD信号则提示为沟间模式,而很弱的信号暗示着插入模式[78,79,80]。
圆二色光谱在DNA领域得到了最为广泛的应用,主要研究了四链DNA在不同溶液条件下的不同构象[81],以及监控随着溶液条件变化的四链DNA构象变化。 也可研究小分子和三链DNA相互作用。Gondeau等[82]利用圆二色光谱研究了纺锤菌素对三链DNA稳定性的影响。 同反平行的三链DNA结构相比,纺锤菌素对平行的三链DNA结构的热稳定性没有明显的影响。
目前,大部分方法对于小分子配体与三链DNA的相互作用研究均有广泛应用,可应用于三链DNA结合剂的初步筛选,但除琼脂糖珠-液质联用技术外,其它几种方法只能用于评价一种小分子配体与三链DNA的相互作用。 如果将2.1节至2.5节的方法应用于中草药中三链DNA结合剂的筛选,就需要将中草药中的潜在活性成分逐个分离纯化,评价单一纯品与三链DNA的相互作用,不仅费时、费力、低效而且活性成分在纯化过程中可能会丢失,这将会遗漏信息。 琼脂糖珠-液质联用技术可以解决上述费时、费力、低效的问题。虽然琼脂糖珠-液质联用技术有自己独特的优势,但在实验中也不可避免地存在重复性较低等不足。 因而,建立并优化能够应用于像中草药粗提物这样混合体系中潜在三链DNA结合剂筛选的分析方法具有重要的应用意义。 随着分析技术的不断发展和进步,相信科研工作者在不久的将来,一定会建立更加有效的复杂体系中DNA结合剂的筛选的高通量的方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|