以肟酯和苄醇为反应物,三氟甲磺酸铜[Cu(OTf)2]为催化剂,通过“一锅法”反应合成三取代吡啶化合物。 分别考察了不同催化剂及其用量、原料配比、溶剂及温度对反应的影响,在最优条件下,反应的收率为85%,目标化合物经核磁共振氢谱、核磁共振碳谱以及质谱进行了结构表征。 该方法具有原料易得,操作简单,反应条件简单温和,产物收率高以及底物适用性好等优点。
Pyridine derivatives were synthesized in a one-pot reaction from oxime acetates and benzyl alcohols in the presence of copper(Ⅱ) trifluoromethanesulfonate [Cu(OTf)2] catalyst. The effect of catalysts and their dosage, raw material ratios, solvents, and temperatures on the yield were investigated. The target compound 2,4,6-trisubstituted pyridine was obtained in 88% yield under the optimum condition. The molecular structures of products were analyzed by mass spectrometry and nuclear magnetic resonance spectroscopy(1H NMR and13C NMR). The method has several advantages:commerically available materials, easy operation, mild reaction conditions, good yields and a wide range of functional group tolerance.
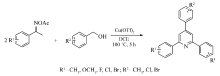
吡啶骨架是一种很重要的杂环结构,广泛存在于自然界的生物活性化合物中[1],并且可以应用于药物分子[2]、功能性配体、中间体及构建多取代结构分子[3]等方面。 例如,3-吡啶甲酰胺类衍生物在临床实践中可以治疗糙皮病和一些神经退化性疾病[4]。 因此,吡啶取代物的合成方法已经引起人们的广泛关注和积极研究[5]。 目前,已报道了多种构建吡啶取代物的方法[6],传统上,吡啶的合成主要由胺与羰基化合物缩合制备,包括1,5-二羰基与氨(NH3)的[5+1]缩合,Hantzsch吡啶的[2+2+1+1]的缩合,以及1,3-二羰基衍生物与插烯酰胺的[3+3]环化反应[7]。 近来,陆续报道了用过渡金属催化环化和交叉偶联的方法来构建官能团化的吡啶衍生物[8,9]。 尽管一些合成方法比较高效,但是由于前体不稳定,金属催化剂较昂贵,操作较繁琐,直接限制了其在构建一些实用但敏感的吡啶衍生物方面的应用。 因此,灵活、高效、具有良好官能团兼容性并且原料来源方便易得的合成方法依旧值得期望。 基于此,我们发展了一种以三氟甲磺酸铜为催化剂,以肟酯衍生物与苄醇为原料反应合成2,4,6-三取代吡啶及其衍生物的廉价、简单、高效的方法(Scheme 1)。
反应物肟酯1a按文献[10]方法合成。 三氟甲磺酸铜(≥98%,上海柏卡化学技术有限公司)、苄醇(≥99%,成都市科龙化工试剂厂)、1,2-二氯乙烷(DCE)(≥99%,天津市光复科技发展有限公司)。
TRACE DSQ型气质联用仪(美国Thermo Electron公司);QZAB-HS型色-质谱联用仪(英国VG公司);Mercury plus 300 BB型液体核磁共振波谱仪(美国Agilent公司);RE-5299型旋转蒸发仪(巩义市予华仪器公司)。
向密封管(38 mL)中加入肟酯35.4 mg(0.2 mmol)、三氟甲磺酸铜3.8 mg(10%(摩尔分数)),再依次加入苄醇52 μL(1.0 mmol)、1,2-二氯乙烷(2.0 mL),100 ℃,反应5 h,结束反应并冷却至室温。 用乙酸乙酯溶解并过滤,用旋转蒸发仪浓缩有机相。 使用 V(石油醚): V(乙酸乙酯)=30:1~10:1的混合液对产物进行柱层析分离提纯,最终得到26.1 mg白色固体产物,熔点102~104 ℃,产率85%,产物2,4,6-三苯基吡啶(3a)的核磁共振表征数据为:1H NMR(300 MHz,CDCl3), δ:8.20(d, J=7.3 Hz,4H),7.89(s,2H),7.74(d, J=7.3 Hz,2H),7.56~7.48(m,6H),7.48~7.41(m,3H);13C NMR(75 MHz,CDCl3), δ:157.44,150.14,139.51,138.99,129.08,129.02,128.95,128.68,127.15,127.09,117.10;HRMS m/z计算值C23H18N(M+H)+308.1434,实测值308.1438。
2,6-二(2-甲基苯基)-4-苯基吡啶(3b):棕色油状物,28.8 mg,产率86%;1H NMR(300 MHz,CDCl3), δ:7.72(dd, J=8.1,1.5 Hz,2H),7.59(s,2H),7.50(td, J=6.2,3.1 Hz,4H),7.33~7.26(m,7H),2.48(s,6H);13C NMR(75 MHz,CDCl3), δ:160.05,148.75,140.67,135.88,130.67,129.82,129.11,129.01,128.50,128.23,127.10,125.83,120.10,20.64;HRMS m/z计算值C25H22N(M+H)+336.1747,实测值336.1752。
2,2-二(3-甲基苯基)-4-苯基吡啶(3c):白色固体,mp 127~129 ℃,28.4 mg,产率85%;1H NMR(300 MHz,CDCl3), δ:8.03~7.93(m,4H),7.87~7.82(m,2H),7.74(d, J=7.8 Hz,2H),7.55~7.25(m,7H), 2.47(s,6H);13C NMR(75 MHz,CDCl3), δ:157.69,150.00,139.61,139.08,138.28,129.75,129.06,128.89,128.58,127.82,127.16,124.29,117.16,21.62;HRMS m/z计算值C25H22N(M+H)+336.1747,实测值336.1750。
2,6-二(4-甲基苯基)-4-苯基吡啶(3d):白色固体,mp 126~128 ℃,27.8 mg,产率83%;1H NMR(300 MHz,CDCl3), δ:8.10(d, J=8.2 Hz,4H),7.83(s,2H),7.73(d, J=6.8 Hz,2H),7.51(d, J=7.4 Hz,3H),7.31(d, J=8.1 Hz,4H),2.43(s,6H);13C NMR(75 MHz,CDCl3), δ:157.35,149.97,139.23,138.93,136.85,129.38,129.04,128.83,127.15,126.96,116.49,21.32;HRMS m/z计算值C25H22N(M+H)+336.1747,实测值336.1751。
2,6-二(4-甲氧基苯基)-4-苯基吡啶(3e):白色固体,mp 94~96 ℃,29.1 mg,产率79%;1H NMR(300 MHz,CDCl3), δ:8.16(d, J=8.9 Hz,4H),7.76(s,2H),7.75~7.71(m,2H),7.49(ddd, J=7.3,6.3,1.7 Hz,3H),7.03(d, J=8.9 Hz,4H),3.87(s,6H);13C NMR(75 MHz,CDCl3), δ:160.43,156.90,149.94,139.30,132.29,129.01,128.79,128.33,127.12,115.66,113.99,55.35;HRMS m/z计算值C25H22NO2(M+H)+368.1645,实测值368.1649。
2,6-二(4-氟苯基)-4-苯基吡啶(3f):白色固体,mp 150~152 ℃,25.0 mg,产率73%;1H NMR(300 MHz,CDCl3), δ:8.19~8.13(m,4H),7.81(s,2H),7.72(dd, J=8.0,1.5 Hz,2H),7.54~7.49(m,3H),7.19(t, J=8.7 Hz,4H);13C NMR(75 MHz,CDCl3), δ:165.22,161.93,156.41,150.39,138.76,135.48,129.12,128.90,128.79,128.40,127.11,116.66,115.74,115.46;HRMS m/z计算值C25H16F2N(M+H)+344.1246,实测值344.1250。
2,6-二(4-氯苯基)-4-苯基吡啶(3g):白色固体,mp 162~164 ℃,28.5 mg,产率76%;1H NMR(300 MHz,CDCl3), δ:8.11(d, J=8.5 Hz,4H),7.83(s,2H),7.71(dd, J=7.7,1.5 Hz,2H),7.52(d, J=7.7 Hz,3H),7.49~7.44(m,4H);13C NMR(75 MHz,CDCl3), δ:156.28,150.51,138.63,137.71,135.25,129.16,128.88,128.31,127.12,117.05;HRMS m/z计算值C25H16Cl2N(M+H)+376.0655,实测值376.0658。
2,6-二(4-溴苯基)-4-苯基吡啶(3h):白色固体,mp 164~166 ℃,35.6 mg,产率77%;1H NMR(300 MHz,CDCl3), δ:8.09~7.98(m,4H),7.86~7.80(m,2H),7.70(dd, J=8.5,7.4 Hz,2H),7.62(dd, J=8.6,2.1 Hz,3H),7.55~7.44(m,4H);13C NMR(75 MHz,CDCl3), δ:156.35,150.55,138.59,138.15,131.84,129.16,128.61,127.13,123.62,117.09;HRMS m/z计算值C23H16Br2N(M+H)+463.9644,实测值463.9648。
2-甲基苯基-2,6-二苯基吡啶(3i):棕色油状物,28.2 mg,产率88%;1H NMR(300 MHz,CDCl3), δ:8.20~8.14(m,4H),7.64(s,2H),7.48(t, J=7.3 Hz,4H),7.40(t, J=7.2 Hz,2H),7.30(d, J=3.1 Hz,4H),2.33(s,3H);13C NMR(75 MHz,CDCl3), δ:156.67,151.22,139.66,139.35,135.05,130.59,129.16,128.97,128.63,128.29,126.99,126.05,119.28,20.35;HRMS m/z计算值C24H20N(M+H)+322.1590,实测值322.1593。
3-甲基苯基-2,6-二苯基吡啶(3j):黄色油状物,27.3 mg,产率85%;1H NMR(300 MHz,CDCl3), δ:8.23~8.18(m,4H),7.88(d, J=0.9 Hz,2H),7.52(dd, J=12.8,6.5 Hz,6H),7.44(dd, J=10.9,4.2 Hz,3H),7.28(d, J=7.4 Hz,1H),2.47(s,3H);13C NMR(75 MHz,CDCl3), δ:157.42,150.31,139.61,139.03,138.80,129.70,128.99,128.67,127.86,127.11,124.27,117.12,21.54;HRMS m/z计算值C24H20N(M+H)+322.1590,实测值322.1592。
4-甲基苯基-2,6-二苯基吡啶(3k):黄色固体,mp 95~97℃,27.6 mg,产率86%;1H NMR(300 MHz,CDCl3), δ:8.22~8.14(m,4H),7.83(s,2H),7.60(d, J=8.1 Hz,2H),7.52~7.45(m,4H),7.42(dt, J=9.6,4.2 Hz,2H),7.28(d, J=7.8 Hz,2H),2.39(s,3H);13C NMR(75 MHz,CDCl3), δ:157.30,149.88,139.53,138.97,135.88,129.73,128.91,128.61,127.04,126.88,116.78,21.20;HRMS m/z计算值C24H20N(M+H)+322.1590,实测值322.1594。
2-氯苯基-2,6-二苯基吡啶(3l):白色油状物,26.6 mg,产率78%;1H NMR(300 MHz,CDCl3), δ:8.21~8.17(m,4H),7.78(s,2H),7.56~7.50(m,4H),7.49~7.43(m,4H),7.41~7.37(m,2H);13C NMR(75 MHz,CDCl3), δ:156.88,148.57,139.38,138.51,132.30,130.89,130.28,129.67,129.06,128.69,127.11,119.44;HRMS m/z计算值C23H17ClN(M+H)+342.1044,实测值342.1049。
4-氯苯基-2,6-二苯基吡啶(3m):白色固体,mp 91~93 ℃,27.3 mg,产率80%;1H NMR(300 MHz,CDCl3), δ:8.22~8.17(m,4H),7.84(s,2H),7.68(d, J=8.6 Hz,2H),7.55~7.44(m,8H);13C NMR(75 MHz,CDCl3), δ:157.67,148.95,139.37,137.48,135.19,129.32,129.16,128.72,128.44,127.11,116.80;HRMS m/z计算值C23H17ClN(M+H)+342.1044,实测值342.1047。
4-溴苯基-2,6-二苯基吡啶(3n):白色固体,mp 98~100 ℃,31.2 mg,产率81%;1H NMR(300 MHz,CDCl3), δ:8.15(d, J=7.2 Hz,4H),7.75(s,2H),7.59(d, J=8.4 Hz,2H),7.47(ddd, J=20.3,11.3,7.0 Hz,8H);13C NMR(75 MHz,CDCl3), δ:157.46,148.73,139.19,137.70,132.13,129.09,128.64,128.61,127.01,123.28,116.57;HRMS m/z计算值C23H17BrN(M+H)+386.0539,实测值386.0543。
以肟酯1a与苄醇2a为模板底物,对反应条件进行了筛选,分别考察了催化剂及其用量、原料比例、溶剂、温度等因素对反应产率的影响,结果列于表1。 从表1中可以看出,当对不同催化剂CuBr2、Cu(OTf)2和CuCl进行筛选时,发现三氟甲磺酸铜[Cu(OTf)2]作为催化剂,收率达到85%,效果最好(Entries 1~3)。 对催化剂的用量进行了筛选,发现加入10%(摩尔分数)(3.8 mg)的Cu(OTf)2时,反应收率达85%(Entries 2,4~5),效果最好。 其次,考察了反应物1a与2a的摩尔比对反应的影响,得出在反应物 n(1a): n(2a)=2:5时,收率达85%,反应效果最好(Entries 2,6~7)。 在上述最优条件下,分别考察了溶剂、温度和时间对反应的影响。 当采用DCE(1,2-二氯乙烷)、DMSO(二甲基亚砜)、DMF( N, N-二甲基甲酰胺)和甲苯作为溶剂时,DCE效果最好,收率达到85%(Entries 2,8~10)。 在不同温度下反应相同时间,发现温度为100 ℃时,效果最好(Entries 2,11~12)。 综上所述,反应合成2,4,6-三苯基吡啶的最优条件为:1a(0.2 mmol),2a(1.0 mmol),Cu(OTf)2(3.8 mg,10%(摩尔分数)),DCE(2.0 mL),反应温度100 ℃,反应时间5 h。
表1 反应条件的优化 Table 1 Optimization of the reaction conditions a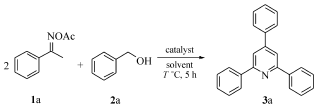 |
在上述最优条件下,对反应底物进行了拓展。通过采用不同官能团取代的肟酯衍生物和苄醇进行反应,合成了14种2,4,6-三取代吡啶化合物如表2所示(3a~3n)。 从表2中的数据可以看出,在三氟甲磺酸铜的催化作用下,不同官能团取代的肟酯衍生物和苄醇均可以顺利进行反应,并得到中等至较好产率的2,4,6-三取代吡啶化合物。 从所得反应结果来看,无论是供电子基团取代底物还是吸电子基团取代底物,反应的产率均较好。 首先,对肟酯进行了底物拓展。当肟酯的苯环上的取代基团为2-CH3、3-CH3、4-CH3以及4-OCH3时,反应产率分别为86%、85%、83%及79%(表2,entries 2~5);当肟酯的苯环上的取代基团为4-F、4-Cl、4-Br时,反应产率稍有降低,分别为73%、76%、77%(表2,entries 6~8)。 接着,又对苄醇进行了底物拓展。 当采用2-CH3、3-CH3、4-CH3取代的苄醇进行反应时,得到了产率为85%~88%的相应目标产物(表2,entries 9~11),而采用4-Cl、4-Br取代的苄醇进行反应时,得到的产物产率分别为80%和81%(表2,entries 12~13)。 由此可见,该反应对不同官能团取代的底物适用性均较好。
表2 反应底物的拓展 Table 2 Scope of the reaction substrates a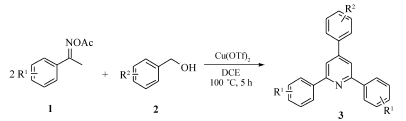 |
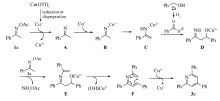
根据实验结果,并结合相关文献的报道[10],提出了可能的反应机理(Scheme 2)。 首先,三氟甲磺酸铜被还原或者经过去质子化过程转化为Cu+[11],在Cu+的作用下化合物1a的N—O键断裂得到亚胺自由基A,接着A与另一分子的Cu+结合生成了N—Cu2+复合物B[12,13];B经过互变异构得到的中间体C与由化合物2a经氧化产生的化合物d进行了亲电加成反应生成亚胺中间体D[13];然后,亚胺中间体D与另一分子的化合物1a缩合生成中间体E,中间体E经过消除反应产生一种含氮原子的1,3,5-三烯中间体F;最后,中间体F发生热电环化后,紧接着快速被Cu2+氧化生成三取代吡啶3a,同时生成Cu+,反应的催化循环通过空气中的氧气将Cu+氧化为Cu2+来完成。
本文发展了一种简便高效合成一系列2,4,6-三苯基吡啶及其衍生物的方法。 该方法采用肟酯和苄醇为原料,三氟甲磺酸铜[Cu(OTf)2]为催化剂,1,2-二氯乙烷(DCE)为溶剂,在温度为100 ℃的条件下反应5 h,产物收率高达88%。 该合成方法原料易得,操作简单,条件简单温和,无需添加酸碱以及其它氧化剂,在空气下即可进行,所得目标产物产率高且对不同官能团取代的底物均有较好的适用性,具有潜在的应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|