蛋白质微阵列芯片能够高通量监测生物毒素、分析宿主-微生物相互作用和抗原-抗体相互作用、筛选疾病生物标志物,因此有望成为体外诊断的主要技术之一并在病原体感染、自身免疫性疾病、神经退行性疾病和癌症等疾病的精准医疗中发挥重要作用。 本文通过对最近发表的相关研究成果分析,总结了蛋白质微阵列芯片在临床分析中新进展,分析了其在实际应用中所面临的技术挑战并探讨了相应的解决方案。
Protein microarray is capable of high-throughput monitoring biological toxins, analyzing the host-microbe interactions and the antigen-antibody interaction, and screening biomarkers of diseases. Therefore, protein microarray is expected to become one of the main technology of in vitro diagnostic and plays an important role in precision medicine of many diseases, such as pathogen infection, autoimmune diseases, neurodegenerative diseases, cancer and so on. Through analyzing the recently published research results, this review summarizes recent progress of protein microarray in the clinical analysis, analyzes the technical challenges in practical application, and discusses corresponding solutions.
由于微阵列芯片技术(microarray或biochip)能够同时检测一个样品中的不同目标物并具有样品消耗量少的特点,因此在过去的20年中这一技术得到了迅速的发展并成为分子生物学基础研究(基因组学、蛋白质组学、信号传导等)和生物医学(疾病标志物筛选、药物研发等)的重要工具[1,2,3,4,5,6,7,8,9,10,11,12]。 微阵列生物芯片通常根据所固定的生物分子探针来分类,如基因微阵列芯片、多肽微阵列芯片、蛋白质微阵列芯片等。 1989年,Ekins在免疫组化分析(immunoassays)实验中发现降低样品的反应量有助于提高检测的灵敏度,从而提出蛋白质微阵列芯片(protein microarray或protein biochip,简称蛋白质芯片)的概念[13]。 21世纪初,MacBeath和Schreiber成功地构建了蛋白质芯片并实现了微量样品中飞摩尔量级蛋白质相互作用及激酶功能的平行分析[14]。
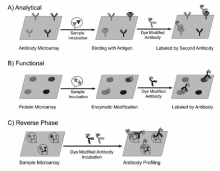
在预设模式下使用微阵列芯片点样仪(microarray printer),采用接触法(contact printing)或非接触法(non-contact printing)将含有蛋白质探针的微小液滴分配(printing/spotting)到固体基底表面(醛基或环氧基修饰的载玻片、尼龙膜等),通过物理吸附(静电作用等)或化学反应(蛋白质的氨基残基与基底上的醛基或环氧基的共价反应等)形成蛋白质探针阵列,是制备蛋白质芯片的主要方法(如图1A所示)[15]。 接触法能够制作较高密度(2500点/cm2)的蛋白质芯片,但定量准确性及重复性不佳;非接触法具有较好定量准确性,能够实现在同一位置重复点样,但喷印的斑点较大,所制作的蛋白质芯片点阵密度较低(≤400点/cm2)。 根据其性能,蛋白质芯片通常可分为分析(analytical)芯片、功能(functional)芯片和反相(reverse phase)芯片3大类 (如图2所示)[16,17,18,19,20,21,22,23]。 分析芯片能够利用所固定的亲和试剂(抗原、抗体等蛋白质探针等)与一个复杂生物样品溶液中待测物间的特异性识别平行定性/定量不同种类的目标物。 功能芯片主要应用于蛋白质分子间相互作用、蛋白质修饰以及酶功能的研究。 反相芯片是指将不同的生物样品(组织/细胞裂解液、血清等)固定于基底表面,应用溶液相的探针分子识别样品中特定蛋白质组分。 通常使用荧光化合物标记上述检测结果/反应过程,并用双激光共聚焦扫描仪采集荧光信号,获得芯片扫描图(如图1B所示)。 与酶联免疫吸附分析法(enzyme-linked immunosorbent assay,ELISA)相比,蛋白质芯片具有较高的检测灵敏度、极少的试剂消耗量。 例如,在相同的反应条件下,抗原芯片对血清中抗体的识别敏感度远高于ELISA,相应的检测灵敏度通常能提高1~2数量级。 另外,蛋白质芯片的检测通量要远高于ELISA,有助于获得临床表现形式和病理亚型相关的所有生物标志物集合,从而能够进一步提高诊断及治疗的准确性。 本文通过分析最近发表的一系列有关蛋白质芯片在临床检测中的研究结果,探讨了其在体外诊断( in vitro diagnostics,IVD)中的应用前景与技术局限性。
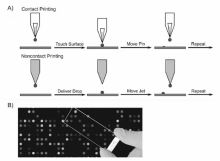 | 图1 接触法或非接触法制备蛋白质芯片示意图(A);蛋白质芯片实物图及相应的双荧光扫描图(B)[15]Fig.1 Illustration of contact printing and noncontact printing modes of protein microarray fabrication(A); photograph and corresponding dual wavelength fluorescence scanning image of protein microarray(B)[15] |
蛋白质芯片已成为蛋白质表达谱、生物标志物筛选、蛋白质翻译后修饰、蛋白质与其它生物分子相互作用等研究的重要工具。 蛋白质芯片在生物分析/生物医学的研究流程如图3A所示。 首先,基于一个典型的生物问题设计蛋白质芯片。 然后,应用所制备的蛋白质芯片对相关的生物样品进行全面的蛋白质组学分析;进一步使用生物信息学工具分析所获得的蛋白质组学数据并归纳科学规律。 最后,通过设计相应体外和体内正交实验验证所获得的新规律。 蛋白质芯片在生物医学分析中的应用如图3B所示,针对不同的生物医学现象构建特定的蛋白质芯片应用于相应的临床样品分析,通过所获得的检测结果(如抗原、抗体或生物标志物等定量与定性分析)对相关疾病进行诊断与治疗。 在临床分析中,蛋白质芯片被广泛应用于:血清学评价过敏和感染性疾病诊断中的抗体应答及抗原筛选、抗体(自身免疫性疾病诊断)或病原体(感染性疾病)的检测、重大疾病(脓毒症、癌症、神经退行性疾病等)生物标志物筛选。
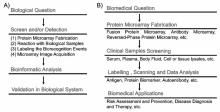 | 图3 蛋白质芯片在生物分析(A)和临床分析(B)的应用示意图Fig.3 Work flow of protein microarray applications for answering biological questions(A) and clinical questions(B) |
将不同的抗原有序地固定于合适的固体介质上,构建抗原芯片并发展相应的竞争免疫分析方法,能够通过抗原-抗体的特异性反应来高灵敏、高选择性、快速地同时检测样品中不同种类的生物毒素[24,25,26,27,28,29,30,31,32,33,34,35,36,37]。 Wang等[25]发展了一种基于商品琼脂糖基质抗原芯片,应用于同时检测6种霉菌毒素(aflatoxin B1,aflatoxin M1,deoxynivalenol,ochratoxin A,T-2 toxin,and zearalenone)。 这一方法的检出限达到10 pg/mL并具有较快的检测速度(即能在4 h完成检测),能够满足对少量实际样品中不同生物毒素高通量检测的需求。 基底对探针分子负载的高能力和对非特异性蛋白质的高抗污能力,抗原点阵单元的一致性好,单克隆抗体对生物毒素的高亲和力和特异性,有助于提高基于抗原芯片的竞争免疫分析方法对生物毒素的检测能力。 Li等[27,28,32]在刷状聚合物(poly[(ethylene glycol) methacrylate- co-glycidyl methacrylate], (POEGMA- co-GMA))修饰的基底上构建抗原芯片,应用于aflatoxin B1(AFB1)、ochratoxin A(OTA)和zearalenone(ZEN)等3种真菌毒素的同时分析(如图4所示)。 由于POEGMA- co-GMA具有蛋白质固定量高、抗污能力强等特点,因此这种基于刷状聚合物抗原芯片的竞争免疫分析具有检测灵敏度高(检出限达到3 pg/mL)、检测浓度范围宽(3个数量级)、选择性好、检测时间短(2 h)的特点。
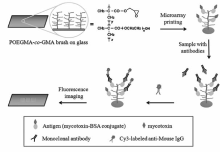 | 图4 基于POEGMA- co-GMA高分子刷修饰基底的抗原芯片非直接竞争免疫分析示意图[27]Fig.4 Schematic illustration of indirect competitive immunoassay on the POEGMA- co-GMA brush modified slide[27] |
相对基于抗原芯片的竞争免疫分析,使用单克隆抗体芯片分析样品中的目标生物毒素,具有检测时间更短、分析结果更可靠的优点[33,34,35,36,37]。 Stieber 等[33]使用含有不同固定量的10种单克隆抗体芯片对110种实验室培养的或临床样本中分离的金黄色葡萄球菌( Staphylococcus aureus, S.aureus)所分泌的生物毒素进行了分析,在2 h内成功的获得了耐药性金黄色葡萄球菌(methicillin resistant S. aureus,MRSA)的生物毒素生物标记物。
蛋白质芯片不仅能高灵敏、高通量检测复杂样品中不同类型的病原体(细菌、病毒真菌等),而且能够应用于病原体的抗体筛选以及系统分析机体对病原体的免疫应答[38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63]。 2006年,Zhu等[49]首次将蛋白质芯片应用于血清学研究,用于确定中国和加拿大的“非典”患者。 随后,科研工作者们制作了大量的新型病原蛋白/抗原芯片应用于包括疟疾(疟原虫)、HIV-1、流感、疱疹病毒、结核病毒等病原体的检测。 Coelho等[51]使用酵母蛋白(yeast protein)芯片在蛋白质组学的水平上分析了CD-1 小鼠被白色念珠菌等3种人类病真菌感染后的免疫应答。 他们发现,有16种免疫活性蛋白能够同时响应不同真菌感染,为新型真菌疫苗的研制提供了基础(如图5所示)。
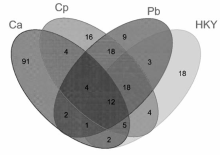 | 图5 使用蛋白芯片检测到的白色念珠菌(Ca)、球孢子posadasii(Cp)、芽生菌(Pb),或免疫热杀死酵母(HKY)感染的小鼠血清中的不同蛋白质及其相互作用。每一个数字代表了小鼠血清中特异蛋白质的数量[51]Fig.5 Interactions detected on the protein microarray after probing with sera from mice infected with Candida albicans(Ca), Coccidioides posadasii(Cp), Paracoccidioides brasiliensis(Pb), or immunized with heat-killed yeast(HKY). Each number represents the number of unique proteins that were visualized by the serum from the mice[51] |
使用纳米标记物、提高芯片对病原体的捕获能力并结合新型检测手段和培养技术有助于进一步提高蛋白质芯片的检测灵敏度。 Bouguelia等[52]结合表面等离子体共振分析技术和抗体芯片及在线培养实现了对食品中沙门氏菌、肺炎链球菌和大肠杆菌O157:H7等3种细菌的同时检测,其检出限能够达到(2.8±19.6) cfu/mL。 Liu等[61]利用刷状聚合物(poly(methyl methacrylate)-poly(glycidyl methacrylate),PGMA-PMMA)增加芯片表面抗体的固定量来提高芯片对病毒的捕获量,成功实现了对低至10 pg/mL乙肝病毒抗原的检测。 Liu等[62,63]制备了一种凝集素水凝胶芯片,具有三维结构的水凝胶基底能够改善细菌表面的糖基化合物与凝集素的特异性相互作用,从而获得用于细菌种类鉴别的指纹图谱,并以此为基础发展了一种夹心法应用于抗菌药筛选及在线药效检测。
使用含有已知过敏原的蛋白质芯片筛选血清样品中对特定过敏原具有特异性的免疫球蛋白E(IgE),能够确定过敏病人特定的敏感原,从而获得特异性免疫治疗的靶分子[64,65,66,67,68,69,70]。 这一方法能够同时检测多种敏感原,因此相对于其他的免疫分析方法具有很强的优势:1)多个过敏原同时检测有助于降低检测成本和检测样品的体积(这对婴儿/儿童病人非常重要);2)结合不同荧光标记的特异抗体可以测量多个分析参数(例如,同时检测过敏原特异性的IgG抗体和IgE抗体)为过敏诊断提供详细的信息;3)能够监测过敏性疾病的发展过程和对特定过敏原的治疗效果。 早在2002年过敏原芯片就被用于同时检测微量血清样品中的对IgE具有反应活性的过敏分子[71]。 随后欧盟过敏发展机制研究项目(Mechanisms for the development of allergies,MeDALL)资助开发的过敏发展机制研究芯片(MeDALL-allergen-chip))被用于监测多达170种过敏原所引起的欧洲儿童过敏性疾病以及过敏性疾病与年龄的关系(如图6所示)[67]。 由于IgE在血清中为低丰度蛋白,因此要求基于过敏原芯片的免疫分析方法必须具有较高的灵敏度 (检出限必须达到ng/mL以下)。通过提高过敏原的固定量、改善过敏原与IgE的反应环境、采用有效的信号放大方法和检测方法等能够有效的提高该方法的灵敏度。 研制高灵敏性、高容量的过敏原芯片有助于在生命早期建立能够与IgE发生反应的过敏分子谱系,从而对过敏性疾病进行有效预防和早期干预。
 | 图6 MeDALL allergen-chip应用于与过敏原反应的IgE和IgG检测。对过敏病人血清中IgE(A)和IgG(B)的检测;对同一过敏病人在10岁(C)与16岁(D)时血清中IgE的检测[67]Fig.6 Detection of allergen-specific IgE and IgG by the MeDALL allergen-chip. A serum sample from an allergic individual was tested for the presence of allergen-specific IgE(A) and IgG(B) using the MeDALL allergen-chip. Serum samples from a study participant of the Norwegian birth cohort ECA, obtained at 10 years(C) and 16 years(D), were analyzed for IgE-reactivities using the MeDALL allergen-chip[67] |
近十几年来,蛋白质芯片在疾病标志物检测中的应用得到了迅速的发展,在神经退行性疾病、肿瘤等重大疾病诊疗中发挥了重要作用[72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97]。 基于蛋白质芯片的高通量免疫分析方法能够对海量临床样品中的生物标志物进行筛选,从而提供病人在生理和病理情况下的组织及血清中与疾病相关蛋白质的种类和含量等详细信息。 另外,使用复杂的生物信息学工具对蛋白质芯片所获得的数据进行进一步分析则可以显著提高诊断的准确度。 例如,反相蛋白质芯片被应用于确定肿瘤生物标志物浓度与疾病进程关系;基于抗体芯片的三明治免疫分析能够同时准确定量不同的疾病标志物。 因此,利用蛋白质芯片筛选/分析疾病生物标志物不仅将有助于实现个体医疗的要求,而且也将有助于最大限度地减少用药不当(药物选择错误或用药过量)造成的不良反应风险。
1.4.1 免疫系统疾病检测 Yoo等[72]使用大肠杆菌Ro蛋白芯片筛选不同动物血清中抗Ro蛋白抗体,从而获得能够与Ro蛋白阳/阴性(Ro protein (+/-))的大肠杆菌( E.Coli)进行特异性反应的抗体。 随后,以所获得的抗体成功地实现了对人类系统红斑狼疮(systemic lupus erythematosus,SLE)的高灵敏性、高特异性检测。
1.4.2 重要器官的病变体外检测 早在2006年,Horn等[73]使用含有37200种重组人蛋白的体芯片,对体液免疫的扩张型心肌病(the humoral autoimmune repertoire of dilated cardiomyopathy(DCM))患者的血清样本中的全部免疫球蛋白和IgG3亚类抗体进行了分析。 研究结果表明,有26种免疫球蛋白和6种IgG3亚型蛋白与DCM相关。 D'Angelo等[74]用蛋白芯片从腹腔疾病(celiac disease(CD))病人血清中筛选出与腹腔疾病相关的13种特异性抗原,并进一步用酶联免疫反应证实其中6种抗原为腹腔疾病的特异性抗原。 最近,Chruscinski等[75]使用抗原芯片对心脏病人及心脏移植后病人血清样本中的64个抗原与IgM和IgG的免疫反应进行了同时分析。 研究发现,8种抗原与细胞介导的排异有关,7种与 IgM有关的抗原与抗体介导的排异有关。 这一研究为器官移植的预后(prognosis:疾病发生后对将来发展为不同后果的预测或估计)提供了一种新的诊断方法。
1.4.3 神经退行性疾病检测 筛选神经退行性病变(neurodegenerative disorders)的生物标志物、探索其发病机制对该类疾病的早期发现、分类及治疗具有重要意义[76,77]。 Ray等[76]使用抗体芯片分析了不同病人血浆中的120种细胞因子的水平,发现18种细胞因子可以用于区分阿茲海默症(Alzheimer's disease,AD)和非AD。 随后,以这18种细胞因子作为标志物对轻度认知障碍病人在2~6年后发展为AD的检测正确率达到90%。 Dunning等[77]使用人类蛋白质芯片(Human protein microarrays,Protoarray v5.0,Life Technologies)分析了AD生物标志物A β1-42多肽及其寡聚体与蛋白质之间的相互作用,发现A β1-42多肽及其寡聚体与人糖原合成激酶(glycogen synthase kinase 3 α,GSK3 α)存在较强的亲和作用并且能够刺激GSK3 α对Tou蛋白的过度磷酸化(如图7所示)。 这一发现为揭示A β1-42多肽及其寡聚体的生物毒性和AD的发病机制之间的关系提供了新证据。
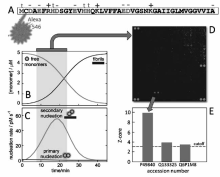 | 图7 使用蛋白质芯片筛选信号通路中与A β1-42寡聚物的相互作用的生物分子[77]。A β1-42的N端修饰绿色荧光染料alexa546(A),在pH值8.0的生理盐水中A β1-42纤维化(B)及成核速率(C)与时间的关系,A β1-42寡聚物与特定蛋白质相互的芯片图像(D)和相应的数据分析(E)Fig.7 Principles of protein array screening to find interaction partners of on-pathway A β42 oligomers. (A)Amino acid sequence of A β(MC1-42) with the Alexa546 chromophore attached to the cysteine residue added at the N-terminus. (B)Fibril formation as a function of time starting from 5 μmol/L monomeric A β42 in physiological salt buffer at pH 8.0. (C)Nucleation rates during the same aggregation reaction, calculated from concentrations and rate constants determined in physiological salt. (D)Example of a subarray with guiding spots in red, and the spots of a putative interaction in green. ( E) Z-scores of three duplicate spots that were found above the cutoff when the array was probed with on-pathway A β42 assemblies[77] |
1.4.4 肿瘤检测 由于肿瘤的异质性,相同类型的肿瘤可能会产生不同的生物标志物,因此,多个肿瘤生物标志物的同时检测对提高肿瘤诊断的准确性和降低治疗成本具有重要意义[78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97]。 另外,直接在护理点(point of care)对多种肿瘤相关抗原(TAA)的高灵敏度、快速检测将有助于早期发现和识别多种形式的癌症。 Wingren等[78]使用含有121人重组单链重组抗体芯片,对148例胰腺癌、慢性胰腺炎、自身免疫性胰腺炎(AIP)和健康对照组的血清中肿瘤抗原进行检测,以确定与胰腺癌相关的生物标志物。 研究发现,其中25个生物标志物可以用于区分胰腺癌与健康人、慢性胰腺炎和AIP。 Luna-Coronell等[80]使用含有5449个独特的人类蛋白的抗体芯片对健康者和病人的血浆进行了分析。 在早期的50例前列腺癌与49例良性前列腺增生症(良性前列腺增生症)的血浆中发现471种(其中21种与高反应性的前列腺癌有关)差异活性抗原。 Rho等[81]发展了一种基于抗糖蛋白的抗体芯片,应用于筛选血清样本中与癌症相关的糖蛋白的糖基化水平(如图8所示)。 他们通过比较30例III、IV期的结直肠癌血清和60例正常人血清中相关糖蛋白的糖基化差异,发现带有唾液酸(sialyl Lewis A or Lewis X)的糖蛋白能够作为结直肠癌的新型生物标志物。Ewaisha等[82]将代表低风险的两种人乳头瘤病毒(the human papillomavirus,HPV)(HPV6和11)和10种高致癌风险的HPV(HPV16、18、31、33、35、39、45、51、52和58)的98种蛋白质进行C-端GST蛋白质融合并构建蛋白质芯片。 与不同种类癌症病人血清及健康人血清相互作用表明,GST蛋白融合HPV蛋白质芯片能够快速鉴定血清中的12种HPV,其中HPV16E1、E2和E7与口咽癌(oropharyngeal cancers,OPC)有关,HPV52 E7与宫颈癌(cervical cancer)有关。 将新的物理方法/检测技术应用于生物芯片有助于进一步提高方法的灵敏度。 最近,Huang等[79]构建了一种基于光子晶体基底的抗体芯片的三文治免疫分析法用于检测乳腺癌的生物标志物。 由于共振激发的影响,其检测的信噪比提高了3.8~6.6倍,能够检测目标物中低至2 pg/mL的单一抗原。应用该方法成功实现了乳腺癌24种抗原的同时检测。
近十几年来,蛋白质芯片在生物医学基础研究和临床诊断均取得了较大的进展,被广泛应用于与疾病相关的蛋白质组学研究、生物标志物筛选(发现和验证新的相互作用,生物标志物和药物靶标检测,翻译后修饰,以及复杂样品中蛋白质的相对定量)。 目前,已经有几十种商品蛋白质芯片被应用于比较蛋白质分析和体外诊断。 例如,Arrayit公司的 HuProtTM v2.0 19K Human Proteome Microarrays (包含19275 种常见的人源蛋白质和119种鼠源蛋白质)被应用于药物和生物标志物筛选;RayBiotech公司的抗体芯片能够同时检测多达1000种的目标物,被应用于过敏性疾病和肿瘤诊断;Phadia AB公司的ImmunoCAP ISAC过敏诊断芯片已在临床上用于确定IgE和IgG反应的112种过敏源分子。 虽然蛋白质芯片在蛋白质组学、生物医学等领域已取得了较大的成功,但其仍然存在以下不足:1)灵敏度低,不能满足低丰度(fg/mL至pg/mL)病生物标志物的检测;2)由于蛋白质的非特异性吸附作用导致复杂样品检测时信噪比较低,影响检测的特异性和重现性,不同批次蛋白质芯片间的检测结果存在较大的变异系数;3)过度依赖于重组蛋白质导致高检测成本而降低了其实用性等。 通过采用以下方法/策略将有助于克服上述不足,进一步建立用户友好、低检测成本的蛋白质芯片免疫分析系统,从而快速、灵敏、准确地同时检测多种生物标志物,提高蛋白质芯片的临床分析能力。 1)构建具有三维结构的新型基底,通过提高单位面积探针的固定量来增强对测样品中目标物的捕获能力,并减少其它蛋白质的非特异性吸附性,从而获得较高的信噪比,改善检测的灵敏度和选择性,实现超低浓度生物标志物的检测。 在二维(2D)平面基底上修饰醛基或环氧基团功能化的具有微孔/介孔结构的水凝胶材料或高抗污刷状高分子构建具有三维(3D)结构的新型基底不仅能够提高单位面积蛋白质探针分子的固定量,而且能够为生物分子反应提供良好的微环境,有效提高生物分子的反应效率并减少非特异性吸附。 2)加强基础研究机构、企业研发部门、医院临床诊断/检测相关课题组之间的合作,标准化蛋白质芯片的制备、反应和储存条件,以改善蛋白质芯片的重现性并减少人为误差。 3)扩大数据采集规模,建立蛋白质芯片对不同临床样本分析的数据库,发展新的统计方法并建立相应的数学模型,以正确分析所获得的芯片检测数据。 4)发展新型的蛋白质固定方法,制作原生或天然的蛋白质抗原芯片,用于分析临床样品中的抗体反应,降低蛋白质芯片的制作成本。 如,针对蛋白质探针分子的理化性质采用不同的点样模式,以保证探针分子结构的稳定性,并通过苯硼酸-碳水化合物耦合反应、金属离子-蛋白质螯合反应等实现天然蛋白质抗原分子的固定。 5)采用高功率单色LED为激发光源,线性CCD为检测器,并结合高分辨拟合算法,研发新型、操作简单、便携式的检测设备。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|