在水热和弱酸性反应条件下,螯合型表面活性剂前驱体乙二胺三乙酸分别与氯化锌、氯化钴反应,形成水合乙二胺三乙酸金属配合物[M(H2O)6][M(ED3A)(H2O)]2·2H2O[M=Zn(1),Co(2);H3ED3A=乙二胺三乙酸,C8H14N2O6]。 产物经元素分析、红外、热重、液体核磁共振和X射线单晶衍射结构表征。 乙二胺三乙酸和锌(Ⅱ)、钴(Ⅱ)五配位,并与水一起形成典型的[MN2O4]或[MO6]八面体结构。13C核磁共振实验结果表明,溶液中乙二胺三乙酸与锌形成配合物在弱酸性条件下(pH值3~7)稳定存在,在酸性溶液中完全解离,乙二胺三乙酸进一步经分子内成环反应生成3-酮哌嗪二乙酸(H2kpda=C8H12N2O5)。
Zinc and cobolt ethylenediaminetriacetates [M(H2O)6][M(ED3A)(H2O)]2·2H2O[M=Zn(1), Co(2); H3ED3A=ethylenediaminetriacetic acid, C8H14N2O6] were obtained on the hydrothermal conditions at 140 ℃ in a weak acidic solution. Complexes 1 and 2 were characterized by elemental analysis, IR, TG-DTG, solution13C NMR spectroscopy, and X-ray analysis. ED3A coordinates with zinc or cobalt ions as a pentadentate ligand. The metal ions are arranged in octahedral coordination geometries [MN2O4] or [MO6]. Comparisons of13C NMR spectra demonstrate that the coordination of ED3A zinc complex is stable in weak acidic solution(pH 3~7), while ED3A cyclizes to form ketopiperazinediacetic acid(H2kpda, C8H12N2O5) under acidic condition.
N-酰基乙二胺三乙酸(H3ED3A=C8H13O6N2)是一种低毒性、高耐盐性和耐硬水性的螯合型表面活性剂[1,2,3,4,5],其研究工作主要集中于其合成方法、碳链长度对表面活性和金属螯合性的影响,以及表面活性各项指标的研究[6,7]。 它在pH值为5~7的区间范围内降低表面张力的效果显著。 这些突出的性质得益于ED3A具有不对称的螯合官能团和强的金属螯合性能。 ED3A也可以连接在生物肽链、介孔二氧化硅等不同结构上[8,9,10,11],以赋予其螯合金属的能力。 类似结构的乙二胺四乙酸可作为螯合剂应用于复氧化物的制备上[12,13]。
目前已经报道了一系列结构为[M(ED3A)X][M=Co(Ⅲ)[14,15],Cr(Ⅲ)[16],Cu(Ⅱ)[17],Ni(Ⅱ)[18],Ti(Ⅳ)[19];X=单齿或双齿配体]的单核配合物,并通过密度泛函理论(DFT)计算了配合物的稳定构象。 但这类配合物的热稳定性和ED3A在溶液中的化学研究较少。 由于乙二胺三乙酸在酸性和弱酸性条件下都可以分子内成环,生成3-酮哌嗪二乙酸(H2kpda=C8H12O5N2)并达到化学平衡[20,21,22]。 其与金属螯合后的溶液行为并不清楚,因此有必要研究ED3A与不同金属形成的配合物及其溶液的反应性行为。 本文报道了在水热条件下分离得到的乙二胺三乙酸锌和钴配合物[M(H2O)6][M(ED3A)(H2O)]2·2H2O[M=Zn(1);Co(2)],产物经光谱、结构表征和热分析研究,并用液体13C核磁共振研究了不同pH值条件下对ED3A锌配合物离解和环合反应生成3-酮哌嗪二乙酸的影响。
六水合氯化钴和氯化锌均为国产分析纯试剂。 乙二胺三乙酸、乙二胺三乙酸钠盐Na3ED3A(3)和3-酮哌嗪二乙酸均由本实验室制备[2,23]。 Bruker Apex CCD型四圆单晶衍射仪(德国Bruker公司);Bruker Avance II(400 MHz)型核磁共振仪(德国Bruker公司)。
将氯化锌(1.36 g,10 mmol)溶液逐滴加入到乙二胺三乙酸三钠(2.99 g,10 mmol)的水溶液中,再加入甘氨酸(0.75 g,10 mmol),用稀盐酸(2.0 mol/L)调节溶液pH值至5.0,140 ℃下水浴加热72 h,待加热结束后缓慢降至室温,常压过滤,放置在室温下缓慢蒸发,两周后有无色块状晶体析出,产量3.23 g,产率77%。 分别调节溶液的pH值在3~7的范围,同样可以分离得到乙二胺三乙酸锌和钴配合物1和2。 Zn3C16H42N4O22( Mr:838.75)元素分析计算值/%:C 22.9,H 5.1,N 6.9;实验值/%:C 23.3,H 4.9,N 6.8。 用同样的方法合成[Co(H2O)6][Co(ED3A)(H2O)]2·2H2O (2),得到紫红色块状晶体。 产量2.67 g,产率65%。 Co3C16H42N4O22( M:819.33)元素分析计算值/%:C 23.5,H 5.2,N 6.8;实验值/%:C 23.2,H 4.8,N 7.1。
1.3.1 X射线单晶衍射分析 单晶结构分析电压45~50 kV,电流20~30 mA,Mo Kα射线,石墨单色器,辐射波长0.07107 nm。 采用WinGX 1.64版程序解得初结构,Shelxl 97程序包精修。 详细晶体数据见辅助材料表S1,配合物1和2的CCDC号分别为1015974和1015973。
1.3.2 核磁共振 以三甲基硅丙基磺酸钠(DSS,Sigma产品)为内标,D2O作溶剂。
与以往的高价态乙二胺三乙酸配合物[M(ED3A)X][14,15,16,19]的温和反应条件不同,本文低价态的二价锌、钴配合物[M(H2O)6][M(ED3A)(H2O)]2·2H2O(M=Zn,Co)的合成是通过水热反应完成。 有意思的是,乙二胺三乙酸锌、钴配合物1和2与文献[17,18]报道的乙二胺三乙酸镍配合物[Ni(H2O)6][Ni(ED3A)(H2O)]2·2H2O和铜配合物[Mg(H2O)6][Cu(ED3A)(H2O)]2·2H2O同晶,但与本文自制纯净的乙二胺三乙酸和氯化锌和氯化钴反应不同[2,23],文献报道的乙二胺三乙酸制备是通过氯乙酸与乙二胺反应、柱色谱分离、钙盐沉淀纯化得到;再与氯化镍或氯化铜反应后,经过柱色谱分离得到产物。
H2NCH2CH2NH2+ClCH2CO2H →H3ED3A →Ca3(ED3A)2 →[Ni/Cu(ED3A)(H2O)]
锌(Ⅱ)、钴(Ⅱ)配合物[Zn(H2O)6][Zn(ED3A)(H2O)]2·2H2O(1)和[Co(H2O)6][Co(ED3A)-(H2O)]2·2H2O(2)的结构分别由配阴离子[M(ED3A)(H2O)]2-和水合配阳离子[M(H2O)6]2+组成。图1和2分别为锌和钴配合物1和2的配阴离子结构图,中心金属(Zn1或Co1)与一个水分子和五配位的ED3A分子形成八面体构型,其中不对称的ED3A分子形成了4个五元环,由于N1上存在一个质子,该质子可被取代用以合成螯合型表面活性剂。 在晶体堆积中,配阳离子[M(H2O)6]2+与配阴离子[M(ED3A)(H2O)]-的乙二胺三乙酸羧基形成一维链,并进一步与配阴离子[M(ED3A)(H2O)]-上的配位水和两个结晶水形成复杂的氢键网络。
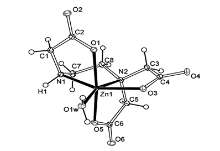 | 图1 椭球率为30%的[Zn(ED3A)(H2O)]2-(1)配阴离子ORTEP结构图Fig.1 ORTEP plot of the anion structure for [Zn(H2O)6][Zn(ED3A)(H2O)]2·2H2O(1) at 30% probability levels |
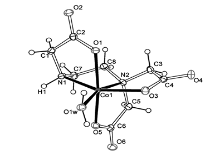 | 图2 椭球率为30%的[Co(ED3A)(H2O)]2-(2)配阴离子ORTEP结构图Fig.2 ORTEP plot of the anion structure for [Co(H2O)6][Co(ED3A)(H2O)]2·2H2O(2) at 30% probability levels |
配合物1中的Zn—Ocarboxy平均键长为0.2123(2) nm;Zn—N平均键为0.2173(2) nm;Zn—Ow键长为0.2037(2) nm。 从键长分析可以看出,配位八面体发生不规则畸变。 配合物2中的Co—Ocarboxy平均键长为0.2105(3) nm;Co—N平均键长为0.2156(3) nm;Co—Ow的键长为0.2057(3) nm。 钴配合物2的键长稍短于锌配合物1的相应键长,这是由于Co2+的离子半径小于Zn2+所致。 配合物1和2与已报道的乙二胺三乙酸类配合物的键长比较如表1所示。 钴配合物2中的Co—Ocarboxy和Co—N键长明显长于相应的高价态Co(Ⅲ)与乙二胺三乙酸的配位键键长。
| 表1 乙二胺三乙酸类金属配合物中配位羧基、氨基和配位水键长比较 Table 1 Comparisons of bond distances(nm) between average coordinated carboxy, amine groups and water molecules in ED3A complexes |
配合物1和2的红外图谱比较如图3所示。 由于两个配合物属同晶结构,二者羧基的反对称伸缩振动均为1599 cm-1,相应的羧基对称伸缩振动则在1432~1309 cm-1之间。 与乙二胺三乙酸钠盐Na3ED3A(3)的未配位羧基吸收峰1687 cm-1相比,形成配位化合物的羧基的反对称伸缩振动明显向低波数方向移动。 由于所有的羧基都参与配位,因此在大于1700 cm-1的范围内没有观察到羧酸的振动吸收峰。
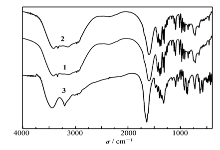 | 图3 配合物[M(H2O)6][M(ED3A)(H2O)]2·2H2O[M=Zn(1),Co(2)]与Na3ED3A(3)的红外光谱比较Fig.3 Comparison of IR spectra for [M(H2O)6][M(ED3A)(H2O)]2·2H2O[M=Zn(1), Co(2)] with Na3ED3A(3) |
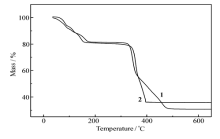
图4是配合物1和2在30 ~ 650 ℃的热分解曲线。 从图4可以看出,锌配合物1失重主要分为两个明显的阶段。 在150 ℃之前主要脱去结晶水和配位水,配合物1和2失去全部的2个结晶水和7个配位水的观察值分别为18.4%和18.7%,介于失去8~9个水过程的理论值分别在17.2%和17.6%与19.3%和19.8%之间,这可能与一水合乙二胺三乙酸配合物的配位水分解有关;在345 ℃可以看到配合物的剧烈分解,当温度达到475 ℃时,分解完全,残余物经过计算为ZnO。 由于钴和锌配合物的结构相似,它们的热分解也相似。 钴配合物2在150 ℃之前主要脱去结合的配为水,在356 ℃可以看到配合物剧烈分解。 钴配合物2的稳定性比锌配合物1稍差,当温度达到400 ℃时已经分解完全,残余物经过对比分析为Co3O4。
图5为乙二胺三乙酸锌配合物1在pH值分别为2.0、3.5和5.0下与乙二胺三乙酸钠和3-酮哌嗪二乙酸溶液的13C NMR谱图比较,其13C信号位移见表2。 对乙二胺三乙酸锌在溶液中核磁共振13C数据变化分析表明:与没有配位的Na3ED3A(3)相比,配位后的羧基和亚甲基碳的核磁共振信号明显向低场移动;对比未配位的3-酮哌嗪二乙酸和乙二胺三乙酸钠两者的平衡产物,当pH值为3.5时,溶液中乙二胺三乙酸仍与锌稳定配位,锌配合物1并没有发生解离;但当溶液pH值达到2.0时,核磁共振信号明显向高场移动,与3-酮哌嗪二乙酸溶液的核磁共振信号位移吻合,说明此时乙二胺三乙酸锌配合物1已经完全解离,解离后的乙二胺三乙酸在酸性溶液中经分子内成环生成3-酮哌嗪二乙酸。 加上先前我们对3-酮哌嗪二乙酸与锌的配位研究[24],该反应过程如图6所示。
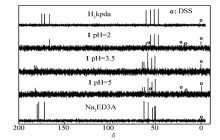 | 图5 3-酮哌嗪二乙酸、乙二胺三乙酸三钠和锌配合物1溶液的13C NMR谱图比较Fig.5 Solution13C NMR spectra of ketopiperazinediacetic acids, sodium ethylenediaminetriacetate and its zinc complex |
| 表2 3-酮哌嗪二乙酸、乙二胺三乙酸三钠与锌配合物1的13C NMR 信号位移( δ) Table 2 Assigned13C NMR spectral data( δ) of ketopiperazinediacetic acid, sodium ethylenediaminetriacetate and its zinc complex |
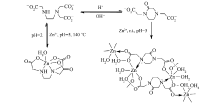 | 图6 不同pH值和温度下乙二胺三乙酸和3-酮哌嗪二乙酸与锌配合物之间的转化Fig.6 pH and temperature-dependent conversion of ED3A and kpda complexes |
实际上,当锌配合物1在酸性条件下解离后,溶液放置于室温中,在pH=5的条件下最后可以得到kpda的聚合物[Zn2(kpda)2(H2O)4] n·6 nH2O[24]。 虽然ED3A和kpda在溶液中存在化学平衡,但锌配合物1受反应温度影响较大。 水热条件下可以抑制在酸性条件下ED3A向kpda的转化过程,促进反应生成乙二胺三乙酸锌配合物1。 但目前尚无证据表明锌配合物1可以直接转化为3-酮哌嗪二乙酸锌配位聚合物。
未配位的乙二胺三乙酸可以发生环合反应生成3-酮哌嗪二乙酸,环合后无法用于合成螯合型表面活性剂制备,该环合过程在溶液中达到平衡,随着酸性提高,环合反应加快。 所以在中性和酸性条件下,未配位乙二胺三乙酸只能少量以开环的形式存在;但当溶液中出现游离碱时,环合反应被抑制。 特别是在弱酸性、140 ℃的水热反应条件下,可以分离得到乙二胺三乙酸与锌(Ⅱ)和钴(Ⅱ)配合物,其配位模式相同,均是以金属离子为中心与乙二胺三乙酸和水分子形成的八面体结构单元。 水热反应抑制弱酸性环境中乙二胺三乙酸向3-酮哌嗪二乙酸的转化过程。 乙二胺三乙酸与锌配位后,pH值3~7条件下可以分离得到乙二胺三乙酸锌,它在溶液中不解离也不发生环合反应,锌的配位使得乙二胺三乙酸可在弱酸性条件下稳定存在。
辅助材料(Supporting Information)[ 晶体数据]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|