共同通讯联系人:胡国强,教授; Tel/Fax:0371-23880680; E-mail:hgqxy@sina.com.cn; 研究方向:新药分子设计
为发现氟喹诺酮由抗菌活性向抗肿瘤活性转化的结构修饰方法,基于生物电子等排药物设计原理,用唑杂环作为氧氟沙星(1)C-3羧基的等排体、硫醚酮缩氨基硫脲为其功能侧链修饰基,设计合成C-3均三唑硫醚酮缩氨基硫脲目标化合物(6a~6g),其结构经元素分析和光谱数据确证。 体外抗肿瘤活性结果表明,中间体C-3均三唑硫醚酮(5a~5g)和目标化合物(6a~6g)的活性均强于母体氧氟沙星的活性,其中缩氨基硫脲的活性强于相应硫醚酮的活性,尤其是苯环含硝基和氟原子目标化合物的活性与对照药阿霉素的活性相当。 因此,功能缩氨基硫脲链修饰的均三唑作为C-3羧基的等排体有利于提高氟喹诺酮的抗肿瘤活性。
Co-corresponding author:HU Guoqing, professor; Tel/Fax:0371-23880680; E-mail:hgqxy@sina.com.cn; Research interests:design for the new drug molecules
To discover efficient structural modification strategy for the conversion of antibacterial activity of fluoroquinolones into antitumor activity, an azole heterocycle modified with sulfide-ketone thiosemicarbazone chain was designed as the bioisosteric replacement of the C-3 carboxylic acid group. Consequently, novel s-triazole-based thiosemicarbazone derivatives(6a~6g) were synthesized from ofloxacin 1, respectively. The structures of the title compounds(6a~6g) were characterized by elemental analysis and spectral data, and the in vitro antitumor activity was also evaluated by the MTT assay. Compounds(6a~6g) exhibit more significantly antiproliferative activity than both of parent ofloxacin 1 and the corresponding sulfide-ketone intermediates(5a~5g). These thiosemicarbazones, particularly those containing nitro group or fluorine atom, have comparable activity to doxorubicin. Therefore, it suggests that an azole ring modified with functional side-chain as the bioisosteric replacement of the C-3 carboxylic group is favorable for an improvement of antitumor activity of fluoroquinolones.
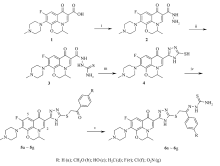
新药研发是一项高风险、高投入的复杂智力创新过程,为规避风险,提高药物创新的成功率,基于现有药物的结构进行修饰以获得有发展成药前景的先导化合物,是新药研发中最经济和最可靠的策略[1]。 其中,基于药效团生物电子等排体的替代和药效团拼合的理性药物分子设计是新药分子构建中常用的方法[2]。 以喹啉-4-酮-3-羧酸为其基本药效骨架的氟喹诺酮类是目前临床广泛使用的抗菌药,基于其抗菌作用靶标—拓扑异构酶也是抗肿瘤药物的重要作用靶点,由此可通过结构修饰将抗菌活性转化为抗肿瘤活性[3]。 同时,对氟喹诺酮的结构修饰发现[4,5],C-3羧基虽是抗菌活性所必需的药效团,但并非是抗肿瘤活性所必要的,可被其杂环或稠杂环类等生物电子等排体替代。 然而,对众多的杂环化合物,哪些是适宜的C-3羧基等排体、对其如何优化以促进向成药性的发展所知甚少。 为此,一方面考虑到唑杂环,尤其是均三唑作为重要的优势药效团构架所构建的衍生物因具有广泛的药理活性备受关注[6],同时,缩氨基硫脲类不但能与多种金属离子螯合产生重要的药理作用,尤其是一些杂环缩氨基硫脲类化合物的抗肿瘤作用靶点也可能是DNA拓扑异构酶II (TopoII),已成为抗肿瘤药物研究的新靶点[7]。 鉴于此,本文利用药效团的生物电子等排及其拼合药物设计原理,用均三唑作为抗菌氟喹诺酮氧氟沙星1的羧基等排体、缩氨基硫脲作为等排体的修饰优化基,进而设计合成了新的C-3均三唑硫醚酮缩氨基硫脲目标化合物(6a~6g),合成路线见Scheme 1。 通过体外抗肿瘤活性的评价,初步分析结构修饰的合理性,为进一步的结构修饰提供新思路。
氧氟沙星(1)为市售品,中间体均三唑硫醇(4)按文献[8]方法制备,所用其它试剂均为市售分析纯。
WK-1B型数字熔点仪(上海精密科学仪器厂);Bruker AM-400型核磁共振仪(德国Bruker公司),DMSO-d6为溶剂,TMS为内标;Esquire LC型质谱仪(德国Bruker公司);PE2400-Ⅱ型元素分析仪(美国Perkin-Elmer公司);BIO-RAD-680型酶标仪(美国Bio-Rad公司)。
1.2.1 6-氟-7-(4-甲基-哌嗪-基)-1,8-(3,1-氧丙基)-3-[5-(取代)苯甲酰甲硫基-4 H-[1,2,4]三唑-3-基]-喹啉-4(1 H)-酮(5a~5g)的合成 2.0 g(4.8 mmol)均三唑硫醇4与1.2 g(6.2 mmol)α-溴代苯乙酮在无水乙醇(50 mL)中搅拌回流反应10 h。 放置室温,过滤。 滤饼悬浮于蒸馏水(50 mL)中,用碳酸氢钠饱和溶液调中性,滤集固体,干燥。 用无水乙醇重结晶,得黄色固体6-氟-7-(4-甲基-哌嗪-基)-1,8-(3,1-氧丙基)-3-(5-苯甲酰甲硫基-4 H-[1,2,4]三唑-3-基)-喹啉-4(1 H)-酮(5a),收率73.6%,mp 204 ~ 206 ℃。
分别用 α-溴代取代苯乙酮替代 α-溴代苯乙酮,按照化合物5a的相同制备方法分别制得化合物5b,收率76.4%,mp 206 ~ 208 ℃;化合物5c,收率70.8%,mp 213 ~ 215 ℃;化合物5d,收率65.2%,mp 174 ~ 176 ℃;化合物5e,收率76.5%,mp 225 ~ 227 ℃;化合物5f,收率71.3%,mp 172 ~ 175 ℃;化合物5g,收率81.5%,mp 234 ~ 236 ℃。
化合物5a:元素分析(C27H27FN6O3S计算值)/%:C 60.87(60.66),H 5.21(5.09),N 15.83(15.72);1H NMR(400 MHz,DMSO-d6), δ:1.46(d, J=7.2 Hz,3H,CH3),2.26(s,3H,N—CH3),3.07~3.52(m,8H,piperazine—H),4.57~4.64(m,3H,OCH2CHN),4.76(s,2H,SCH2),7.53~7.83(m,6H,Ph—H和C5—H),8.74(s,1H,C2—H),13.64(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.40,40.52,46.57,50.62,54.31,55.80,68.49,103.50,106.80,121.52,121.64,124.61,128.87,129.29,131.18,134.05,136.14,140.80,141.77,152.34,157.83,172.33,194.46;ESI-MS( m/z):535[M+H]+,计算值:534[M]。
化合物5b:元素分析(C28H29FN6O4S计算值)/%:C 59.72(59.56),H 5.03(5.18),N 15.05(14.88);1H NMR(400 MHz,DMSO-d6), δ:1.47(d, J=7.2 Hz,3H,CH3),2.28(s,3H,N—CH3),3.14~3.46(m,8H,piperazine—H),3.87(s,3H,OCH3),4.57~4.68(m,3H,OCH2CHN),4.78(s,2H,SCH2),7.62(d, J=8.6 Hz,2H,Ph—H),7.75(d, J=6.8 Hz,1H,C5—H),8.07(d, J=8.6 Hz,2H,Ph—H),8.76(s,1H,C2—H),13.66(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.40,40.53,46.55,50.63,54.33,55.80,58.42,68.50,103.52,106.80,116.82,121.53,121.66,124.67,127.68,130.46,136.14,140.83,141.78,152.36,157.88,172.35,163.23,194.48;ESI-MS( m/z):565[M+H]+,计算值:564.64。
化合物5c:元素分析(C27H27FN6O4S计算值)/%:C 59.15(58.90),H 5.07(4.94),N 15.48(15.26);1H NMR(400 MHz,DMSO-d6), δ:1.46(d, J=7.2 Hz,3H,CH3),2.26(s,3H,N—CH3),3.12~3.48(m,8H,piperazine—H),4.57~4.68(m,3H,OCH2CHN),4.77(s,2H,SCH2),7.65(d, J=8.6 Hz,2H,Ph—H),7.82(d, J=6.8 Hz,1H,C5—H),8.06(d, J=8.6 Hz,2H,Ph—H),8.74(s,1H,C2—H),10.56(s,1H,OH),13.65(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.40,40.53,46.58,50.62,54.30,55.77,68.54,103.51,106.76,112.54,121.55,121.62,124.63,125.63,126.83,136.11,140.80,141.77,152.35,157.84,172.30,160.51,194.46;ESI-MS( m/z):551[M+H]+,计算值:550.62。
化合物5d:元素分析(C28H29FN6O3S计算值)/%:C 61.52(61.30),H 5.14(5.33),N 15.56(15.32);1H NMR(400 MHz,DMSO-d6), δ:1.45(d, J=7.2 Hz,3H,CH3),2.23,2.26(s,6H,Ph—CH3 和N—CH3),3.04~3.43(m,8H,piperazine—H),4.55~4.67(m,3H,OCH2CHN),4.76(s,2H,SCH2),7.46(d, J=8.6 Hz,2H,Ph—H),7.78(d, J=6.8 Hz,1H,C5—H),7.84(d, J=8.6 Hz,2H,Ph—H),8.68(s,1H,C2—H),13.64(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:24.26,18.40,40.53,46.55,50.60,54.31,55.74,68.53,103.48,106.66,121.55,121.58,124.60,128.45,128.62,130.46,136.10,138.67,140.78,141.75,152.34,157.80,172.27,194.40;ESI-MS( m/z):549[M+H]+,计算值:548[M]。
化合物5e:元素分析(C27H26F2N6O3S计算值)/%:C 58.93(58.69),H 4.63(4.74),N 15.44(15.21);1H NMR(400 MHz,DMSO-d6), δ:1.48(d, J=7.2 Hz,3H,CH3),2.31(s,H,N—CH3),3.16~3.48(m,8H,piperazine—H),4.61~4.68(m,3H,OCH2CHN),4.82(s,2H,SCH2),7.73(d, J=8.6 Hz,2H,Ph—H),7.83(d, J=6.8 Hz,1H,C5—H),8.16(d, J=8.6 Hz,2H,Ph—H),8.81(s,1H,C2—H),13.68(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.41,40.55,46.58,50.62,54.32,55.82,68.55,103.61,106.84,121.55,121.66,124.62,125.66,129.31,130.08,136.17,140.82,141.78,152.36,157.85,163.16,172.35,194.48;ESI-MS( m/z):553[M+H]+,计算值:552[M]。
化合物5f:元素分析(C27H26ClFN6O3S计算值)/%:C 57.24(56.99),H 4.48(4.61),N 14.93(14.77);1H NMR(400 MHz,DMSO-d6), δ:1.46(d, J=7.2 Hz,3H,CH3),2.30(s,H,N—CH3),3.13~3.47(m,8H,piperazine—H),4.57~4.66(m,3H,OCH2CHN),4.80(s,2H,SCH2),7.68(d, J=8.6 Hz,2H,Ph—H),7.82(d, J=6.8 Hz,1H,C5—H),8.15(d, J=8.6 Hz,2H,Ph—H),8.78(s,1H,C2—H),13.66(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.42,40.55,46.56,50.61,54.33,55.82,68.57,103.62,106.82,121.57,121.63,124.58,128.68,129.78,130.24,131.57,136.16,140.80,141.78,152.33,157.84,172.34,194.46;ESI-MS( m/z):569[M+H]+,计算值:568[M](35Cl)。
化合物5g:元素分析(C27H26FN7O5S计算值)/%:C 56.18(55.95),H 4.36(4.52),N 17.16(16.92);1H NMR(400 MHz,DMSO-d6), δ:1.52(d, J=7.2 Hz,3H,CH3),2.35(s,H,N—CH3),3.17~3.53(m,8H,piperazine—H),4.62~4.68(m,3H,OCH2CHN),4.82(s,2H,SCH2),7.76(d, J=8.6 Hz,2H,Ph—H),8.07(d, J=6.8 Hz,1H,C5—H),8.23(d, J=8.6 Hz,2H,Ph—H),9.06(s,1H,C2—H),13.68(s,1H,triazole—NH);13C NMR(100 MHz,d6), δ:18.41,40.55,46.54,50.64,54.35,55.82,68.57,103.66,106.85,120.76,121.63,121.83,124.62,128.57,129.48,136.16,138.62,140.83,141.76,152.35,157.84,172.36,194.45;ESI-MS( m/z):580[M+H]+,计算值:579[M]。
1.2.2 2-{5-[6-氟-7-(4-甲基哌嗪-1-基)-1,8-(3,1-氧丙基)-喹啉-4(1 H)-酮-3-基]-4 H-[1,2,4]三唑-3-硫基}-1-(取代)苯基-乙酮缩氨基硫脲(6a~6g)合成 1.0 g(1.8 mmol)化合物5a悬浮于25 mL无水乙醇中,搅拌下加入0.32 g(3.6 mmol)氨基硫脲和1.0 mL的98%浓硫酸,反应混合物慢慢加热回流反应6 h。 减压蒸除溶剂,加30 mL水溶解,加适量的活性炭在60 ℃搅拌脱色1 h。 滤液用氨水调至中性,滤集产生的固体,水洗,干燥。 粗品用无水乙醇重结晶,得类白色固体目标物2-{5-[6-氟-7-(4-甲基哌嗪-1-基)-1,8-(3,1-氧丙基)-喹啉-4(1 H)-酮-3-基]-4 H-[1,2,4]三唑-3-硫基}-1-苯基-乙酮缩氨基硫脲(6a),收率61.6%,mp 214 ~ 216 ℃。
分别用化合物5b~5g替代化合物5a,同法操作,分别制得化合物6b,收率65.7%,mp 215~217 ℃;化合物6c,收率53.2%,mp 221~224 ℃;化合物6d,收率62.6%,mp 183~185 ℃;化合物6e,收率76.3%,mp 232~234 ℃;化合物6f,收率74.6%,mp 176~178 ℃;化合物6g,收率76.2%,mp 241~243 ℃。
化合物6a:元素分析(C28H30FN9O2S2计算值)/%:C 55.57(55.34),H 4.74(4.98),N 20.86(20.74);1H NMR(400 MHz,DMSO-d6), δ:1.46(d, J=7.2 Hz,3H,CH3),2.32(s,3H,N—CH3),3.05~3.53(m,8H,piperazine—H),4.57~4.68(m,3H,OCH2CHN),4.82(s,2H,SCH2),7.54~7.85(m,7H,Ph—H、C5—H和NH),8.28,8.36(2s,2H,NH2),8.77(s,1H,C2—H),13.66(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.38,32.26,46.55,50.60,54.27,55.68,68.45,103.50,106.77,121.48,121.63,124.56,128.86,129.28,131.16,134.00,136.12,140.80,141.74,152.34,156.54,157.78,172.32,182.47;ESI-MS( m/z):608[M+H]+,计算值:607[M]。
化合物6b:元素分析(C29H32FN9O3S2计算值)/%:C 54.78(54.62),H 5.25(5.06),N 19.63(19.77);1H NMR(400 MHz,DMSO-d6), δ:1.47(d, J=7.2 Hz,3H,CH3),2.34(s,3H,N—CH3),3.15~3.52(m,8H,piperazine—H),3.88(s,3H,OCH3),4.62~4.68(m,3H,OCH2CHN),4.84(s,2H,SCH2),7.54(d, J=8.2 Hz,2H,Ph—H),7.82~7.85(m,2H,C5—H和NH),8.13(d, J=8.2 Hz,2H,Ph—H),8.33,8.37(2s,2H,NH2),8.78(s,1H,C2—H),13.72(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.40,32.36,46.53,50.61,54.33,55.78,58.42,68.50,103.53,106.78,116.80,121.52,121.64,124.67,127.65,130.44,136.13,140.82,141.78,152.34,156.38,172.28,172.33,163.22,182.51;ESI-MS( m/z):638[M+H]+,计算值:637[M]。
化合物6c:元素分析(C28H30FN9O3S2计算值)/%:C 54.16(53.92),H 4.67(4.85),N 20.44(20.21);1H NMR(400 MHz,DMSO-d6), δ:1.48(d, J=7.2 Hz,3H,CH3),2.26(s,3H,N—CH3),3.15~3.52(m,8H,piperazine—H),4.58~4.68(m,3H,OCH2CHN),4.80(s,2H,SCH2),7.72(d, J=8.6 Hz,2H,Ph—H),7.83~7.86(m,2H,C5—H和NH),8.14(d, J=8.6 Hz,2H,Ph—H),8.35,8.38(2s,2H,NH2),8.75(s,1H,C2—H),10.57(s,1H,OH),13.68(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.38,32.35,46.56,50.60,54.30,55.76,68.52,103.51,106.77,112.53,121.55,121.61,124.62,125.64,126.83,136.10,140.80,141.75,152.33,156.62,157.80,172.30,160.48,182.62;ESI-MS( m/z):624[M+H]+,计算值:623[M]。
化合物6d:元素分析(C29H32FN9O2S2计算值)/%:C 56.27(56.02),H 5.43(5.19),N 20.53(20.27);1H NMR(400 MHz,DMSO-d6), δ:1.46(d, J=7.2 Hz,3H,CH3),2.24,2.30(2s,6H,N—CH3和Ph—CH3),3.03~3.47(m,8H,piperazine—H),4.56~4.64(m,3H,OCH2CHN),4.78(s,2H,SCH2),7.57(d, J=8.6 Hz,2H,Ph—H),7.81~7.88(m,4H,C5—H、NH和Ph—H),8.31,8.36(2s,2H,NH2),8.74(s,1H,C2—H),13.66(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:24.25,18.38,32.28,46.53,50.60,54.28,55.73,68.51,103.46,106.64,121.55,121.57,124.60,128.44,128.61,130.43,136.06,138.64,140.75,141.75,152.32,156.56,157.77,172.25,182.57;ESI-MS( m/z):622[M+H]+,计算值:621[M]。
化合物6e:元素分析(C28H29F2N9O2S计算值)/%:C 53.90(53.75),H 4.48(4.67),N 20.38(20.15);1H NMR(400 MHz,DMSO-d6), δ:1.52(d, J=7.2 Hz,3H,CH3),2.33(s,H,N—CH3),3.18~3.54(m,8H,piperazine—H),4.63~4.71(m,3H,OCH2CHN),4.84(s,2H,SCH2),7.76(d, J=8.6 Hz,2H,Ph—H),7.85~8.05(m,2H,C5—H和NH),8.28(d, J=8.6 Hz,2H,Ph—H),8.35,8.38(2s,2H,NH2),8.85(s,1H,C2—H),13.73(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.40,32.62,46.57,50.60,54.31,55.82,68.53,103.58,106.82,121.54,121.63,124.60,125.65,129.28,130.06,136.16,140.81,141.76,152.33,156.74,157.83,163.14,172.31,182.66;ESI-MS( m/z):626[M+H]+,计算值:625[M]。
化合物6f:元素分析(C28H29ClFN9O2S计算值)/%:C 52.60(52.37),H 4.34(4.55),N 19.78(19.63);1H NMR(400 MHz,DMSO-d6), δ:1.51(d, J=7.2 Hz,3H,CH3),2.32(s,H,N—CH3),3.16~3.56(m,8H,piperazine—H),4.62~4.70(m,3H,OCH2CHN),4.82(s,2H,SCH2),7.73(d, J=8.2 Hz,2H,Ph—H),7.85~7.96(m,2H,C5—H和NH),8.27(d, J=8.6 Hz,2H,Ph—H),8.34,8.36(2s,2H,NH2),8.86(s,1H,C2—H),13.71(s,1H,triazole—NH);13C NMR(100 MHz,DMSO-d6), δ:18.38,32.58,46.53,50.58,54.30,55.78,68.51,103.57,106.80,121.54,121.61,124.56,128.66,129.75,130.23,131.56,136.14,140.77,141.75,152.31,156.68,157.82,172.31,182.56;ESI-MS( m/z):642[M+H]+,计算值:641[M](35Cl)。
化合物6g:元素分析(C28H29FN10O4S计算值)/%:C 51.76(51.52),H 4.30(4.48),N 21.64(21.46);1H NMR(400 MHz,DMSO-d6), δ:1.56(d, J=7.2 Hz,3H,CH3),2.35(s,H,N—CH3),3.23~3.67(m,8H,piperazine—H),4.64~4.76(m,3H,OCH2CHN),4.85(s,2H,SCH2),7.82(d, J=8.6 Hz,2H,Ph—H),7.86~8.13(m,2H,C5—H和NH),8.36(d, J=8.6 Hz,2H,Ph—H),8.36,8.44(2s,2H,NH2),9.12(s,1H,C2—H),13.74(s,1H,triazole—NH);13C NMR(100 MHz,d6), δ:18.40,32.74,46.52,50.64,54.33,55.80,68.56,103.70,106.86,120.74,121.64,121.82,124.63,128.57,129.46,136.14,138.63,140.81,141.74,152.33,156.74,157.82,172.34,182.72;ESI-MS( m/z):653[M+H]+,计算值:652[M]。
对合成的7个C-3均三唑硫醚酮和7个相应的硫醚酮缩氨基硫脲化合物及对照氧氟沙星(ofloxacin,OF)和结构类似抗癌药物阿霉素(doxorubicin,DOX)用DMSO配成1.0×10-2 mol/L浓度的储备液,用RPMI-1640稀释到所需浓度。取对数生长期的人肝癌Hep-3B细胞、人胰腺癌Capan-1细胞及人白血病HL60细胞分别以每孔5000个细胞接种于96孔板,培养隔夜后,加入不同浓度的上述供试化合物溶液,继续培养48 h后弃去培养基。 每孔加入1 g/L MTT溶液100 μL,继续培养4 h后弃上清液。 每孔加入150 μL二甲基亚砜,轻轻振荡30 min,用酶标仪在570 nm波长处测其吸光度值。 计算各组对癌细胞的抑制率:抑制率/%=[(1-实验组吸光度值)/对照组吸光度值]×100。 然后以各药物浓度的对数值对各浓度下的抑制率作线性回归,得浓度-效应方程,以此计算出各供试化合物对实验癌细胞的半数抑制浓度(IC50)。 所有实验在相同条件下重复进行3次,最终结果以Mean±SD表示。
均三唑硫醇类化合物与 α-卤代(取代)苯乙酮类通常在醇中可发生取代和闭环反应生成噻唑并均三唑稠杂环类化合物。 然而,对氟喹诺酮取代的均三唑硫醇化合物4与 α-溴代(取代)苯乙酮在无水乙醇中可顺利发生巯基(—SH)与Br的亲核取代反应形成硫醚酮5,但由于受氟喹诺酮取代基较大空间位阻的影响,产生的中间体5未能进一步发生分子内环合反应。 如将中间体5在多聚磷酸中进一步反应,可顺利实现闭环形成相应的稠杂环类化合物。 另外,试图在反应体系中加入缚酸剂如有机碱三乙胺和吡啶或无机碱如碳酸(氢)钠等以促进反应速度,提高其收率,但这些均能导致反应液变深,副产物增多。 这可能是生成的硫醚酮5中的硫原子受羰基吸电子基的影响,在碱性条件下易发生脱硫反应而致。 同时,对一般的酮类与氨基硫脲的缩合反应通常用弱酸冰乙酸催化即可完成,而对大分子的硫醚酮5仅在强脱水剂浓硫酸的催化下方可完成。
实验化合物对Hep-3B、Capan-1及HL60 3种癌细胞的半数抑制浓度(IC50)见表1。 7个C-3均三唑硫醚酮化合物(5a~5g)和相应的7个硫醚酮缩氨基硫脲化合物(6a~6g)的对3种实验癌细胞的IC50值均在50 μmol/L以下,低于母体氧氟沙星1的值(>100 μmol/L),其中对人胰腺癌Capan-1细胞的活性最强,表现出一定的选择性。 同时,硫醚酮缩氨基硫脲化合物的活性强于硫醚酮的活性,尤其是修饰基苯环含有F原子(6e)或硝基取代的氨基硫脲化合物(6g)对Capan-1细胞的IC50值已达到微摩尔浓度,其活性与抗肿瘤对照药阿霉素相当,具有发展为先导物的潜力。
| 表1 实验化合物对Hep-3B、Capan-1 和 HL60 的抗细胞增值活性 Table 1 Anti-cell proliferative activity of the tested compounds against Hep-3B, Capan-1 and HL60 tumor cells |
以氧氟沙星1为原料,经肼解、与硫氰化钾缩环合反应得到氟喹诺酮C-3均三唑硫醇中间体、然后与 α-卤代(取代)苯乙酮类发生亲核取代反应生成C-3均三唑硫醚酮类化合物5a~5g,再与氨基硫脲在浓硫酸的催化下形成C-3均三唑硫醚酮缩氨基硫脲类化合物6a~6g。 初步的抗肿瘤结果表明,硫醚酮5和相应的硫醚酮缩氨基硫脲类6的抗肿瘤活性菌强于母体1的活性,尤其修饰基苯环含硝基和氟原子的化合物6e和6g的活性与对照药阿霉素的活性相当。 因此,氟喹诺酮C-3羧基并非是抗肿瘤活性所必要药效团,可用均三唑杂环等排体取代,且被硫醚酮缩氨基硫脲功能侧链修饰有利于提高其抗肿瘤活性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|