共同通讯联系人:程海洋,副研究员; Tel/Fax:0431-85262454; E-mail:hycyl@ciac.ac.cn; 研究方向:超临界二氧化碳,硝基化合物加氢
对氨基苯酚是一种重要的化工原料及医药中间体。 由硝基苯合成对氨基苯酚具有明显的原料优势,并且具有流程短、能耗低等优点;但该方法通常以传统液体强酸为催化剂,存在设备腐蚀、需要用碱中和反应后的残余酸,产生大量盐固体废弃物等问题。 因此,开发硝基苯加氢合成对氨基苯酚的绿色工艺具有重要的意义,也是近年研究的热点。 现阶段的研究主要集中在开发可替代传统液体酸的催化剂,如固体酸、酸性离子液体、路易斯酸、二氧化碳-水以及固体酸负载金属纳米粒子双效催化剂等,并取得了较大的进展。 本文主要综述和评价如上绿色酸催化体系中硝基苯加氢合成对氨基苯酚的最新进展并对其未来发展进行了展望。
Co-corresponding author:CHENG Haiyang, associate professor; Tel/Fax:0431-85262454; E-mail:hycyl@ciac.ac.cn; Research interests:supercritical carbon dioxide and hydrogenation of nitro compounds
p-Aminophenol(PAP) is an important chemical and pharmaceutical intermediate. Its synthesis from nitrobenzene(NB) has obvious advantages from the view of raw material, and the short reaction process as well as the low energy consumption. However, conventional liquid acid is usually used as catalyst in this reaction, which brings serious corrosion of equipment. Alkali is used to neutralize acid after the reaction to produce a great deal of solid waste of salt. Therefore, green technology for preparation of PAP from NB is of great significance, and becomes one of the hot research topics in these years. Most interests have been focused on searching for benign alternative to conventional liquid acid, and some progresses have been achieved, such as solid acid, acidic ionic liquid, Lewis acid, CO2-H2O system, and bi-functional catalysts with solid acid supported metal nanoparticles. Herein, we review the latest progresses on the hydrogenation of NB to PAP with these environmental benign acid catalysts and give the future development prospects.
对氨基苯酚(PAP)是一种重要的化工原料和医药中间体,被广泛应用于医药、染料、橡胶、农药和感光材料等领域。 在医药领域,主要用于制造解热镇痛药扑热息痛(对乙酰氨基酚);在染料行业,作为染料的中间体,多用于合成硫化染料、酸性染料、毛皮染料及偶氮染料等;在橡胶工业,主要用来合成苯二胺类防老剂;在农药领域,可以合成植物生长调节剂对氯苯氧乙酸;在感光材料行业用于制造显影剂。
合成对氨基苯酚工艺按原料路线可分为以下几种:1)苯酚亚硝化法,该法以苯酚为原料,在硫酸介质中亚硝酸钠存在下低温进行亚硝化得到对亚硝基苯酚,还原得到PAP。 该法的产物复杂,毒性大,操作条件要求高,有机溶剂消耗量大,收率低,产物分离及溶剂回收困难,环境污染较为严重,此生产工艺已基本被摒弃。 2)苯酚、苯胺偶合法,苯胺重氮化后与苯酚在NaOH溶液中偶合生成对羟基偶氮苯,然后还原获得PAP和苯胺,苯胺经蒸馏回收使用。此法原料成本相对较低,但消耗量大,三废多,低温重氮化工艺复杂,工业上极少采用。 3)对氯硝基苯法[1],以对氯硝基苯为原料,在碱性条件下加压水解,酸化后制备成对硝基苯酚,再还原得到PAP。 该法为国内生产PAP的主要方法,但此法污染严重,三废处理难,已限定其生产规模。 4)对苯二酚氨化法,以对苯二酚为原料,在含镓氧化物催化剂作用下,与氨气在300~500 ℃下反应可生成PAP,但原料价格远高于PAP价格,没有工业化意义。 5)对硝基苯酚法:a.铁粉还原法[2],使用铁屑在酸性介质中还原对硝基苯酚生成PAP,该法是PAP生产最早采用的一种生产方法,该方法工艺成熟,投资少,但PAP收率低,环境污染严重,在发达国家已被淘汰,我国的一些中小规模企业仍采用该方法生产;b.催化加氢法[3],工业上以雷尼镍为催化剂,对硝基苯酚通过加氢还原得到PAP,该方法PAP收率高,副产物少,产品质量高,废液及废渣的排放量大大减少,国外多家公司以及我国安徽八一化工集团等均采用该工艺技术生产。 6)硝基苯(NB)还原法:a.金属还原法[4],以Al、Fe在酸性条件下还原NB生成PAP,PAP的收率可达到80%以上,但金属消耗量大,环境污染严重;b.电化学还原法[5],以铅或铝板作阳极,以铜板做阴极,在20%~70%的硫酸介质中,还原NB生成PAP。 该法操作简单,工艺流程短,产品纯度高,环境污染小,但是设备复杂,耗电量大,对反应器的设计及工艺条件控制技术要求严格;c.催化加氢法[6],在酸性环境下,使用加氢催化剂,催化NB加氢重排生成PAP。 该法流程短,能耗低,污染小,被普遍认为是未来发展的方向。
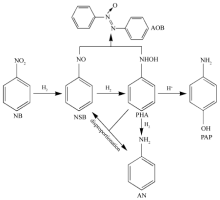
NB在酸性环境下选择性催化加氢制备PAP分为两步,即催化加氢和酸催化重排(Scheme 1)。 NB加氢生成中间体 N-苯基羟胺(PHA),PHA发生bamberger重排生成PAP;但PHA通常会继续加氢到苯胺(AN);PHA也会发生歧化的自氧化反应生成AN和亚硝基苯(NSB);另外PHA可以和NSB发生缩合反应生成氧化偶氮苯(AOB);反应路径复杂,需综合考虑催化加氢过程和酸催化重排过程,从而提高PAP的选择性。 国外已有公司采用该方法投产,国内有多家单位进行该工艺的研发。 该方法多采用较浓的硫酸(质量分数>10%)作为PHA重排的酸催化剂,存在设备腐蚀严重、后处理复杂、产品分离困难等一系列问题。 因此,开发可替代硫酸的非传统液体酸催化剂以及NB加氢合成PAP的绿色反应工艺成为研究的重点和热点。 本文将综述和评论几种可替代硫酸的非传统液体酸和绿色酸催化体系及其在NB加氢合成PAP反应中的研究进展。
Chaudhari等[7]率先报道了用固体酸代替传统液体酸的可行性,在NB加氢重排制备PAP的研究中,以离子交换树脂(Indion 130)为酸催化剂,S毒化的Pt催化剂(1%Pt-S/C)为加氢催化剂,在最佳条件下(90 g水,93.4 mmol NB,0.018 g 1%Pt-S/C,3 g Indion 130,80 ℃,0.4 MPa H2), PAP的最高收率为13.9%。 由于离子交换树脂的酸强度远低于传统液体酸(硫酸等),无法得到高产率的PAP,但固体酸易于分离、可重复使用,且过程清洁、废弃物少。
王延吉等[8]用三乙胺为模板剂,采用水热法分别在无氟和含氟体系中合成了一系列磷酸硅铝分子筛(SAPO-5),并将其与Pt/SiO2共混作为催化剂应用于NB加氢合成PAP反应中。 含氟体系制备的SAPO-5分子筛催化活性明显高于无氟体系合成的分子筛的活性,PAP最高收率可达53.2%。 HF的存在促进了Si在分子筛结构中的插入和Si(4Si)配体环境的形成,使分子筛酸量降低,但酸强度增加,较强的酸性中心可能与PHA之间具有更强的相互作用,加速了PHA由金属催化剂表面脱附并吸附于酸中心,促进了PHA的重排反应。 此外,还以Zn2+作为插入金属离子,制备了Zn改性的磷酸铝分子筛(ZnAPO),并将其与1%Pt/SiO2混合应用于NB加氢合成PAP反应的研究,PAP的收率可达到53.9%[9]。
王延吉等[10]还研究了以S2
刘平乐等[14]制备了复合金属氧化物固体酸S
王延吉等[15]以葡萄糖为碳源,经过磺化制备了一种碳基固体酸。 研究其在NB加氢制备PAP反应中的酸催化性能,以1%Pt/SiO2为加氢催化剂,115 ℃,0.4 MPa H2,0.01 g CTAB,反应4 h后NB的转化率达到76.2%,PAP的选择性为54.4%。 但循环过程中PAP的选择性显著降低,可能由于—SO3H和芳香多环间的键的断裂造成—SO3H流失以及积碳覆盖酸性位点所致。 刘迎新等[16]以淀粉、葡萄糖、蔗糖、糠醛为碳源,一步水热碳化制备碳基固体酸,研究了不同碳源对硝基苯加氢制备PAP催化活性的影响。 实验结果表明,采用的碳源不同,得到的碳基固体酸的微球形貌和微球尺寸存在一定差异。 碳基固体酸的酸密度对酸催化活性起着至关重要的作用,碳磺化后引入强酸性—SO3H基团,是主要的酸催化活性位,以淀粉为碳源的碳基固体酸表现出最高的酸密度,—SO3H数量为0.73 mmol/g,以3%Pt/C为加氢催化剂,85 ℃,0.4 MPa H2,表面活性剂存在下,反应10 h,NB转化率为61.0%时,PAP的选择性为77.8%。 该催化体系循环使用3次之后,PAP的选择性下降到10.5%,主要是因为表面酸位逐渐损失,导致PHA的酸催化重排活性降低。
鉴于镍基催化剂在NB加氢制AN中反应表现出的优异活性和成本低等优点,张利雄等[17]探索了非贵金属Ni基催化剂在NB加氢制备PAP中的催化性能,制备了介孔SBA-15负载的磺酸化的碳固体酸催化剂SO3H-C/SBA-15,具有与硫酸类似的酸性,含40%的碳,磺酸化后酸密度值达到最大,为0.62 mmol/g。当反应在Ni/SiO2和SO3H-C/SBA-15质量比为1:6,0.6 MPa H2,120 ℃,1200 r/min,CTAB存在下反应3 h,硝基苯转化率可以达到85.1%,PAP的选择性最高为23.8%。
将加氢活性组分与酸性位点结合合成双效催化剂,如固体酸负载的纳米金属催化剂。 双效催化剂的研发使NB加氢、重排合成PAP的反应研究得到了进一步的发展,加氢活性中心及酸性位的影响及协同作用成为该体系的研究热点。 Komatsu等[18]首次将过渡金属Pt、Pd、Ru、Rh、Ni、Fe、Co及Cu负载在HZSM-5(Si/Al=143)上,并讨论了该双效催化剂催化NB气相加氢制备PAP的性能。 负载型Rh、Ru、Pd和Pt催化剂的活性顺序为:Rh>Pd>Ru≈Pt,对PAP的收率顺序为Pt>Pd>Ru>Rh,Pt催化剂对PAP的选择性最高达到21%;Ni催化剂活性也很高,NB转化率达到80%,但PAP的选择性仅为1.2%。 此外,Co、Fe和Cu催化活性和选择性均很低。 在最优的条件下0.1% Pt/ZSM-5(Si/Al=130) 催化剂表现了对PAP的最佳选择性为66%。 对于双效催化剂,固体酸载体的种类对催化性能影响较大,特别是催化选择性。 SAPO-11、beta(27)、USY(137)和发光沸石(83)载体对PAP的选择性不超过1%,MCM-22(16)、镁碱沸石(17)、ZSM-11(68)及ZSM-5(117)略有提高,而 ZSM-5(117)载体对PAP的选择性达到42%。 SAPO-11和USY(137)载体由于酸性弱,对PAP的选择性低。 然而H-beta和H-MCM-22的酸性虽然比H-ZSM-5强,对PAP的选择性却低于H-ZSM-5,说明酸强度并不是决定PAP选择性的唯一因素。 载体的孔结构以及Pt粒子尺寸也是影响PAP选择性的因素之一。 分散在H-ZSM-5分子筛表面的Pt粒径越小,加氢活性就越高,导致深度加氢,PAP选择性下降。
杂多酸由于其独特的物理化学性质,被广泛用于均相和多相酸催化或氧化反应中[19]。 Keggin型杂多酸具有比传统H2SO4、Al2O3-SiO2、分子筛、酸性树脂等还强的Brønsted酸强度,在酯化反应和酯交换反应中表现出了较好的催化活性[20]。 主要缺点是杂多酸的比表面积小(<10 m2/g),不利于反应物与酸位充分接触,另一个缺点是杂多酸易溶于极性溶剂,回收困难。 为了便于杂多酸的利用及回收,通常将杂多酸负载于一些载体上,如硅胶、Al2O3、介孔硅材料等。储伟等[21]讨论了HF-SiO2、KF-SiO2、ZSM-5、SiO2、Al2O3等载体同时负载硅钨酸及Pt纳米粒子的双效催化剂的催化性能,结果表明,除了KF-SiO2和ZSM-5载体,双效催化剂均较单一负载Pt催化剂的活性高,且PAP的收率也不同程度地增加。 其中以Al2O3为载体的催化剂(Pt/PW-Al2O3)的活性、选择性最高,PAP的选择性高达79.6%。
王延吉等[22]用S2
王延吉等[23]还研究Mg改性的磷酸铝分子筛(MgAPO-5)作为载体, Pt/MgAPO-5双效催化剂的催化性能。 结果认为催化剂的酸强度与Mg含量即MgO/Al2O3的比例有关,当MgO/Al2O3比例<0.5时,弱、强酸性位点数量均随着Mg的增加而增加,且形成材料的尺寸显著变大。 在催化NB加氢合成PAP反应中,PAP的选择性取决于MgAPO-5强酸中心的数目,初始凝胶中MgO/Al2O3比为0.5条件下合成的分子筛,强酸中心数目最多,酸催化活性高,有利于PHA的重排,PAP的产率高达41.1%。 他们还制备了Mg改性的磷酸硅铝分子筛(MgSAPO),负载Pt形成双效催化剂,对PAP的收率可达到66.9%。 同时还讨论了其它离子Zn及Co掺杂对PAP收率的影响,Zn改性的磷酸硅铝分子筛(ZnSAPO)负载0.005%的Pt对PAP的收率最高,可达83%[9]。 他们还研究了Pb掺杂对催化性能的影响,用H2程序升温脱附及傅里叶变换红外光谱证实了Pb的掺杂提高了Pt在载体上的分散度以及Pt表面的电子密度。 因此,减弱NB在Pt表面的吸附,使NB的加氢速率降低;Pt表面电子密度增加,有利于PHA在催化剂表面的脱附,有效抑制了PHA进一步加氢生成AN,提高了PAP的选择性。 Pb的掺杂使PAP的收率增加将近一倍,最大达到79.6%[24]。 他们也证实了Pb掺杂对HZSM-5为载体的Pt催化剂具有相同的影响效果[25]。
刘迎新等[26]报道了几种硫酸磺化的碳基固体酸的强度及其催化性能。碳基固体酸材料酸的密度顺序为:CBSA-淀粉(0.73 mmol/g)>CBSA-葡萄糖(0.54 mmol/g)>CBSA-蔗糖(0.51 mmol/g)>CBSA-糠醛(0.39 mmol/g)。 Pt/CBSA-淀粉双效催化剂活性最高,NB转化率达到93.6%,对PAP选择性却仅为23.4%;而Pt/CBSA-糠醛的活性较低,NB转化率为55.3%,但对PAP的选择性最高,达到34.9%。说明在PHA重排生成PAP时,并不是催化剂的酸性越强越好,催化剂的加氢活性位和酸催化活性位存在一定协调作用。
宋丽娟等[27]报道了酸性分子筛SAPO-5负载非贵金属NiCoB的双效催化剂在适宜的反应条件下,使NB转化率达到90.0%,PAP收率达到45%。 他们还报道了HY负载的NiCoB催化剂使NB的转化率和PAP的选择性分别可达到65%和53%;HZSM负载NiCoB催化剂使NB的转化率和PAP的选择性分别可达到73%和60%[28]。 非贵金属双效催化剂可大幅降低催化剂成本,但PAP选择性和收率还有待提高。
功能化Brønsted酸性离子液体既具有液体酸流动性好和酸强度分布均匀的特点,又具有固体酸无挥发和低腐蚀性的特点。 在酸催化反应中具有活性高、易于分离、可循环使用及环境友好等优点[29]。 王延吉等[30]设计并制备了季铵型Brønsted酸性离子液体[HSO3-b-N(CH3)3]·HSO4(式中b=(CH2)4),并将该酸性离子液体和Pt/SiO2组合形成双效体系应用于NB加氢重排反应。 研究证实,酸性离子液体(AIL)浓度对反应转化率和产物选择性有较大的影响,当AIL浓度增加至22.5%,PAP的选择性有最大值,达到70.3%,此时NB转化率为96.5%;随着AIL浓度继续增加,PAP的选择性有所下降。 他们认为,提高酸浓度既可提高重排速率,又可加速PHA深度加氢的速度。 此外,同时加入CTAB与DMSO,可以显著抑制PHA的深度加氢,NB转化率为96.6%时,PAP的选择性达到81.4%,此数值优于相同浓度硫酸体系中的结果(NB转化率99.9%,PAP选择性为69.6%)。 而且,经分离后,离子液体和催化剂均可以循环使用,且保持活性基本不变[31]。 此外,他们还利用化学还原法在[HSO3-b-N(CH3)3]HSO4离子液体中制备了Pt纳米粒子,Pt以平均粒径约为3 nm均匀分散在离子液体中。该AIL既作为保护剂,阻止Pt纳米粒子的团聚,又提供酸性,和Pt纳米粒子组合形成双效催化体系。该催化体系在NB的加氢重排反应中表现出了较好的活性和选择性,NB转化率达到98.6%时,PAP的收率可达到75.8%。 但是,该催化体系AIL用量大(质量比AIL/NB=3.75),回收工艺复杂,循环时活性和选择性均明显下降[32]。 此外,作者还比较了多种阴离子为HS
李小年等[35]设计并合成了一系列季膦型Brønsted酸性离子液体[HSO3-b-P(Ph)3]·HSO4、[HSO3-b-P(Ph)3]·CF3SO3、[HSO3-b-P(Ph)3]·CH3(C6H4)SO3、[HSO3-b-P(C4H9)3]·HSO4,含有21 g的AIL的40 mL水溶液和20 mL的15%的H2SO4的pH值顺序为:[HSO3-b-P(Ph)3]·HSO4(0.14)<[HSO3-b-P(C4H9)3]·HSO4(0.24)<H2SO4(0.28)<[HSO3-b-P(Ph)3]·CF3SO3(0.57)<[HSO3-b-P(Ph)3]·CH3(C6H4)SO3(1.35)。 并将这些AIL与Pt/C形成双效催化体系应用于NB的加氢重排。 [HSO3-b-P(Ph)3]·HSO4的酸性最强,对PAP的选择性最高,NB转化率为86.5%时,PAP的选择性达到49%。 但由于该AIL的粘度大,不利于PHA的重排反应,效果比H2SO4中的结果差(NB转化率93.3%,PAP选择性60.2%)。 并且循环过程中活性及PAP的选择性均明显下降。
与硫酸等强酸相比,Lewis酸水溶液酸性较弱,对设备的腐蚀性小,环境污染小,并且较容易从反应体系中分离出来,不需要后处理,可应用于酸催化反应。 王延吉等[36]以Pt/SiO2、Pt/C或Pt/Al2O3为加氢催化剂,使用硫酸锌、硝酸锌、氯化锌、氯化铁、硝酸铁、硫酸锆或硝酸锆等为Lewis酸替代硫酸等强酸应用于NB加氢重排反应,PAP的收率最高可达到73%。 经过滤、分离、可有效的回收Pt/SiO2及硫酸锌,而且在循环使用中,NB转化率为100%,PAP的收率仍可达到69%。 但该体系需要金属盐的浓度较高,致使PAP的分离困难,能耗高,产品损失量大。 基于此,在反应液中加入少量乙二胺四乙酸、乙二胺四乙酸锌钠或Zn/SiO2作为反应助剂,可有效降低所需金属盐的浓度,并保证获得较高的PAP收率。 此过程可经蒸发分离出AN和部分水,然后直接冷却、结晶得到PAP,结晶母液可直接循环使用,无废液排放[37]。
宋丽娟等[38]以硫酸锌水溶液为酸性介质,使用负载型非晶态合金NiB/C催化剂进行NB催化加氢重排制备PAP,考察了反应温度、压力、时间和催化剂及硫酸锌的加入量对NB转化率和PAP的选择性的影响。 在最佳反应条件下:3 g NiB/C,4 g硫酸锌,0.5 mL NB,50 mL H2O,0.02 g CTAB,120 ℃,0.1 MPa H2,1500 r/min,3 h,NB转化率达到86.8%,但PAP的选择性仅为15.6%。 他们认为PAP选择性低的主要原因为硫酸锌的水溶液酸性较弱,不足以使NB催化加氢的中间产物PHA进行彻底的Bamberger重排生成PAP,导致PHA深度加氢生成AN。
CO2溶解在水中产生H2CO3,使水溶液呈酸性,pH值约为3,可以代替无机强酸应用于酸催化反应[39]。 反应后通过简单的泄压,水溶液基本回到中性,不需要中和,对设备无腐蚀,后处理简单,为一种环境友好的酸催化体系。 蒋景阳等[40]利用H2O-CO2体系的酸性,使用Zn粉为还原剂,还原NB生成PHA。 在无CO2时反应基本没有活性,当加入0.5 MPa CO2时,转化率可达到100%,PHA的收率增加至76%,但若CO2压力继续增加导致PHA被深度还原到AN,使PHA的收率降低。 使用NH4Cl的水溶液或在H2O-CO2体系中加入NaCl,NB转化速率较H2O-CO2体系中的高,但PHA的选择性低于77%;加入NaNO3,NB的转化率提高到71%,PHA的选择性达到97%。 加入无机盐,加快了电子的转移速度,导致反应速率加快;Cl-能加速金属的腐蚀,增大了金属的表面积,反应速度加快,但将导致PHA来不及在Zn表面上脱附,被深度加氢到AN,从而导致PHA的选择性低[41,42]。 此外,利用H2O-CO2体系的酸性催化 PHA进行Bamberger重排反应制备PAP,在50 mL水中加入0.5 mmol的PHA,在100 ℃下反应1 h,当CO2压力增加到4 MPa,PHA的转化率增加到100%,PAP的收率达到79%,CO2压力继续增加,PAP的收率保持不变[43]。 而且,PHA的浓度显著影响PAP的选择性,随着PHA浓度增加,PAP的选择性降低,PHA的浓度达到0.1 mol/L以上时,PAP的选择性降至60%以下[44]。 最近,他们还研究了H2O-CO2体系中,一系列催化剂催化NB加氢重排制备PAP反应。 Pt/C、Ru/C、Co-B、Ni-B、Raney-Ni或Co等催化剂对PAP的选择性低于14%。 Pd/C对PAP的选择性可达到61%,且收率可达53%;Pd-CaCO3-PbO/PbAc2对PAP的选择性为64%,收率为62%;Pt-Sn/Al2O3对PAP的选择性可达到79%,但收率仅为11%[45]。 我们研究了H2O-CO2体系中Pt/Al2O3催化NB的加氢重排反应,在水中不加CO2时NB完全加氢生成AN,无PAP生成;加入10 MPa CO2,PAP的选择性达到68%。 在醋酸水溶液(pH=3)中加入CO2,PAP的选择性明显提高,从26.6%提高到60%。 因此,我们认为CO2-H2O体系不但是酸性、而且可能有CO的生成对反应起到一定的作用。 在醋酸水溶液(pH=3)中加入CO的结果与加入CO2相近,证明了CO2在加氢氛围下生成的微量CO,抑制了NB及其PHA的加氢,提高了PAP的选择性。
对氨基苯酚作为一种重要的精细化工中间体,随着其在医药、染料、畜牧业等行业的日益广泛应用,需求量逐年增加,其合成方法的研究也越来越深入。 由硝基苯合成对氨基苯酚具有明显的原料优势,但该法通常以传统液体强酸为催化剂,存在腐蚀设备,污染环境等问题。 而随着环境问题的日益突出,节能减排的绿色化工过程倍受关注。 硝基苯催化加氢合成对氨基苯酚的绿色合成路线具有明显的优势,在Pt基加氢催化剂与Zr(SO4)2高温煅烧的固体酸混合的催化体系以及Pt基加氢催化剂-硫酸锌-乙二胺四乙酸体系中,对氨基苯酚的收率可以达到液体硫酸中的效果。 而且,Pt基催化剂使用量少,过程操作较为简单,是比较有发展前景的催化体系。 H2O-CO2体系操作简单,催化剂使用量少,易于分离,不需要中和及后续处理,但对PAP的收率有待进一步提高。 因此,开发高效、清洁的催化体系仍然是硝基苯加氢制备对氨基苯酚中的重点研究方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
 Mixed Catalysts for Isomerization-cracking of Heavy Alkanes by Prereduction of the Acid Function Mixed Catalysts for Isomerization-cracking of Heavy Alkanes by Prereduction of the Acid Function |
| [14] |
 Solid Acid Solid Acid |
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|