在酸性硫酸锌体系中研究了不同氯离子含量对Al/Pb-0.3%Ag-0.06%Ca复合 β-PbO2颗粒阳极行为的影响, 并通过X射线衍射(XRD)以及扫描电子显微镜(SEM)等技术手段来表征阳极的特征。 结果表明, 随着氯离子含量的增加, 阳极的析氧过电位逐渐增大;阻抗呈逐渐增大的趋势;阳极表面膜 β-PbO2和 α-PbO2衍射峰强度整体呈现出减弱的趋势;阳极氧化膜上的枝状晶簇消失;腐蚀速率逐渐增大。 当氯离子含量为300 mg/L时, 阳极具有最大的表观电流密度 i0, 表现出了最好的电化学性能以及耐腐蚀性。
The anodic behavior of Al/Pb-0.3%Ag-0.06%Ca/ β-PbO2 composite electrode in the acidic zinc sulphate containing different concentrations of Cl- was studied. The microstructures were investigated by scanning electron microscopy(SEM) and X-ray diffraction(XRD). With the increase of Cl- concentration, the oxygen evolution overpotential, impedance and corrosion rate increase gradually; the intensity of diffraction peak of β-PbO2 and α-PbO2 decreases gradually; the dendritic crystal clusters on the anode surface disappear. When the Cl- concentration is 300 mg/L, the apparent current density( i0) of the anode reaches maximum and the anode shows the best electrochemical properties and corrosion resistance.
在湿法炼锌过程中, 硫酸锌电解液中普遍存在氯离子, 而氯离子会取代PbO2晶格中的氧离子, 造成晶粒间的破坏, 加速阳极的腐蚀[1], 这不但降低了阳极的使用寿命, 而且使阴极锌中铅含量升高进而降低了锌的品质。 电解锌液中氯离子含量一般为100~300 mg/L, 然而, 随着炼锌矿的不断开采, 高品位的锌精矿越来越少, 复杂难冶炼锌矿不断增加, 这就给硫酸锌电解液的净化带来了很多困难, 进而增大了氯离子的浓度。 目前, 在很多湿法炼锌企业中, 氯离子的浓度甚至达到800~1000 mg/L[2]。 此外, 有文献[3]表明, 氯离子可以增加阳极钝化的时间, 氯离子浓度越高, 阳极钝化层形成的时间越久。 而且, 在氯离子存在的情况下, 活性点区域的溶解电位比没有氯离子的情况下更负, 也表明了氯离子对阳极有明显的去极化效果。 因此, 在含高氯的电解液中研究阳极的电化学行为显得至关重要。
不同的氯离子浓度对阳极行为产生的影响不同。 在含氯电解液中铅合金阳极会发生如下反应(1)~(3)[2], 反应(1)、(2-a)和(2-b)均会产生氯气, 极大的污染了工作环境;反应(3-a)和(3-b)会产生强氧化性的ClO-和Cl
关于Pb-Ag(质量分数0.5%~1%)阳极行为的研究[4,5]较多, 但大多数均在不含氯离子的纯硫酸锌电解液中进行, 在含氯电解液中的研究很少且都是针对传统的铅银合金阳极, 随着锌精矿品位的越来越低, 研究氯离子对阳极行为的影响就显得非常必要。 本文采用电化学方法以及XRD和SEM, 较系统地研究了新型的铝基铅合金复合 β-PbO2颗粒阳极及其在含氯离子的硫酸锌体系中电解24 h后的电化学性能、表面的物相组成和形貌。 此外, 用加速腐蚀电解的手段对其在含氯电解液中腐蚀速率进行了考察。
纯铝棒(>99.95%, 昆明理工恒达科技股份有限公司);Pb-0.3%Ag-0.06%Ca合金(昆明理工恒达科技股份有限公司); β-PbO2(昆明理工恒达科技股份有限公司)和纯铝板(99.95%)。 电解液成分为50 g/L Zn2+, 150 g/L H2SO4, 根据工业生产中的现状选取不同含量的Cl-(300、500、800和1200 mg/L), 温度为35 ℃, 电流密度为500 A/m2。 并且电解过程中, 每2 h取样测试电解液各离子的浓度并及时补充, 通过添加纯ZnSO4溶液、浓H2SO4(质量分数98%)和浓HCl (质量分数36%)使阳极处在一个稳定的环境中(50 g/L Zn2+, 150 g/L H2SO4以及特定的氯离子浓度)。
XL30ESEM-TEMP型扫描电子显微镜(荷兰Philips公司);D8-ADVANCE型X射线衍射仪(德国Bruker公司);CHI 760型三电极体系电化学工作站(上海辰华仪器有限公司)。
阳极试样的制备工艺流程如下:处理过的铝棒(磨砂→10% NaOH, 50 ℃碱洗→抛光→10% HNO3酸洗活化)→将Pb-0.3%Ag-0.06%Ca合金熔融并维持在400~500 ℃→拉拔挤压复合 β-PbO2颗粒(~280 μm)→铝基铅合金复合 β-PbO2阳极。 将制得的阳极用铜导线连接并焊锡加固, 留取1.0 cm×1.0 cm的工作面积, 其余部分用环氧树脂和聚酰胺树脂(体积比2:1)密封。 同样大小的纯铝片用作阴极。
由于本工作是要研究氯离子浓度对铝基铅合金复合 β-PbO2阳极的影响, 因此除加速腐蚀测试实验外, 其它的表征和电化学测试所用的阳极样品均是在50 g/L Zn2+、150 g/L H2SO4、不同含量的Cl-(300、500、800和1200 mg/L)体系中, 温度为(35±0.2) ℃, 电流密度为500 A/m2条件下电解24 h后的铝基铅合金复合 β-PbO2阳极样品。
电化学测试用三电极体系电化学工作站进行。 铝基铅合金复合 β-PbO2颗粒阳极作为工作电极;参比电极是饱和硫酸亚汞电极(MSE);对电极是面积为6 cm2的铂片, 工作电极与参比电极用饱和硫酸钾琼脂盐桥连接。 每次电化学测试前, 先用铬酸(30 g/L)浸洗铂片, 再用蒸馏水冲洗干净。
为了研究铝基铅合金复合 β-PbO2颗粒阳极在不同Cl-浓度的锌电解液中的腐蚀速率进而推测出阳极的使用寿命, 本文采用强化电流加速腐蚀的方法进行。 加速腐蚀测试实验阳极为铝基铅合金复合 β-PbO2颗粒材料, 阴极为纯Al板, 极间距为3 cm, 测试条件为:阳极电流密度5000 A/m2, 温度35 ℃, 不同Cl-含量(300、500、800和1200 mg/L)。 加速腐蚀测试在5 L的烧杯中进行, 电解12 h并机械搅拌。 腐蚀速率按下式(4)计算:
式中, V为腐蚀速率(g·h-1·m-2); m0为阳极电解前质量(g); m1为阳极电解后质量(g); S为阳极的实际表观表面积(m2); t为阳极极化时间(h)。
图1为铝基铅合金复合 β-PbO2颗粒阳极在电流密度为500 A/m2的体系中电解24 h后, 去离子水洗净风干后的XRD图谱。
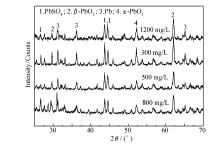 | 图1 铝基铅合金复合 β-PbO2颗粒阳极在不同氯离子含量的硫酸锌溶液中电解24 h后的XRD图谱Fig.1 XRD patterns of Al-substrate lead alloy/ β-PbO2 composite anode after 24 h electrolysis in zinc sulfate solutions with different contents of Cl- |
由图1可知, 铝基铅合金复合 β-PbO2颗粒阳极氧化层的主要物相为 α-PbO2、PbSO4、Pb和 β-PbO2。 其中, α-PbO2的择优取向从左向右分别为(011)和(231)晶面;PbSO4的择优取向从左向右分别为(021)、(212)和(140)晶面;Pb的择优取向从左向右分别为(111)、(200)和(222)晶面; β-PbO2的择优取向为(220)晶面。当氯离子含量为800 mg/L时, 阳极氧化层的主要物相为 α-PbO2和Pb, 以及少量的PbSO4和 β-PbO2。 当氯离子含量为500 mg/L时, 阳极氧化层的主要物相为 α-PbO2和PbSO4, 以及少量的Pb和 β-PbO2;但是, 与氯离子含量为800 mg/L相比, α-PbO2和 β-PbO2的衍射强度缓慢上升, PbSO4的衍射强度缓慢上升。 当氯离子含量为300 mg/L时, 阳极氧化层各物相变化较为明显, 此时的主要物相依然为 α-PbO2和PbSO4, 以及Pb和 β-PbO2;且 α-PbO2、PbSO4和 β-PbO2的衍射强度为最大值, 有文献表明[6], α-PbO2和 β-PbO2具有较低的电阻( α-PbO2为10-3 ohm·cm, β-PbO2为10-4 ohm·cm)和电子密度(约为1021 cm-3), 因此表现出优异的催化活性和较低的阻抗。 当氯离子含量为1200 mg/L时, 主要物相为 α-PbO2、PbSO4和 β-PbO2以及少量的Pb;但是 α-PbO2、PbSO4和 β-PbO2的衍射强度均有所降低, 可能是因为高含量的氯离子会降低PbO2的电极电位, 加速其溶解。
图2为铝基铅合金复合 β-PbO2颗粒阳极在电流密度为500 A/m2的体系中电解24 h后放大的SEM照片。
从图2可以看出, 不同氯离子含量下, 阳极氧化膜的微观形貌相似, 晶粒尺寸变化不明显, 孔洞较少, 表现出了良好的耐腐蚀性。 当氯离子含量为300 mg/L时, 阳极氧化膜表面较为粗糙, 与其它不同的氯离子含量相比, 在小长方体晶粒的上面有矩形微晶组成的线状晶簇, 微晶可能是 β-PbO2, 线状晶簇增大了阳极的比表面积, 因此有更好的电催化活性, 有利于析氧反应的进行。 当氯离子含量为500、800和1200 mg/L时, 阳极氧化膜表面的线状晶簇消失, 可能是因为氯离子浓度的增加加速了阳极表面的腐蚀, 使阳极表面包裹的 β-PbO2被腐蚀。当氯离子含量为800 mg/L时, 阳极氧化膜表面与氯离子含量为500 mg/L时相比变化不明显。 当氯离子含量为1200 mg/L时, 阳极表面变化较为明显, 小长方体晶粒变得很少, 可能是因为氯离子浓度太高以至于阳极氧化膜还没彻底形成就被腐蚀。
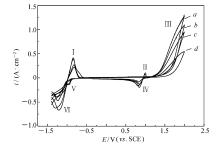
图3为铝基铅合金复合 β-PbO2颗粒阳极在电流密度为500 A/m2的体系中电解24 h后的循环伏安曲线。 从图3可以看出, 不同Cl-浓度下的循环伏安曲线均出现了两个典型的氧化峰(曲线 a和 c)和两个典型的还原峰(曲线 b和 d)[7]。 根据相关文献可知[7,8,9], 氧化峰Ⅰ代表Pb→PbSO4;氧化峰Ⅲ表示PbO→ α-PbO2, PbSO4→ β-PbO2和析氧反应;还原峰Ⅳ是 α-PbO2, β-PbO2→PbSO4;还原峰Ⅵ代表PbSO4→Pb。 与典型的循环伏安曲线相比, 明显的区别是出现了氧化峰Ⅱ和还原峰Ⅴ。 氧化峰Ⅱ是反向扫描时出现的非典型的氧化峰, 这是由于正向扫描生成的PbO2是多孔结构, PbO2孔中Pb氧化成了PbSO4, 换句话说, 只有在正向扫描生成PbO2时, 反向扫描时才会出现氧化峰Ⅱ, 但也有人认为[10], 氧化峰Ⅱ的出现是由于析氧反应破坏了的PbSO4钝化膜, 这为S
由图3可知, 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的氧化峰Ⅰ的电流密度逐渐降低, 电位缓慢向正方向移动, 有人认为[11], 该峰强度越小, 阳极的腐蚀速率越小, 则阳极的耐腐蚀性越好。 PbSO4稳定钝化区对应的电位区间是-0.5~1.1 V。 氧化峰Ⅱ电流密度逐渐减小, 当氯离子含量大于500 mg/L时, 氧化峰Ⅱ几乎消失, 电位并未发生偏移, 可以认为是由于氧化峰Ⅲ的电流密度逐渐降低, 使PbO2膜层空隙中的Pb形成PbSO4的量减少, 以及高 α-PbO2含量使氧化峰Ⅱ的强度降低, 这可以在XRD图中得到证实。 氧化峰Ⅲ的电流密度逐渐降低, 且电位逐渐向正方向移动, 这种现象可能是由于随着氯离子含量的增加, 阳极表面更不易形成氧化层。 还原峰Ⅳ的强度逐渐减小, 电位缓慢向负方向移动。 还原峰Ⅴ的电流密度也逐渐减小, 电位基本未发生移动。 还原峰Ⅵ的电流密度逐渐降低, 电位向负方向移动, 最后电流密度约0.38 A/cm2, 电位约-1.3 V。
总之, 随着氯离子含量的增加, 氧化峰和还原峰的强度都逐渐降低, 这是因为氯离子含量越高, 阳极表面氧化层的形成需要的时间越长[6]。
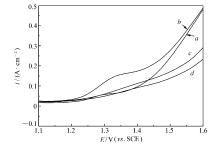
图4为铝基铅合金复合 β-PbO2颗粒阳极在电流密度为500 A/m2的体系中电解24 h后的阳极极化曲线。 从图4可以看出, 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的析氧电位先降低后升高;在电流密度为500 A/m2时, 析氧电位分别为1.279、1.237、1.278和1.303 V(MSE)。
根据Tafel方程:
式中, η为析氧反应过电位; a为Tafel图形的截矩; b为Tafel图形的斜率; i为法拉第电流密度, 即阳极极化曲线纵坐标的数值。 析氧过电位用以下公式[12]:
式中, η为析氧反应过电位; E为阳极极化曲线中相对饱和硫酸亚汞参比电极的析氧电位, 即阳极极化曲线中的横坐标数值;0.640 V表示饱和硫酸亚汞参比电极的电极电位;1.242 V代表在50 g/L Zn2+, 150 g/L H2SO4, 不同含量的Cl-(300、500、800和1200 mg/L), 温度为35 ℃的体系中, 根据能斯特方程获得的析氧平衡电位; Rs表示工作电极与参比电极之间的溶液电阻, 它既表示交流阻抗谱中半圆的起点横坐标数值, 也可以通过交流阻抗谱中等效电路的数据获得。
因此, 通过以上理论可以获得铝基铅合金复合 β-PbO2颗粒阳极的Tafel曲线( η-lg i), 再通过线性回归(Origin 8.6)可以获得曲线的截矩和斜率, 并列于表1。 其中, 当 η=0时, 通过Tafel方程可以计算得到不同氯离子含量下的电极表面交换电流密度
| 表1 铝基铅合金复合 β-PbO2颗粒阳极在不同氯离子含量的硫酸锌溶液中电解24 h后的析氧过电位和动力参数 Table 1 The overpotential and kinetic parameters of oxygen evolution reaction for Al-substrate lead alloy/ β-PbO2 composite anode after 24 h electrolysis in zinc sulfate solutions with different contents of Cl- |
从表1可知, 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的交换电流密度 i0先减小后增大。 根据电化学理论[13], i0的大小决定了电极反应的可逆性和电极极化的程度。 一般说来, i0越大电极极化越小。 当氯离子含量为300 mg/L时, 铝基铅合金复合 β-PbO2颗粒阳极的 i0最大, 这可能和电极表面的微观结构以及氯离子对阳极去极化作用的变化有关。
图5为铝基铅合金复合 β-PbO2颗粒阳极在电流密度为500 A/m2的体系中电解24 h后的交流阻抗谱。 测量电位为1.4 V, 频率扫描区间是105 Hz→10-1 Hz, 振幅为5 mV。
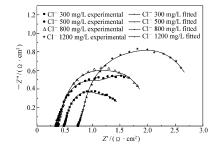 | 图5 铝基铅合金复合 β-PbO2颗粒阳极在不同氯离子含量的硫酸锌溶液中电解24 h后的交流阻抗谱Fig.5 EIS of Al-substrate Pb alloy/ β-PbO2 composite anode after 24 h electrolysis in zinc sulfate solutions with different contents of Cl- |
由图5可知, 阳极的实验数据和拟合数据吻合性很好, 有学者认为[14]这是因为铅合金阳极层的形成有以下两种方式:1)Pb→PbSO4→ β-PbO2;2)Pb→PbO→ α-PbO2→ β-PbO2。 因此, 在阳极层的形成过程中, 阳极层的阻抗是由不导电的PbSO4和不完全导电的氧化产物组成。 并且, 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的阻抗逐渐增大, 当氯离子含量为300 mg/L时, 阳极的阻抗最小, 这是由于此时阳极的氧化层更有助析氧反应的进行[15], 因此具有更好的导电性。
在酸性介质中, 析氧反应为:
根据相关文献[16], 析氧反应的机理由以下4个步骤组成:
式中, S表示阳极表面氧化物活性点, S—OHads和S—Oads是吸附中间介质。 一般认为, 步骤(9a)通常是由致密的表面形貌获得的;步骤(9b)是由破裂的表面形貌获得的。 根据以上4个步骤, 对于特定阳极的速率控制步骤与Tafel斜率 b有关。 通常情况下, 当 b≥120 mV/dec时, 步骤(8)是速率控制步骤;当 b≈40 mV/dec时, 步骤(9)是速率控制步骤;当 b≈15 mV/dec时, 步骤(10)是速率控制步骤[17]。
由表1可知, 在不同氯离子含量下根据阳极极化曲线作Tafel拟合的 b值均大于120 mV/dec, 因此, 步骤(8)控制着铝基铅合金复合 β-PbO2颗粒阳极的表面反应。 通过Zsimpwin软件, 可以获得如图6所示的等效电路图用来模拟电极析氧反应的机理[6,18]。 其中, Rs为工作电极与参比电极之间的溶液电阻, Cf和 Rf分别为氧化层的电容和电阻, Cdl为电极与电解液相间的双电层电容, Rt为电极反应的传递电阻, Ra和 Ca分别为吸附的中间介质S—OHads的电阻和电容。
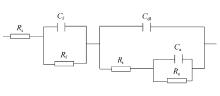 | 图6 用于模拟析氧反应机理的等效电路图Fig.6 Electrical equivalent circuit used to simulate the mechanism of oxygen evolution reaction |
不同氯离子含量的硫酸锌电解液下, 铝基铅合金复合 β-PbO2颗粒阳极交流阻抗谱的等效电路参数如表2所示。 由表2可知, Cf、 Rf和 Ra起主要作用。 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的 Cf先大幅度减小后增大; Rf和 Ra逐渐增大, 当氯离子含量为300 mg/L时最小, 说明此时阳极表面的PbO2层更易于吸附中间介质(S—OHads); Cdl逐渐减小, 当氯离子含量为300 mg/L时最大, 这说明此时阳极表面更易于吸收离子, 例如HS
| 表2 不同氯离子含量下铝基铅合金复合 β-PbO2颗粒阳极交流阻抗谱的等效电路参数 Table 2 Equivalent circuit parameters of Al-substrate Pb alloy/ β-PbO2 composite anode corresponding to the EIS spectra in different content of Cl- |
有文献[12]报道阳极的粗糙度( RF)可以通过式(11)计算得到:
式中, C*代表一个电容参比值, 对于光滑的汞电极, C*为20 μF/cm2。 RF可以用来表征电极的微观形貌, RF越大说明粗糙度越大[19]。 以式(11)可以得到Al/Pb-0.3%Ag-0.06%Ca复合 β-PbO2颗粒阳极在不同氯离子含量下的 RF值分别为5550、4500、3350和2500, 可以推断出在Cl-为300 mg/L时Al/Pb-0.3%Ag-0.06%Ca复合 β-PbO2颗粒阳极的表面最粗糙, 比表面积最大, 这和扫描电子显微镜的分析结论相吻合。
表3为铝基铅合金复合 β-PbO2颗粒阳极在1.3节所列的条件下电解24 h的腐蚀速率。
| 表3 铝基铅合金复合 β-PbO2颗粒阳极在不同氯离子含量的硫酸锌溶液中的腐蚀速率 Table 3 Corrosion rate of Al-substrate Pb alloy/ β-PbO2 composite anode with different content of Cl- in zinc sulfate solutions |
从表3可以看出, 随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的腐蚀速率逐渐增大。 当氯离子含量为300 mg/L时, 铝基铅合金复合 β-PbO2颗粒阳极的腐蚀速率最小为3.708 g/(h·m2);当氯离子含量大于500 mg/L时, 阳极的腐蚀速率变化较小。 结合生产中的实际情况控制溶液中氯离子浓度在一个可以接受的范围内是非常必要的。
随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的析氧过电位逐渐升高, 表观电流密度呈现出增大的趋势, 阻抗逐渐增大;当氯离子含量为300 mg/L时, 阳极的表观电流密度最大为2.742×10-4 A/cm2, 表现出了最好的电催化活性和导电性。 阳极表面氧化膜的物相主要为 α-PbO2、PbSO4、Pb和 β-PbO2。 而且, 随着氯离子含量的增加, 阳极表面氧化膜的 α-PbO2和 β-PbO2的衍射强度整体呈现逐渐减小的趋势, 当氯离子浓度为300 mg/L时为最大。 不同氯离子含量下, 阳极氧化膜的微观形貌相似, 孔洞较少, 均表现出了良好的耐腐蚀性。 当氯离子含量为300 mg/L时, 在小长方体晶粒的上面有矩形微晶组成的线状晶簇, 表面更加粗糙, 此时的阳极有更大的比表面积, 因此有更好的电催化活性, 有利于析氧反应的进行。随着氯离子含量的增加, 铝基铅合金复合 β-PbO2颗粒阳极的腐蚀速率逐渐增大;氯离子含量为300 mg/L时, 阳极的腐蚀速率最小。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|