共同通讯作者 张学全, 研究员; Tel: 0431-85262303; Fax: 0431-85262303; E-mail: xqzhang@ciac.ac.cn; 研究方向: 烯烃可控聚合
合成了一系列吡唑亚胺二齿Ni(Ⅱ)配合物(4a~4e), 并通过红外光谱、元素分析及单晶衍射等对配合物进行了表征。 配合物4b属于单斜晶系, 以Ni原子为中心形成扭曲的三角双锥构型。 该系列配合物在倍半乙基氯化铝(EASC)的活化下, 对1, 3-丁二烯聚合表现出较高的顺-1, 4选择性, 得到了相对分子质量为4500~9000、顺-1, 4含量在91%左右的液体聚丁二烯。 随着取代基空间位阻的增大, 催化活性逐渐减低。 进一步详细研究了Al/Ni摩尔比和温度对聚合的影响。 在20~60 ℃范围内, 催化活性随着聚合温度的升高而提高, 聚合温度为80 ℃时, 聚合物收率仅略有降低, 表明该系列催化剂产生的活性中心具有良好的高温稳定性。
Co-corresponding author: ZHANG Xuequan, professor; Tel: 0431-85262303; Fax: 0431-85262303; E-mail: xqzhang@ciac.ac.cn; Research interests: olefin controllable polymerization
A series of NN-bidentate nickel(Ⅱ) complexes bearing pyrazolylimine ligands(4a~4e) was synthesized and characterized by FTIR and elemental analysis. Determined by X-ray single crystal diffraction, complex 4b adopted distorted trigonal bipyramidal geometry around the central metal. Activated by ethylaluminum sesquichloride(EASC), all complexes exhibited high cis-1, 4 selectivity towards 1, 3-butadiene polymerization to afford liquid polybutadienes(PB) with relative molecular mass of 4500~9000 and 91% cis-1, 4 content. The catalytic activity of the complex decreased as the hindrance of the substituent on the ligand increased. The effects of Al/Ni molar ratio and polymerization temperature on the polymerization were further investigated in details. The catalytic activity increased with the increase of polymerization temperature from 20 ℃ to 60 ℃, and the polymer yield only slightly decreased even at a high temperature of 80 ℃, indicating high thermal stability of the active species generated by the present catalytic system.
液体橡胶作为合成橡胶的一个重要品种, 可用于制造密封胶和胶黏剂等产品[1,2,3]。 其中二烯烃(丁二烯、异戊二烯)类液体橡胶因其与天然橡胶和顺丁橡胶等有良好的相容性, 可替代低分子油类作为这些橡胶的增塑剂或软化剂, 并可在硫化过程中参与交联反应。 这种反应型增塑剂在制品中不会发生迁移、挥发, 也不会被溶剂抽出, 从而使硫化胶获得良好的物理机械性能和化学稳定性。
目前, 二烯类液体橡胶主要采用自由基和阴离子聚合技术制备, 但聚合物的立构规整性不能得到很好的控制[4,5,6,7]。 采用配位聚合方法, 可制备高顺-1, 4结构含量的液体橡胶。 本实验室曾采用吡啶双亚胺酰氯Ni(Ⅱ)/倍半乙基氯化铝(EASC)[8]和Nd(O i-Pr)3/AlR3/RCl[9]催化体系制备了液体聚丁二烯, 但顺-1, 4结构含量均偏低(<80%)。 本文合成了一系列新型吡唑亚胺Ni(Ⅱ)配合物, 在倍半乙基氯化铝(EASC)活化下催化丁二烯聚合, 制备了相对分子质量为4500~9000、顺-1, 4结构含量为89.5%~91.1%的液体聚丁二烯, 并考察了配体空间位阻、聚合时间和温度等条件对丁二烯聚合的影响。
所用溶剂均经二苯甲酮/钠或氢化钙回流后蒸出使用。 1, 3-丁二烯由中国石油锦州分公司提供, 用前经串联的氢氧化钠和硅胶柱精制; 2, 6-二甲基苯胺(Aladdin), 纯度97%; 二氯亚砜, 纯度99.5%; 苯甲酰氯, 纯度99.5%(Aladdin); 三乙胺, 纯度99%(北京试剂厂); NiBr2·DME, 纯度97%(德国Aldrich公司); 2, 6-二异丙基苯胺, 纯度90+%; 吡唑, 纯度98%; 3, 5-二甲基吡唑, 纯度99%; 3, 5-二苯基吡唑, 纯度98%(美国Alfa公司), 直接使用; 倍半乙基铝(Al2Et3Cl3, EASC)购于Akzo Nobel公司, 经甲苯稀释至1.0 mol/L后使用。
BRUKE Vertex-70型傅里叶红外光谱仪(德国布鲁克公司), KBr涂膜; Unity-400型核磁共振仪(美国Varian公司), 以CDCl3或DMSO为溶剂, TMS为内标; Waters 515型凝胶渗透色谱仪(美国Waters公司), 以四氢呋喃为流动相, 流速为1.0 mL/min, 以窄分布聚苯乙烯标准样品为内标; Series II CHN/O 2400型元素分析仪(美国PERKIN ELMER 公司)。 Bruker Smart Apex型X射线单晶衍射仪(德国布鲁克公司), 低温(-88.5 ℃)或常温下测定。 CCD检测器, Mo Kα射线为光源, 波长为0.071073 nm。 晶系和晶胞参数等由SMART程序确定, 用SAINT和SADABS对衍射数据进行初步处理, 采用SHELXTL-97软件解出。
配体3a~3e按文献[10]方法制备, 配体3a~3e和配合物4a~4e的合成路线见Scheme 1。
配体3a的合成: 室温下将2, 6-二甲基苯胺(3.2 g, 26.4 mmol)加入到50 mL四氢呋喃溶剂中, 加入三乙胺(4.2 mL, 30 mmol), 通过恒压漏斗滴加苯甲酰氯(2.8 mL, 24 mmol), 于室温下搅拌12 h。 反应结束后, 过滤掉Et3N·HCl, 减压除去四氢呋喃, 得到的固体经己烷洗两次后, 过滤、干燥, 得到白色固体1a(5.2 g), 产率96.3%。 化合物1a(2 g, 8.9 mmol)置于50 mL甲苯中, 向其中滴加二氯亚砜(1 mL, 13.3 mmol), 于80 ℃回流反应4 h, 减压除去未反应的二氯亚砜和甲苯, 加入50 mL甲苯、三乙胺(1.5 mL, 10.8 mmol)和吡唑(0.61 g, 8.9 mmol), 于室温反应12 h。 反应结束后, 过滤除去Et3N·HCl, 减压除去溶剂, 所得固体用正己烷重结晶, 得到黄绿色晶体3a(0.53 g), 产率21.6%。元素分析实测值(C18H17N3计算值)/%: C 78.34(78.52), H 6.26(6.22), N 15.4(15.26)。1H NMR(400 MHz, DMSO), δ: 8.68(s, 1H, Pz—H); 7.74(s, 1H, Pz—H); 7.36~6.78(m, 8H, Ar—H), 1.99(s, 6H, Ar—CH3)。
配体3b的合成方法与3a相同, 收率55.2%。 元素分析实测值(C20H21N3计算值)/%: C 79.12(79.17), H 7.01(6.98), N 13.87(13.85)。1H NMR(400 MHz, CDCl3), δ: 7.29~7.12(m, 5H, Ar—H); 6.91~6.82(m, 3H, Ar—H); 6.05(s, 1H, Pz—H); 2.62(s, 3H, Pz—CH3); 2.22(s, 3H, Pz—CH3); 2.06(s, 6H, Ar—CH3)。
配体3c的合成方法与3a相同, 收率25.2%。 元素分析实测值(C22H25N3计算值)/%: C 79.68(79.72), H 7.61(7.6), N 12.71(12.68)。1H NMR(400 MHz, DMSO), δ: 8.61(s, 1H, Pz—H); 7.76(s, 1H, Pz—H); 7.64~6.98(m, 8H, Ar—H); 6.63(s, 1H, Pz—H); 2.84(s, 2H, i-Pr—H); 1.06~0.89(d, 12H, i-Pr—CH3)。
配体3d的合成方法与3a相同, 收率60.1%。 元素分析实测值(C24H29N3计算值)/%: C 80.11(80.18), H 8. 08(8.13), N 11.81(11.69)。1H NMR(400 MHz, DMSO), δ: 7.28~6.99(m, 8H, Ar—H); 6.18(s, 1H, Pz—H); 3.24(s, 3H, Pz—CH3); 2.89(m, 2H, i-Pr—H); 2.09(s, 3H, Pz—CH3); 1.07~0.89(d, 12H, i-Pr—CH3)。
配体3e的合成方法与3a相同, 收率15.2%。 元素分析实测值(C34H33N3计算值)/%: C 84.39(84.43), H 6.91(6.88), N 8.68(8.69)。1H NMR(400 MHz, DMSO), δ: 7.8~6.94(m, 18H, Ar—H); 2.73(m, 2H, i-Pr—H); 1.23~0.73(m, 12H, i-Pr—CH3)。
配合物4a的合成: 参照文献[8]方法, 在N2气保护下, 向装有搅拌子的圆底烧瓶中依次加入配体3a(0.2 g, 0.73 mmol)、NiBr2·DME(0.224 g, 0.73 mmol)和THF(3 mL), 搅拌4 h, 减压抽去部分溶剂, 加入大量乙醚后析出沉淀, 过滤得到浅绿色粉末, 经真空干燥处理, 产率82%。 元素分析实测值(C18H17N3Br2Ni计算值)/%: C 43.51(43.78), H 3.36(3.47), N 8.36(8.51)。 FTIR(KBr), σ/cm-1: 2926, 2856, 1636, 1533, 1492, 1446, 1403, 1360, 1320, 1209, 1164, 1096, 1059, 1001, 945, 913, 767, 702。
配合物4b的合成方法与4a类似。 由配体3b与NiBr2·DME在THF中反应得到黄棕色粉末, 收率77.9%。 元素分析实测值(C20H21N3Br2Ni计算值)/%: C 45.89(46.03), H 3.92(4.06), N 7.88(8.05)。 FTIR(KBr), σ/cm-1: 3110, 3045, 3002, 2924, 1615, 1591, 1567, 1494, 1443, 1386, 1365, 1214, 1176, 1160, 1123, 1092, 1059, 992, 921, 846, 832, 797, 780, 746, 703。
配合物4c的合成方法与4a类似。 由配体3c与NiBr2·DME在THF中反应得到淡绿色粉末, 收率71.2%。 元素分析实测值(C22H25N3Br2Ni计算值)/%: C 47.93(48.05), H 4.49(4.58), N 7.51(7.64)。 FTIR(KBr), σ/cm-1: 2974, 2945, 2865, 1638, 1534, 1492, 1458, 1425, 1406, 1381, 1357, 1328, 1210, 1158, 1094, 1059, 1002, 945, 915, 773, 706。
配合物4d的合成方法与4a类似。 由配体3d与NiBr2·DME在THF中反应得到紫红色粉末, 收率80.1%。 元素分析实测值(C24H29N3Br2Ni计算值)/%: C 49.77(49.87), H 5.9(5.06), N 7.11(7.27)。 FTIR(KBr), σ/cm-1: 2965, 2869, 1612, 1562, 1489, 1458, 1447, 1383, 1362, 1335, 1319, 1205, 1178, 1155, 1131, 1099, 1066, 992, 933, 819, 797, 771, 749, 717。
配合物4e的合成方法与4a类似。 由配体3e与NiBr2·DME在THF中反应得到浅绿色粉末, 收率65.8%。 元素分析实测值(C34H33N3Br2Ni计算值)/%: C 58.93(58.16), H 4.63(4.74), N 5.89(5.98)。 FTIR(KBr), σ/cm-1: 2971, 2865, 1625, 1560, 1508, 1486, 1460, 1403, 1349, 1327, 1307, 1281, 1173, 1154, 1080, 1026, 941, 921, 804, 757, 727, 693。
聚合反应在经真空烘烤并充氮气处理的30 mL安瓿瓶中进行。 按照催化剂、1, 3-丁二烯/甲苯溶液、EASC/甲苯溶液的顺序依次加入到安瓿瓶中, 在设定温度的水浴中聚合至给定时间后, 用含有1% 2, 6-二叔丁基-4-甲基苯酚及少量盐酸的乙醇溶液终止聚合反应, 将其倒入约50 mL乙醇中搅拌, 静置过夜, 倒出上层乙醇溶液, 得到白色油状物置于真空干燥箱中干燥至恒重。
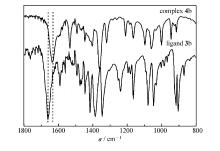
FTIR表征发现, 配体3b中C=N基团伸缩振动吸收峰出现在1661~1651 cm-1(图1); 配合物4b的C=N基团伸缩振动吸收峰向低频方向移动, 出现在1636~1614 cm-1处; 表明C=N基团的N原子与Ni发生了配位。
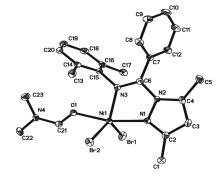
配合物的结构对催化剂的活性及选择性有着深远的影响, 为此对其结构进行精确表征, 其中配合物4b得到了单晶。 配合物4b的单晶由乙醚向其DMF饱和溶液缓慢扩散获得, 晶体结构与选取的部分键长和键角数据如图2所示。 配合物4b属于单斜晶系P21/c空间群, 具有近似Cs对称性, 呈扭曲三角双锥构型, 以N3、Br1、Br2构成赤道平面, O1和N1位于轴向位, 处于三角双锥2个顶点位置。 Ni与N3、N1、O的配位键长分别为0.2062(2)、0.2060(3)和0.2038(2) nm; N1—Ni—N3、Ni—N1—C15和Ni—N3—C2夹角分别为76.88°、121.28°和139.3°。
以EASC为助催化剂, 考察了吡唑亚胺Ni(Ⅱ)配合物催化丁二烯的聚合行为。 从表1可见, 中心金属的配位环境对催化活性影响较大。 随着配体吡唑上取代基的改变(H, 4c; Me, 4d; Ph, 4e), 聚合物收率由66.8%降低至19.6%, 这是由于空间位阻所致。 另一方面, 配体空间位阻的不同基本未影响所得聚合物的立构规整性, 其顺-1, 4结构含量均为90%左右。
| 表1 不同取代基的镍配合物/EASC催化丁二烯聚合结果 Table1 1, 3-Butadiene polymerization with 4a~4e/EASC a |
选用配合物4d为主催化剂, 研究了反应温度和时间对聚合的影响。 由表2可以看出, 随着聚合温度的升高, 聚合物收率逐渐提高, 60 ℃时达到最大值83.7%。 进一步升高温度至80 ℃, 聚合物收率略有降低(79.7%)。 通常后过渡金属催化剂温度耐受性差, 如吡啶双亚胺铁/Al( iBu)3催化剂进行丁二烯聚合, 当反应温度由20 ℃提高至60 ℃, 聚合物收率由99%降低至40%[11]。 这表明该催化体系具有良好的高温稳定性。 同时, 所得聚合物的顺-1, 4含量下降。 在20 ℃时, 所得聚合物的顺-1, 4含量为90.6%; 80 ℃时顺-1, 4含量降至64.8%。 这是由于随着温度升高, 对式烯丙基(anti)向热力学更稳定的同式烯丙基(syn)转变所致。 随着温度的升高, 聚合物相对分子质量逐渐降低, 且分布逐渐变宽, 这是由于高温下链转移反应加剧导致的。 随着聚合时间的延长, 聚合物的顺-1, 4含量略有降低。 这也是由于丁二烯聚合过程中anti-syn构型转换引起的, 在较高单体浓度下易形成anti-构型; 随反应进行, 丁二烯浓度减小使得丁二烯聚合速率下降, 因此anti-构型有充分时间向syn-构型转换, 从而导致反-1, 4含量增加[12,13]。
| 表2 聚合温度和时间对4d/EASC催化丁二烯聚合的影响 Table 2 Effects of temperature and time on 1, 3-butadiene polymerization with 4d/EASC a |
由表3可见, 随着Al/Ni摩尔比的增加, 聚合物收率逐渐提高, 这是由于所生成活性中心数目增加所致。 同时聚合物相对分子质量逐渐下降, 且分布变宽, 这可能是由于高分子链向EASC链转移造成的。 EASC用量基本未影响催化剂的选择性, 所得聚合物的顺-1, 4含量均在90%左右。
| 表3 Al/Ni摩尔比对4d/EASC催化丁二烯聚合的影响 Table 3 Effect of Al/Ni molar ratio on 1, 3-butadiene polymerization with 4d/EASC a |
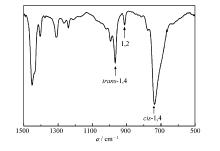 | 图3 聚丁二烯的红外谱图Fig.3 IR spectrum of polybutadiene(Run 8,Table 2) |
采用FTIR对所得聚丁二烯进行了结构表征。图3为所得聚丁二烯(Run 8,表2)的FTIR谱图, 其中738、911和967 cm-1分别为顺-1, 4、1, 2和反-1, 4结构的特征吸收峰。 根据各吸收峰强度计算得出聚合物的顺-1, 4、1, 2和反-1, 4结构含量分别为88%、2.3%和9.7%。为了验证FTIR的结果, 进一步以1H NMR对聚合物进行表征(图4)。 δ 5.40和 δ 4.98处分别为1, 4-和1, 2-结构的共振峰, 根据各特征峰积分面积比计算得出聚合物的1, 4-和1, 2-结构含量分别为97.2%和2.7%。
由于1H NMR 谱图不能区分聚合物中的顺-1, 4和反-1, 4结构, 因此进一步通过13C NMR 对该聚合物进行表征。图5中, 顺-1, 4, 反-1, 4结构的特征峰分别位于 δ 129.6和130.1处, 双键相邻的—CH2的特征峰分别位于 δ 27.45和32.74处; 1, 2-PB中-CH+和=CH2的特征峰分别在 δ 142.5和114.2处。 计算得出所得聚丁二烯顺-1, 4、反-1, 4和1, 2结构含量分别为88.3%、9.0%和2.7%, 与FTIR和1H NMR计算结果一致。
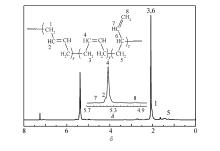 | 图4 聚丁二烯的1H NMR谱图Fig.4 1H NMR spectrum of polybutadiene(Run 8,Table 2) |
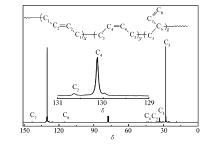 | 图5 聚丁二烯13C NMR谱图Fig.5 13C NMR spectrum of polybutadiene(Run 8,Table 2) |
合成了一系列吡唑亚胺Ni(Ⅱ) 配合物, 并对其进行了表征。 该系列配合物经EASC活化, 可制备相对分子质量为4500~9000、顺-1, 4含量为89.5%~91.1% 的液体聚丁二烯。 配体的空间位阻对配合物的催化活性有较大影响, 随取代基空间位阻的增加, 聚合物收率下降。 随聚合温度的升高, 聚合物收率增加, 在聚合温度为80 ℃时, 聚合物收率仅略有降低, 表明该催化体系具有良好的高温稳定性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|