发展一种简单、高效的铜催化活泼烯烃氰烷基化成环合成吲哚酮的方法。 在CuI/DTBP(叔丁基过氧化物)催化作用下, N-芳基丙烯酰胺类化合物与 α-氰基偶氮试剂发生自由基环化反应, 高效地合成了一系列含 α-氰基季碳中心的吲哚酮, 并探讨了其反应机理。 该方法底物适用范围较广、反应体系温和, 催化体系廉价。
A practical, mild and highly efficient cyanoalkylation reaction of activated alkenes by copper catalysis has been developed. In the presence of CuI/DTBP(Di-tert-butyl peroxide), N-arylacrylamide undergoes radical cyclization smoothly, and affords a series of pharmaceutically important oxindoles bearing an α-cyano quaternary carbon center. The protocol features broad substrate scope, simplicity of operation and handling, and inexpensive catalytic systems. In addition, the synthetic application and possible mechanism process in the cyclization reaction were also demonstrated.
发展高效、条件温和、环境友好的C—C键构建方法, 是当今众多有机化学家研究的一个热门领域[1,2]。 在这一研究领域, 近年来廉价金属(如铜、铁等)催化的烯烃串联自由基双官能团化“一步”构筑双重碳-碳键得到了非常多的关注。 目前, 此类自由基双官能团化反应中常用的自由基前体有重氮盐、肼类、芳基碘鎓盐类、三氟甲基类试剂等[3,4,5,6,7,8,9,10]。 烷基偶氮试剂(如AIBN)是一类原料易得, 低毒的化合物, 它们能在较温和的温度条件下分解, 释放出氮气生成烷基自由基。 但是, 烷基偶氮试剂参与的烯烃自由基双官能团化反应报道不多[11]。 基于近年来 N-芳基丙烯酰胺双官能团化合成吲哚酮的研究发现[4], 本文拟发展一种 α-氰烷基偶氮试剂参与的 N-芳基丙烯酰胺环化合成含氰吲哚酮的反应。
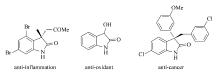
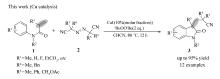
众所周知, 吲哚酮及其衍生物广泛分布在自然界中, 是许多潜在生理活性化合物的重要构建骨架(Scheme 1)[12]。 含氰化合物也是非常重要的一类合成中间体, 在一定条件下能转化为氨、醛、羧酸、酮、酰胺等一系列其它基团。 因此通过烯烃双官能团反应在吲哚酮骨架中引入含氰基团将具有重要合成意义。 2012年, 刘国生教授[13]报道了一例先驱性的工作, 他们利用钯/银体系催化 N-芳基丙烯酰胺和乙腈发生双重碳-氢键断裂环化生成含氰吲哚酮, 但其反应所需的Pd/Ag催化体系价格较昂贵, 不利于大规模生产。 最近, 游劲松和朱成建教授[14,15]分别报道了铜/铁催化的烯烃与乙腈氰甲基化合成吲哚酮的方法, 但反应需要较高温条件(120 ℃)在一定程度上限制了其广泛应用。 此外, 由于叔腈具有较大的位阻, 且其 α-C—H键比较惰性, 以上报道的方法通常不能使用此类腈试剂通过碳-氢活化在吲哚酮骨架中引入 α-氰季碳中心。 因此发展一种可供选择的, 且条件温和、操作简单的含 α-氰季碳中心的吲哚酮合成方法目前仍然具有重要的意义。 基于我们在合成吲哚酮方面的研究兴趣[16,17], 本文发展了一种廉价铜催化的活泼烯烃与含氰偶氮试剂双官能团环化合成含氰吲哚酮反应(Scheme 2)。 此方法首次实现了在吲哚酮骨架中引入 α-氰季碳中心, 因此具有重要的合成意义。
所用的苯胺、草酰氯、二氯甲烷、乙腈试剂均购自阿拉丁试剂公司, 偶氮异丁腈(AIBN) 和1, 1-偶氮双(环己烷-1-甲腈)购自百灵威试剂公司, 除标明外均为分析纯试剂。 AVANCE 400 MHz型超导傅里叶数字化核磁共振仪(瑞士Bruker公司), 内标为TMS; GC-MS-QP2010型质谱仪(日本岛津公司); XT5A型显微熔点仪(北京市科仪电光学仪器厂)。
实验中所需的原料 N-芳基丙烯酰胺参照相关文献[5]报道方法合成得到。
以产物3a合成为例, 取87.5 mg(0.5 mmol) N-芳基丙烯酰胺1a溶于2 mL乙腈中, 加入9.6 mg(0.05 mmol) 的碘化亚铜和244 mg(1.0 mmol)的 1, 1-偶氮双(环己烷-1-甲腈), 加入146 mg(1.0 mmol)的叔丁基过氧化物, 在80 ℃下搅拌12 h。 经TLC检测反应完全后, 经柱层析分离, 石油醚-乙酸乙酯梯度洗脱, 得到最终目标产物3a为一种白色固体。
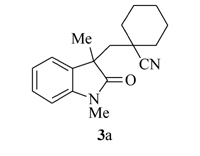
产物3a: 白色固体, mp 158~159 ℃。1H NMR(400 MHz, CDCl3), δ: 7.32~7.28(m, 2H), 7.06(t, J=7.6 Hz, 1H), 6.87(d, J=8.0 Hz, 1H), 3.21(s, 3H), 2.39(d, J=14.4 Hz, 1H), 2.14(d, J=14.4Hz, 1H), 1.64~1.03(m. 10H), 1.31(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.8, 143.0, 131.3, 128.5, 124.6, 122.4, 122.1, 108.5, 46.7, 46.6, 38.1, 37.0, 35.0, 27.7, 26.4, 24.8, 22.8, 22.5; IR(KBr), σ/cm-1: 2231, 1701, 1614, 1471; HRMS m/z(ESI)计算值C18H23N2O[M+H]+: 283.1805, 实测值: 283.1808。
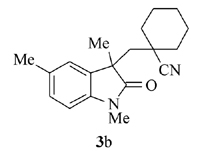
产物3b: 黄色固体, mp 145~146 ℃。1H NMR(400 MHz, CDCl3), δ: 7.11(s, 1H), 7.07(d, J=7.6 Hz, 1H), 6.74(d, J=8.0 Hz, 1H), 3.17(s, 3H), 2.31(s, 3H), 2.25(d, J=14.8 Hz, 1H), 2, 11(d, J=14.8 Hz, 1H), 1.28~1.09(m, 10H), 1.28(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.8, 140.6, 131.8, 131.2, 128.6, 125.5, 122.2, 108.1, 46.7, 46.5, 38.1, 37.0, 34.8, 27.8, 26.4, 24.8, 22.7, 22.5, 21.2; IR(KBr), σ/cm-1: 2233, 1706, 1617, 1496; HRMS m/z(ESI)计算值C19H25N2O[M+H]+: 297.1962, 实测值: 297.1965。
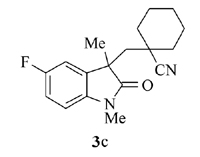
产物3c: 黄色固体, mp 150~151 ℃。1H NMR(400 MHz, CDCl3), δ: 7.05~ 6.97(m, 2H), 6.81~6.77(m, 1H), 3.20(s, 3H), 2.39(d, 14.8 Hz, 1H), 2.19(d, J=14.8 Hz, 1H), 1.52~0.99(m, 10H), 1.31(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.4, 159.1(d, J=241 Hz), 139.0, 133.0(d, J=7.8 Hz), 121.9, 114.6, 112.6(d, J=24.5 Hz), 108.9(d, J=7.1 Hz), 47.1, 46.6, 38.1, 36.9, 35.3, 27.6, 26.5, 24.5, 22.7, 22.5; IR(KBr), σ/cm-1: 2234, 1713, 1621, 1451; HRMS m/z(ESI)计算值C18H22FN2O[M+H]+: 301.1711, 实测值: 301.1714。
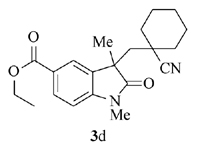
产物3d: 黄色固体, mp 140~141 ℃。1H NMR(400 MHz, CDCl3), δ: 8.05(dd, J=8.4 Hz, 1.6 Hz, 1H), 7.90(s, 1H), 6.90(d, J=8.4 Hz, 1H), 4.34(q, J=6.8 Hz, 2H), 3.25(s, 3H), 2.32(d, J=14.4 Hz, 1H), 2.25(d, J=14.4 Hz, 1H), 1.61~0.98(m, 10H), 1.37(t, J=7.2 Hz, 3H), 1.35(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.9, 166.3, 147.2, 131.5, 131.1, 125.4, 124.6, 121.6, 108.0, 60.9, 46.7, 46.6, 37.9, 36.9, 36.1, 27.5, 26.6, 24.8, 22.7, 22.5, 14.3; IR(KBr), σ/cm-1: 2235, 1726, 1701, 1612, 1475; HRMS m/z(ESI)计算值C21H27N2O3[M+H]+: 355.2017, 实测值: 355.2019。
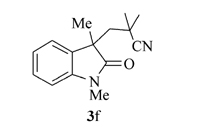
产物3f: 无色固体, mp 100~101 ℃。1H NMR(400 MHz, CDCl3), δ: 7.40~7.25(m, 2H), 7.09(t, J=6.0 Hz, 1H), 6.90(d, J=6.4 Hz, 1H), 3.23(s, 3H), 2.32(d, J=11.6 Hz, 1H), 2.16(d, J=11.6, 1H), 1.34(s, 3H), 1.13(s, 3H), 1.08(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.5, 143.1, 130.9, 128.6, 124.6, 123.9, 122.4, 108.5, 47.0, 46.5, 30.7, 29.6, 27.4, 26.8, 26.4; IR(KBr), σ/cm-1: 2234, 1716, 1610, 1432, 1378, 1335; HRMS m/z(ESI)计算值C15H19N2O[M+H]+: 243.1492, 实测值: 243.1495。
产物3g: 黄色固体, mp 80~81 ℃。1H NMR(400 MHz, CDCl3), δ: 7.40~7.20(m, 7H), 7.05(t, J=7.2 Hz, 1H), 6.83(d, J=8.0 Hz, 2H), 5.12(d, J=15.6 Hz, 1H), 4.72(d, J=15.6 Hz, 1H), 2.36(d, J=14.8 Hz, 1H), 2.22(d, J=14.4 Hz, 1H), 1.40(s, 3H), 1.19(s, 3H), 1.03(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.7, 142.3, 130.8, 128.7, 128.5, 127.7, 127.6, 124.8, 124.1, 122.4, 119.9, 109.5, 47.0, 46.2, 44.1, 30.8, 29.7, 28.1, 26.3; MS IR(KBr), σ/cm-1: 2233, 1701, 1610, 1432, 1376, 1332; HRMS m/z(ESI)计算值C21H23N2O[M+H]+: 319.1805, 实测值: 319.1801。
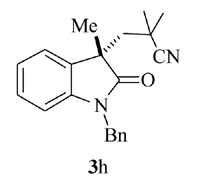
产物3h: 黄色固体, mp 121~122 ℃。1H NMR(400 MHz, CDCl3), δ: 7.50~7.48(m, 7H), 7.18( t, J=8.0 Hz, 1H), 6.96(d, J=8.0 Hz, 1H), 3.22(s, 3H), 2.82(d, J=14.4 Hz, 1H), 2.49(d, J=14.4 Hz, 1H), 1.23(s, 3H), 1.18(s, 3H);13C NMR(101 MHz, CDCl3), δ: 177.4, 144.1, 140.7, 140.4, 129.4, 128.0, 127.5, 125.4, 124.2, 123.8, 122.5, 108.9, 54.6, 46.6, 30.7, 30.2, 29.0, 28.7; IR(KBr), σ/cm-1: 2234, 1713, 1611, 1470, 1372, 1341; HRMS m/z(ESI)计算值C17H21N2O[M+H]+: 269.1649, 实测值: 269.1653。
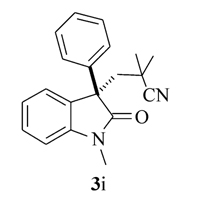
产物3i: 黄色油状物。1H NMR(400 MHz, CDCl3), δ: 7.37(m, 2H), 7.07(t, J=7.6 Hz, 1H), 6.90(d, J=8.4 Hz, 1H), 4.34(d, J=10.4 Hz, 1H), 4.00(d, J=10.8 Hz, 1H), 3.24(s, 3H), 2.28(s, 2H), 1.90(s, 3H), 1.17(s, 3H), 1.10(s, 3H);13C NMR(101 MHz, CDCl3), δ: 176.3, 170.2, 143.9, 129.4, 125.9, 123.7, 122.5, 108.5, 68.5, 50.9, 41.6, 30.3, 27.8, 26.8, 26.5, 20.5; IR(KBr), σ/cm-1: 2234, 1732, 1710, 1614, 1491, 1378, 1340; HRMS m/z(ESI)计算值C17H21N2O3[M+H]+: 301.1547, 实测值: 301.1546。
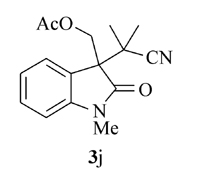
产物3j: 黄色油状物。1H NMR(400 MHz, CDCl3), δ: 7.20(d, J=7.2 Hz, 1H), 7.13(d, J=7.6 Hz, 1H), 7.04(t, J=7.6 Hz, 1H), 3.85~3.74(m, 2H), 2.93~2.79(m, 2H), 2.38(d, J=14.4 Hz, 1H), 2.19(d, J=14.4 Hz, 1H), 2.11~2.09(m, 2H), 1.41(s, 3H), 1.22(s, 3H), 1.18(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.3, 139.8, 130.3, 128.1, 124.8, 123.3, 122.6, 121.4, 49.1, 47.2, 31.6, 30.4, 27.9, 27.7, 25.4, 21.9; IR(KBr), σ/cm-1: 2232, 1710, 1608, 1473, 1372, 1341; HRMS m/z(ESI)计算值C17H21N2O[M+H]+: 269.1649, 实测值: 269.1653。
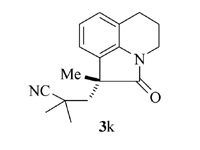
产物3k: 淡黄色固体, mp 128~129 ℃。1H NMR(400 MHz, CDCl3), δ: 7.31~7.25( m, 2H), 6.81(d, J=8.0 Hz, 1H), 3.21(s, 3H), 2.32(d, J=14.4 Hz, 1H), 2.10(d, J=14.4 Hz, 1H), 1.34(s, 3H), 1.15(s, 3H), 1.10(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.0, 141.7, 132.7, 127.9, 125.0, 123.9, 123.6, 109.4, 47.2, 46.6, 30.5, 29.6, 27.3, 27.1, 26.5; IR(KBr), σ/cm-1: 2233, 1715, 1610, 1432, 1383, 1345; HRMS m/z(ESI)计算值C15H18ClN2O[M+H]+: 277.1103, 实测值: 277.1106。
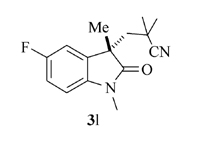
产物3l: 淡黄色固体, mp 107~108 ℃。1H NMR(400 MHz, CDCl3), δ: 7.10~7.00(m, 2H), 6.60~6.71(m, 1H), 3.21(s, 3H), 2.32(d, J=14.8 Hz, 1H), 2.11(d, J=14.8 Hz, 1H), 1.34(s, 3H), 1.16(s, 3H), 1.10(s, 3H);13C NMR(101 MHz, CDCl3), δ: 179.2, 159.2(d, J=204.4 Hz), 139.1, 132.6, 123.7, 114.8(d, J=23.4Hz), 112.7(d, J=24.5 Hz), 109.0, 47.4, 46.5, 30.6, 29.1, 23.3, 26.9, 26.5; IR(KBr), σ/cm-1: 2234, 1718, 1617, 1435, 1383, 1335; HRMS m/z(ESI)计算值C15H18FN2O[M+H]+: 261.1397, 实测值: 261.1399。
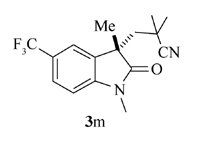
产物3m: 黄色固体, mp 114~115 ℃。1H NMR(400 MHz, CDCl3), δ: 7.60(d, J=8.4 Hz, 1H), 7.52(s, 1H), 6.96(d, J=8.4 Hz, 1H), 3.26(s, 3H), 2.33(d, J=14.8 Hz, 1H), 2.15(d, J=14.8 Hz, 1H), 1.37(s, 3H), 1.11(s, 6H);13C NMR(101 MHz, CDCl3), δ: 179.4, 146.1, 131.6, 126.3(q, J=3.9 Hz), 124.0(q, J=32.8 Hz), 123.4, 121.6(q, J=3.5 Hz), 120.2, 108.3, 47.0, 46.5, 30.5, 29.5, 27.2, 27.1, 26.6; IR(KBr), σ/cm-1: 2235, 1715, 1624, 1432, 1385, 1327; HRMS m/z(ESI)计算值C16H18F3N2O[M+H]+: 311.1366, 实测值: 311.1367。
称取吲哚酮产物3c 150 mg(0.5 mmol)和LiAlH4 76 mg(2.0 mmol), 溶于10 mL四氢呋喃, 在N2气保护下于室温搅拌1 h, 加热至沸腾反应0.5 h。 反应结束后, 加入THF/H2O(体积比10:1)溶剂2 mL在0 ℃条件下继续搅拌0.5 h, 经二氯甲烷萃取, 干燥得到粗产品。 所得的粗产品溶于乙酸乙酯, 加入1 mol/L HCl 溶液5 mL, 搅拌5 min后, 用固体K2CO3中和, 乙酸乙酯萃取。 合并有机层溶剂, 无水Na2SO4干燥。 所得粗产品经柱层析分离, 石油醚-乙酸乙酯梯度洗脱, 得到最终目标产物4为无色油状物(105 mg, 73%)。
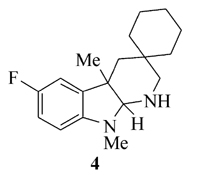
产物4, 无色油状物,1H NMR(400 MHz, CDCl3), δ: 6.83~6.73(m, 2H), 6.41(dd, J=8.0 Hz, 4.0 Hz, 1H), 3.87(s, 1H), 2.77(s, 3H), 2.69(d, J=12.8 Hz, 1H), 2.58(d, J=12.8 Hz, 1H), 1.97(br, 1H), 1.70~1.50(m, 10H), 1.39(s, 3H), 1.17~1.04(m, 2H);13C NMR(101 MHz, CDCl3), δ: 157.4(d, J=234.4 Hz), 146.5, 141.4, 113.5(d, J=23.4 Hz), 110.1(d, J=23.7 Hz), 107.9(d, J=7.1 Hz), 87.5, 49.1, 45.3, 41.4, 38.5, 35.9, 32.8, 32.1, 27.4, 26.9, 22.6, 22.3; HRMS m/z(ESI)计算值C18H26FN2[M+H]+: 289.2075, 实测值: 289.2079。
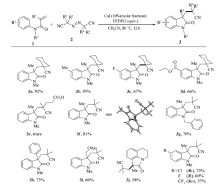
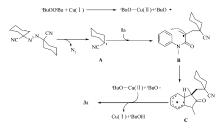
最佳反应条件筛选以 N-甲基 -N-芳基丙烯酰胺1a和1, 1-偶氮双(环己烷甲腈)2a的环化反应为对象展开(见表1)。 首先对催化剂进行了筛选, 最初以过氧化叔丁基醚为氧化剂, 乙腈作为反应溶剂, 在没有加入催化剂的情况下, 仅仅以23%的产率得到目标产物3a(表1, entry 1)。 为了提高产率, 进一步考察了一些铜盐, 如氯化亚铜、溴化亚铜、碘化亚铜和氰化亚铜, 铜盐可以提高反应的产率, 其中碘化亚铜的催化效果最好, 催化反应以高达92%的产率得到目标产物3a(表1, entries 2~5)。 最后还对铁盐的催化效果进行了考察, 当使用FeSO4·7H2O和Fe(NH4)2(SO4)2·6H2O作为催化剂时, 产率分别为65%和70%(表1, entries 6~8)。 根据相关文献报道, 氧化剂一般会对此类反应有较大的影响, 因此除上文所述的DTBP以外, 进一步考察了其它氧化剂对反应的影响。 TBHP(叔丁基过氧化氢)对反应的促进效果稍逊于DTBP(二叔丁基过氧化物, 得到76%的产率(表1, entry 9), 过硫酸钾对于该反应不理想, 所得的产物产率降低到70%(表1, entry 10)。 其它常见氧化剂, 如醋酸碘苯PhI(OAc)2和三氟醋酸碘苯PhI(OTFA)2, 应用于该反应效果同样不如DTBP(表1, entries 11~12)。 最后, 不使用氧化剂时, 目标产物的产率仅仅为14%(表1, entry 13)。 实验发现, 乙腈有利于目标产物的生成, 与乙腈有着相似效果的是二氧六环, 产率高达90%(表1, entry 14), 当以甲苯或二氯乙烷替换溶剂乙腈时, 反应产率未能取得任何提高(表1, entries 15~16)。 值得一提的是, 当采用干燥过的乙腈作为溶剂时, 反应非常不理想, 可能是溶剂中微量水有利于反应进行。 最后研究了温度对反应的影响, 当温度降低到60 ℃时, 产率显著降低为42%(表1, entry 17), 提高反应温度至110 ℃, 反应产率仅为64%(表1, entry 18)。
综上所述, 最佳反应条件为: N-芳基丙烯酰胺1 0.5 mmol, a-氰偶氮试剂1 mmol, CuI 0.05mmol, 叔丁基过氧化物(DTBP) 1 mmol, 温度80 ℃, 溶剂为乙腈, 反应时间为12 h。
表1 优化反应条件 Table 1 Screening of optimal reaction conditions a 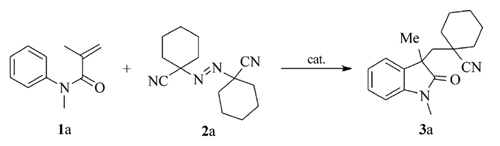 |
根据上述最佳反应条件, 进一步考察了反应底物的适用范围(Scheme 3)。 当利用1, 1-偶氮双(环己烷-1-甲腈)(2a)作为含氰基自由基源时, 芳环上带各种取代基团的 N-芳基丙烯酰胺(如Me, H, F, CO2Et)大部分表现出非常好的反应活性, 其中甲基取代的 N-芳基丙烯酰胺产率高达95%。 此外, 还考察了其它含氰基偶氮试剂在反应中的活性, 当使用含羧基的含氰基偶氮试剂时, 未检测到目标产物3e。 AIBN(2, 2'-二氰基-2, 2'-偶氮丙烷)同样也表现出较好的反应活性, 在优化条件下, 反应以81%的产率得到目标产物3f, 产物通过单晶衍射表征与目标结构完全吻合。 此外, AIBN还可以与具有其它结构特征的 N-芳基丙烯酰胺发生环化反应。 当以苄基替换N原子上的甲基后, 反应以70%的产率得到产物3g, 当烯烃双键上的甲基变为苯环或者CH2OAc基团时, 反应仍然保持较高的活性, 分别以73%和66%的产率得到产物3h和3i。 当具有四氢喹啉结构特征的丙烯酰胺作为底物时, 环化反应以中等收率得到稠环吲哚酮3j。
所得含氰基吲哚酮产物可以作为具有潜在重要生物活性的多环吲哚的合成前体。 例如, 产物3c可以利用LiALH4在温和的条件下, 一步还原环化, 以73%的产率生成含4个环的二氢吲哚4(Scheme 4)。
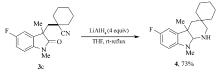 | Scheme 4 Synthetic transformation of oxindole 3cReagent and conditions: (a)LiAlH4(4 equiv), THF, 1 h, then reflux, 0.5 h |
本文探索了铜催化的活泼烯烃与偶氮试剂氰烷基化成环合成吲哚酮反应, 研究结果表明, 以CuI(5%摩尔分数)作为催化剂, 过氧叔丁基醚(DTBP, 2倍化学计量)作为氧化剂, 含氰基偶氮试剂作为自由基源, 温度为80 ℃的条件下, N-芳基丙烯酰胺能顺利发生环化反应合成多种含氰吲哚酮。 该方法具有底物适应范围广, 操作简单、产率较高、环境友好和催化剂廉价等优点, 为合成含氰吲哚酮提供了一种新的可供选择途径。 该合成方法获得的吲哚酮可用于合成具有多环二氢吲哚片段的天然产物合成。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|