合成了15种新型三脚架结构苯并咪唑季铵盐类化合物(3a~3o)。 通过IR、NMR和HRMS等技术手段对目标产物(3a~3o)进行了结构表征。 并对目标化合物调节植物生长活性进行了评价。 结果表明, 目标化合物浓度为10 mg/L时, 化合物3a、3c、3f、3g、3h、3i和3j均具有优良的促细胞分裂活性, 最高达88.3%, 比参照物三唑酮(50.2%)的促细胞分裂活性更高, 但生长素活性不明显;目标化合物均具有优异的除草活性, 其中化合物3i效果最明显, 可以达到95.6%。 同时利用荧光光谱, 探究了4种代表性目标分子对人体中常见的6种阴离子的荧光识别, 结果发现目标化合物能较好的识别I-, 可作为I-荧光识别探针。
Fifteen new tripod type benzimidazolium salts(3a~3o) were synthesized and characterized by IR, NMR and HRMS. The plant growth regulating activities of compound 3 were evaluated. Compounds 3a, 3c, 3f, 3g, 3h, 3i and 3j exhibit excellent cytokinesis activities up to 88.3% at the concentration of 10 mg/L which are higher than that of the reference triadimefon(50.2%), but their auxin activities are not obviously effective. Nearly all the target compounds have excellent herbicidal activity, while compound 3i is the best with 95.6%. The fluorescent identification of the four representative target molecules on six important anions was explored by fluorescence spectrum. The target compounds can be used as fluorescence probe for I- identification.
在植物体生长、增殖、分化、衰老和休眠的过程中, 新农药起着关键性的作用[1,2]。 新农药因能高效控制植物激素分泌, 从而起到控制农作物的生长、发芽、分化和高效杀虫的作用, 其中含氮杂环农药效果最佳, 其毒性低、作用时间长和环境友好等特点已经成为绿色新农药研究发展的热点[3,4,5,6]。 在药物设计中苯并咪唑杂环可作为有力药效基团, 更是得到了研究者的关注, 现已被广泛的应用到农药的生产中。
苯并咪唑衍生物因其特殊的分子结构, 易与生物体中酶、DNA和RNA的有效成分形成氢键, 具有多种医药用途[7], 如杀菌、抗癌、抗糖尿病、抗高血压和抗寄生虫等作用[8,9,10], 聚合苯并咪唑在力学和电学特征上也具有很好的应用。 在农药方面的研究表明, 以苯并咪唑为药效团的分子具有抗虫[11,12,13,14,15,16]和除草活性[17], 由苯并咪唑衍生的季铵盐具有一定的植物生长调节活性[18,19,20,21,22]。 因此, 我们以具有较好分子柔性的三氯三乙胺为模板, 依据药效叠加原理, 模板与3个苯并咪唑基元对接, 并通过季铵化修饰苯并咪唑, 构筑了具有三脚架结构特征的新型苯并咪唑季铵盐分子。 通过黄瓜子叶生根法和小麦芽鞘法, 评价了其细胞分裂素活性和植物生长素活性, 通过对稗草种子的发芽抑制, 评价了其除草活性, 以期筛选性能优良的植物生长调节剂。
人体中存在大量的阴离子, 特别是卤素阴离子, 它们在生命活动中具有重要作用, 因此相关阴离子的荧光识别在生物和医药等领域中的应用已成为学科研究的热点[23]。 研究表明, 苯并咪唑衍生物对生物体和环境中的阴离子的荧光识别具有高效、便捷和灵敏度高的特点[24], 借助苯并咪唑的荧光性能变化, 有望准确高效地检测人体和环境中微量元素, 给疾病诊治和环保提供重要参考。 因此本文设计合成了系列具有复合功能的新型三脚架结构的苯并咪唑季铵盐类目标产物3a~3o, 探究了其对人体中普遍存在的F-、Cl-、Br-、I-、H2P
BRUKER Avance-500 MHz型核磁共振波谱仪(瑞士Bruker公司);Accurate-Mass TOF LC/MS型精确质量液相色谱飞行时间质谱联用仪(美国Agilent公司);Lambda 35型紫外可见分光光度计(Perkin Elmer公司);傅里叶变换红外光谱仪(德国Bruker AXS 公司);RF-540型荧光光谱仪(日本岛津公司);X-5型数字显微熔点测定仪(北京泰克仪器有限公司), 温度计未经校正;WFH-203B型三用紫外分析仪(上海精科实业有限公司)。 所用的试剂均为市售的分析纯。 化合物1收率为85.1%, 熔点118.2~119.6 ℃与文献值相符[25,26]。
1.2.1 化合物2的合成 文献报道[27], 化合物2的合成的产率较低(52%), 为提高产率, 对此进行了进一步的研究, 确定了合成的最优条件为物料比为 n(三氯化物): n(苯并咪唑)=1:3.2, THF作溶剂, NaH作碱性条件, 反应温度为70 ℃, 反应时间4 h, 所得化合物2的收率由52%提高到了88%, 化合物2熔点值176.5~177.9 ℃与文献值相符[27], 条件选择如表1所示。
| 表1 中间体2合成条件的优化 Table 1 Synthesis of intermediate 2 in optimal conditions |
1.2.2 化合物3a~3o的合成通法 在N2气气氛下, 将0.4492 g化合物2(1 mmol)加到100 mL三口瓶中, 加入20 mL DMF, 充分搅拌使其溶解, 加入0.4097 g的苄氯(3.2 mmol)或0.5473 g苄溴(3.2 mmol), 在110 ℃的条件下反应48 h, 冷却至室温, 减压蒸去溶剂, 得到灰白色的固体, 将固体溶解在20 mL的乙醇溶液中, 加入0.3151 g的NH4BF4(3 mmol), 有白色固体析出, 减压过滤, 固体用乙醇进行快速柱层析, 得到白色的固体。
4-甲基苄基-苯并咪唑季铵盐(3a):白色固体, 收率79.6%, mp 198.3~199.9 ℃。 IR(KBr), σ/cm-1:3048, 2922, 1648, 1532, 1032, 744;1H NMR(500 Hz, DMSO-d6), δ:9.89(s, 1H, N-CH), 7.94(d, J=8.15 Hz, 2H, 苯并咪唑), 7.66~7.60(m, 2H, PhH), 7.40 (d, J=8.05 Hz, 2H, 苯并咪唑), 7.18 (d, J=7.90 Hz, 2H, PhH), 5.68(s, 2H), 4.52(t, J=6.65 Hz, 2H, N—CH2—CH2—), 3.29(t, J=6.65 Hz, 2H, —CH2—N), 2.22 (s, 3H, Ph—CH3);13C NMR(125 Hz, DMSO-d6), δ:142.17(N-CH), 135.81(Ph), 134.71(Ph), 132.11(苯并咪唑), 131.53(苯并咪唑), 129.71(Ph), 128.74(Ph), 127.02(苯并咪唑), 126.89(苯并咪唑), 114.89(苯并咪唑), 114.43(苯并咪唑), 52.14(Ph—CH2—), 48.82(N—CH2—), 43.09(N—CH2—CH2—), 21.83(Ph—CH3);HRMS(ESI), m/z:254.8140[M-3B
2, 4, 6-三甲基苄基-苯并咪唑季铵盐(3b):白色固体, 收率81.2%, mp 187.8~188.9 ℃。 IR(KBr), σ/cm-1):3178, 2977, 1649, 1549, 1108, 725;1H NMR(500 Hz, DMSO-d6), δ:9.89(s, 1H, N-CH), 8.13(d, J=8.20 Hz, 1H, 苯并咪唑), 7.93(d, J= 8.20 Hz, 1H, 苯并咪唑), 7.78~7.70(m, 2H, PhH), 6.97(s, 2H, 苯并咪唑), 5.61(s, 2H, —CH2—Ph), 4.27(s, 2H, N—CH2—CH2—), 3.01(s, 2H, N—CH2—), 2.20(s, 3H, Ph—CH3);13C NMR(125 Hz, DMSO-d6), δ:142.08(N-CH), 139.83(Ph), 137.42(Ph), 136.52(Ph), 131.17(苯并咪唑), 130.48(苯并咪唑), 126.80(苯并咪唑), 126.71(苯并咪唑), 113.80(苯并咪唑), 113.60(苯并咪唑), 52.12(Ph—CH2—), 49.94(N—CH2—), 44.17(N—CH2—CH2—), 21.08(Ph—CH3), 19.82(Ph—CH3);HRMS(ESI), m/z:282.8452[M-3B
对甲氧基苄基-苯并咪唑季铵盐(3c):白色固体, 收率78.5%, mp 180.9~181.7 ℃。 IR(KBr), σ/cm-1:3055, 2932, 1662, 1587, 1221, 1083, 744;1H NMR(500 Hz, DMSO-d6), δ:9.70(s, 1H, N-CH), 7.98(d, J=8.05 Hz, 1H, 苯并咪唑), 7.92(d, J=8.05 Hz, 1H, 苯并咪唑), 7.66~7.61(m, 2H, 苯并咪唑), 7.46(d, J=8.65 Hz, 2H, PhH), 6.94(d, J=8.65 Hz, 2H, PhH), 5.64(s, 2H, —CH2—Ph), 4.49(t, J=6.55 Hz, 2H, N—CH2—CH2—), 3.70(s, 3H, Ph—OCH3), 3.30(t, J=6.55 Hz, 2H, —CH2—N);13C NMR(125 Hz, DMSO-d6), δ:157.63(Ph—OCH3), 141.03(N-CH), 135.24(Ph), 132.12(苯并咪唑), 131.54(苯并咪唑), 129.94(Ph), 127.82(苯并咪唑), 127.68(苯并咪唑), 114.81(苯并咪唑), 115.56(Ph), 113.59(苯并咪唑), 55.82(—OCH3), 50.13(Ph—CH2—), 47.74(N—CH2—), 43.39(N—CH2—CH2—);HRMS(ESI), m/z:270.6730[M-3B
3, 4-二甲氧基苄基-苯并咪唑季铵盐(3d):灰白色固体, 收率80.3%, mp 196.5~197.9 ℃。 IR(KBr) σ/cm-1:3093, 2927, 1639, 1597, 1213, 1102, 794;1H NMR(500 Hz, DMSO-d6), δ:9.68(s, 1H, N-CH), 8.03(d, J=8.20 Hz, 1H, 苯并咪唑), 7.90(d, J=8.20 Hz, 1H, 苯并咪唑), 7.69~7.61(m, 2H, PhH), 7.18(d, J=1.70 Hz 1H, 苯并咪唑), 7.03(q, J=1.70 Hz, 1H, 苯并咪唑), 6.92~6.88(m, 1H, PhH), 5.61(s, 2H, CH2—Ph), 4.48(t, J=6.45 Hz, 2H, N—CH2—CH2—), 3.72(s, 3H, Ph—OCH3), 3.69(s, 3H, Ph—OCH3), 3.29(t, J=6.45 Hz, 2H, —N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:154.83(Ph—OCH3), 153.54(Ph—OCH3), 143.05(N-CH), 139.66(Ph), 131.23(苯并咪唑), 130.61(苯并咪唑), 126.82(苯并咪唑), 126.72(苯并咪唑), 123.72(Ph), 113.91(苯并咪唑), 113.62(苯并咪唑), 112.53(Ph), 111.31(Ph), 56.21(—OCH3), 55.11(—OCH3), 54.14(Ph—CH2—), 47.33(N—CH2—), 41.21(N—CH2—CH2—);HRMS(ESI), m/z:300.8190[M-3B
3, 5-二甲氧基苄基-苯并咪唑季铵盐(3e):白色固体, 收率80.9%, mp 172.8~173.4 ℃。 IR(KBr), σ/m-1:3098, 2931, 1652, 1537, 1222, 1108, 762;1H NMR(500 Hz, DMSO-d6), δ:9.82(s, 1H, N-CH), 7.98(d, J=8.10 Hz, 1H, 苯并咪唑), 7.92(d, J=8.15 Hz, 1H, 苯并咪唑), 7.68~7.61(m, 2H, PhH), 7.20(d, J=1.70 Hz, 1H, 苯并咪唑), 7.12(q, J=1.70 Hz, 1H, 苯并咪唑), 6.98~6.90(m, 1H, PhH), 5.64(s, 2H, —CH2—Ph), 4.52(t, J=6.35 Hz, 2H, N—CH2—CH2—), 3.67(s, 3H, Ph—OCH3), 3.62(s, 3H, Ph—OCH3), 3.27(t, J=6.35 Hz, 2H, N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:160.83(Ph—OCH3), 142.37(N-CH), 135.81(Ph), 131.10(苯并咪唑), 130.54(苯并咪唑), 126.82(苯并咪唑), 126.61(苯并咪唑), 113.84(苯并咪唑), 113.53(苯并咪唑), 106.56(Ph), 99.60(Ph), 55.22(—OCH3), 51.14(Ph—CH2—), 49.84(N—CH2—), 44.09(N—CH2—CH2—);HRMS(ESI), m/z:300.8188[M-3B
对氟苄基-苯并咪唑季铵盐(3f):灰白色固体, 收率80.4%, mp 192.6~194.1 ℃。 IR(KBr), σ/cm-1:3089, 2906, 1662, 1582, 1172, 728;1H NMR(500 Hz, DMSO-d6), δ:9.75(s, 1H, N-CH), 7.94(d, J=7.55 Hz, 2H, 苯并咪唑), 7.65(d, J=7.50 Hz, 2H, 苯并咪唑), 7.61(d, J=8.0 Hz, 2H, PhH), 7.44(d, J=7.95 Hz, 2H, PhH), 5.72(s, 2H, —CH2—Ph), 4.50(t, J=6.50 Hz, 2H, N—CH2—CH2—), 3.30(t, J=6.50 Hz, 2H, N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:142.06(N-CH), 134.83(Ph), 132.94(苯并咪唑), 132.83(苯并咪唑), 131.98(Ph—Cl), 130.47(Ph), 129.55(Ph), 128.49(苯并咪唑), 128.56(苯并咪唑), 115.72(苯并咪唑), 115.62(苯并咪唑), 47.98(N—CH2—), 47.98(Ph—CH2—), 44.03(N—CH2—CH2—);HRMS(ESI), m/z:258.7895[M-3B
邻氯苄基-苯并咪唑季铵盐(3g):白色固体, 收率78.5%;mp 216.5~218.0 ℃。 IR(KBr), σ/cm-1:3098, 2937, 1676, 1542, 1225, 735;1H NMR(500 Hz, DMSO-d6), δ:9.83(s, 1H, N-CH), 7.99~7.98(d, J=8.15 Hz, 1H, 苯并咪唑), 7.87~7.84(d, J=8.15 Hz, 1H, 苯并咪唑), 7.69~7.61(m, 2H, 苯并咪唑), 7.50~7.49(d, J=7.0 Hz, 1H, PhH), 7.32~7.39(t, J=7.6 Hz, 1H, PhH), 7.06~7.04(d, J=8.2 Hz, 1H, PhH), 6.95~6.92(t, J=7.55 Hz, J=7.15 Hz, 1H, PhH), 5.68(s, 2H, —CH2—CH2—Ph), 4.52~4.50(t, J=6.45 Hz, 2H, N—CH2—CH2—), 3.23~3.21(t, J=6.45 Hz, 2H, —N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:141.73(N-CH), 139.26(Ph), 132.96(Ph), 131.03(苯并咪唑), 130.51(苯并咪唑), 129.23(Ph), 128.93(Ph), 127.63(Ph), 127.33(Ph), 126.52(苯并咪唑), 126.21(苯并咪唑), 112.84(苯并咪唑), 112.53(苯并咪唑), 55.22(—OCH3), 51.14(Ph—CH2—), 49.84(N—CH2—), 44.09(N—CH2—CH2—);HRMS(ESI), m/z: 274.7591[M-3B
2, 4-二氯苄基-苯并咪唑季铵盐(3h):白色固体, 收率75.8%, mp 205.9~207.1 ℃。 IR(KBr), σ/cm-1:3142, 2998, 1682, 1602, 1232, 731;1H NMR(500 Hz, DMSO-d6), δ:9.71(s, 1H, N-CH), 7.97(d, J=9.65 Hz, 2H, 苯并咪唑), 7.74(d, J=8.0 Hz, 3H, PhH), 7.49(s, 2H, 苯并咪唑), 5.82(s, 2H, —CH2—Ph), 4.50(s, 2H, N—CH2—CH2—), 3.33(s, 2H, N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:142.04(N-CH), 138.82(Ph), 136.71(Ph), 133.51(Ph), 132.11(苯并咪唑), 131.86(苯并咪唑), 130.21(Ph), 129.81(Ph), 128.71(Ph), 125.81(苯并咪唑), 125.25(苯并咪唑), 112.85(苯并咪唑), 111.83(苯并咪唑), 54.17(Ph—CH2—), 48.24(N—CH2—), 41.17(N—CH2—CH2—);HRMS(ESI), m/z:308.7210[M-3B
间硝基苄基-苯并咪唑季铵盐(3i):淡黄色固体, 收率77.3%, mp 211.1~212.8 ℃。 IR(KBr), σ/cm-1:3142, 2996, 1662, 1591, 1535, 1235, 718;1H NMR(500 Hz, DMSO-d6), δ:9.82(s, 1H, N-CH), 7.96~7.94(d, J=8.05 Hz, 1H, 苯并咪唑), 7.91~7.88(d, J=8.1 Hz, 1H, 苯并咪唑), 7.63~7.60(m, 2H, 苯并咪唑), 7.42~7.38(m, 4H, PhH), 5.90(s, 2H, —CH2—Ph), 4.52~4.49(t, J=6.5 Hz, 2H, N—CH2—CH2—), 3.30~3.27(t, J= 6.5 Hz, 2H, —N—CH2—);13C NMR(125 Hz, DMSO-d6), δ:148.23(Ph—NO2), 141.63(N-CH), 139.76(Ph), 134.21(Ph), 131.11(苯并咪唑), 130.66(苯并咪唑), 128.27(Ph), 126.85(苯并咪唑), 124.31(苯并咪唑), 121.66(Ph), 121.37(Ph), 115.86(苯并咪唑), 114.73(苯并咪唑), 53.64(Ph—CH2—), 47.81(N—CH2—), 42.07(N—CH2—CH2—);HRMS(ESI), m/z:285.7828[M-3B
对硝基苄基-苯并咪唑季铵盐(3j):淡黄色固体, 收率77.8%, mp 205.7~206.6 ℃。 IR(KBr), σ/cm-1:3183, 2915, 1602, 1585, 1529, 1101, 721;1H NMR(500 Hz, DMSO-d6), δ:9.84(s, 1H, N-CH), 7.94(d, J=8.15 Hz, 2H, 苯并咪唑), 7.66~7.60(m, 2H, PhH), 7.40(d, J=8.05 Hz, 2H, 苯并咪唑), 7.18(d, J=7.90 Hz, 2H, PhH), 5.91(s, 2H, —CH2—Ph), 4.57(t, J=6.65 Hz, 2H, N—CH2—CH2—), 3.29(t, J=6.65 Hz, 2H, —CH2—N);13C NMR(125Hz, DMSO-d6), δ:146.25(Ph—NO2), 144.12(Ph), 142.15(N-CH), 132.15(苯并咪唑), 131.74(苯并咪唑), 129.82(Ph), 126.82(苯并咪唑), 126.61(苯并咪唑), 123.46(Ph), 113.84(苯并咪唑), 113.53(苯并咪唑), 52.17(Ph—CH2—), 47.24(N—CH2—), 45.17(N—CH2—CH2—);HRMS(ESI), m/z:285.7830[M-3B
庚基-苯并咪唑季铵盐(3k):灰色固体, 收率71.2%, mp 183.2~184.9 ℃。 IR(KBr), σ/cm-1:3029, 2923, 1643, 1556, 1218, 729;1H NMR(500 Hz, DMSO-d6), δ:9.59(s, 1H, N-CH), 8.04(d, J=7.95 Hz, 1H, 苯并咪唑), 7.95(d, J=7.95 Hz, 1H, 苯并咪唑), 7.70~7.63(m, 2H, 苯并咪唑), 4.52~4.59(t, J=6.60 Hz, 2H, N—CH2—CH2—), 4.43(t, J=7.40 Hz, 2H, —CH2—Ph), 3.27(t, J=6.60 Hz, 2H, —N—CH2—), 2.84~2.80(m, 2H, —CH2—), 1.30~1.22(m, 10H, —CH2—), 0.86~0.81(m, 3H, —CH3);13C NMR(125 Hz, DMSO-d6), δ:141.42(N-CH), 132.07(苯并咪唑), 131.84(苯并咪唑), 126.82(苯并咪唑), 126.71(苯并咪唑), 113.74(苯并咪唑), 113.23(苯并咪唑), 56.27(N+—CH2), 48.24(N—CH2—), 43.01(N—CH2—CH2—), 29.62, 28.54, 27.81, 25.31, 22.18, 14.21;HRMS(ESI), m/z:248.8606[M-3B
己基-苯并咪唑季铵盐(3l):灰色固体, 收率71.6%, mp 181.6~182.7 ℃;IR(KBr), σ/cm-1:3119, 2911, 1651, 1569, 1248, 722;1H NMR(500 Hz, DMSO-d6), δ:9.59(s, 1H, N-CH), 8.04(d, J=7.95 Hz, 1H, 苯并咪唑), 7.95(d, J=7.95 Hz, 1H, 苯并咪唑), 7.70~7.63(m, 2H, 苯并咪唑), 4.52~4.59(t, J=6.60 Hz, 2H, N—CH2—CH2—), 4.43(t, J=7.40 Hz, 2H, —CH2—Ph), 3.27(t, J=6.60 Hz, 2H, —N—CH2—), 2.78(t, J=7.60 Hz, 2H, —CH2—), 1.76~1.70(m, 6H, —CH2—), 1.39~1.33(m, 2H, —CH2—), 0.91~0.88(m, J=7.00 Hz, 3H, —CH3);13C NMR(125 Hz, DMSO-d6), δ:141.72(N-CH), 131.37(苯并咪唑), 131.21(苯并咪唑), 126.12(苯并咪唑), 125.82(苯并咪唑), 113.78(苯并咪唑), 113.43(苯并咪唑), 55.18(N+—CH2), 47.89(N—CH2—), 43.19(N—CH2—CH2—), 29.62, 27.34, 26.28, 22.47, 14.11;HRMS(ESI), m/z:234.8444[M-3B
戊基-苯并咪唑季铵盐(3m):灰色固体, 收率72.8%, mp 178.4~179.6 ℃。 IR(KBr), σ/cm-1:3110, 2928, 1671, 1552, 1148, 726;1H NMR(500 Hz, DMSO-d6), δ:9.59(s, 1H, N-CH), 8.04(d, J=7.95 Hz, 1H, 苯并咪唑), 7.95(d, J=7.95 Hz, 1H, 苯并咪唑), 7.70~7.63(m, 2H, 苯并咪唑), 4.52(t, J=6.60 Hz, 2H, N—CH2—CH2—), 4.43(t, J=7.40 Hz, 2H, —CH2—Ph), 3.27(t, J=6.60 Hz, 2H, —N—CH2—), 2.74(t, J=7.60 Hz, 2H, —CH2—), 1.77~1.70(m, 2H, —CH2—), 1.39~1.35(m, 4H, —CH2—), 0.90(t, J=7.00 Hz, 3H, —CH3);13C NMR(125 Hz, DMSO-d6), δ:141.83(N-CH), 132.08(苯并咪唑), 131.76(苯并咪唑), 126.97(苯并咪唑), 126.72(苯并咪唑), 113.75(苯并咪唑), 113.51(苯并咪唑), 56.18(N+—CH2), 48.78(N—CH2—), 42.17(N—CH2—CH2—), 29.32, 29.02, 22.87, 14.32;HRMS(ESI), m/z:220.8284[M-3B
丁基-苯并咪唑季铵盐(3n):灰色固体, 收率69.2%, mp 172.4~173.6 ℃;IR(KBr), σ/cm-1:3121, 2981, 1632, 1543, 1172, 721;1H NMR(500 Hz, DMSO-d6), δ:9.69(s, 1H, N-CH), 8.11(d, J=7.75 Hz, 1H, 苯并咪唑), 7.97(d, J=7.7 Hz, 1H, 苯并咪唑), 7.63~7.62(m, 2H, 苯并咪唑), 4.62(t, J=6.75 Hz, 2H, N—CH2—CH2—), 4.53(t, J=7.65 Hz, 2H, N+—CH2—CH2—), 3.27(t, J=6.75 Hz, 2H, —N—CH2—), 2.77~2.74(m, 2H, —CH2—), 1.38~1.35(m, 4H, —CH2—), 0.85(t, J=2.55 Hz, 3H, —CH3);13C NMR(500 Hz, DMSO-d6), δ:141.77(N-CH), 132.21(苯并咪唑), 131.86(苯并咪唑), 126.67(苯并咪唑), 126.42(苯并咪唑), 113.25(苯并咪唑), 113.03(苯并咪唑), 56.48(N+—CH2), 48.78(N—CH2—), 42.17(N—CH2—CH2—), 29.79, 20.63, 13.82;HRMS(ESI), m/z:206.8129[M-3B
丙基-苯并咪唑季铵盐(3o):灰色固体, 收率72.6%, mp 165.3~166.7 ℃。 IR(KBr), σ/cm-1:3120, 2912, 1638, 1554, 1175, 732;1H NMR(500 Hz, DMSO-d6), δ:9.57(s, 1H, N-CH), 8.07(d, J=7.85 Hz, 1H, 苯并咪唑), 7.99(d, J=7.9 Hz, 1H, 苯并咪唑), 7.72~7.66(m, 2H, 苯并咪唑), 4.55(t, J=6.65 Hz, 2H, N—CH2—CH2—), 4.44(t, J=7.35 Hz, 2H, N+—CH2—CH2—), 3.30(t, J=6.65 Hz, 2H, —N—CH2—), 2.78~2.74(m, 2H, —CH2—), 1.38~1.35(m, 2H, —CH2—), 0.88(t, J=2.4 Hz, 3H, —CH3);13C NMR(125 Hz, DMSO-d6), δ:141.72(N-CH), 132.35(苯并咪唑), 131.91(苯并咪唑), 126.81(苯并咪唑), 126.51(苯并咪唑), 113.16(苯并咪唑), 113.08(苯并咪唑), 56.41(N+—CH2), 48.78(N—CH2—), 42.26(N—CH2—CH2—), 24.26, 12.81;HRMS(ESI), m/z:192.7995[M-3B
利用经典的方法, 参照文献[6]对目标分子的细胞分裂素活性、生长素活性和除草活性进行了评价, 测试结果如表2所示。
| 表2 化合物的生长调节活性 Table 2 Growth regulating activity of target compounds |
表格中的计算结果均为正值, 表明具有促进作用, 该结果可以作为药效评价标准:A级为测试促进效果≥40 %;B级为25 %≤效果<40 %;C级为10%≤效果<25 %;效果低于10%为D级。 其中参照物分别为三唑酮(Triadimefon)和 N-羟基- N-异丙基草酰胺(IpOHA)。
在细胞分裂素活性测试中, 与参照物三唑酮(50.2%)相比, 发现目标产物均表现出优良的细胞分裂素活性, 其中化合物3a、3c、3f、3g、3h、3i和3j均表现为A级。 构效关系表明, 苯并咪唑和邻氯苯基相连接的化合物3g的促进效果最佳, 可以达88.3%;结构中含有卤素的产物都具有较好的促进效果。
在生长素活性的测试中, 发现目标产物均表现出了一定的活性, 对小麦芽鞘具有一定的促进作用, 其中与苯并咪唑相连接为硝基的化合物3j的效果最为明显, 可达38.6%, 表现为B级, 其它的化合物的生长素活性相对较低, 多为C级, 其生长活性有了一定的提高。
在除草活性测试中, 利用在农作物生长过程中容易滋生的稗草做为测试, 研究了目标产物对稗草抑制活性。 结果表明, 所有目标产物均对稗草生长都具有优良的抑制作用。当抑制剂浓度为10 mg/L时, 多数化合物均优于参照物 N-羟基- N-异丙基草酰胺IpOHA(50.2%), 特别是化合物3i表现出优秀的除草活性, 抑制率达到95.6%, 作用效果非常明显, 有望成为优秀的除草剂。
2.2.1 目标化合物对不同阴离子的荧光猝灭 本文选择6种(F-、Cl-、Br-、I-、H2P
 | 图1 不同阴离子对发射光谱的影响(自左至右:化合物3d、3e、3f、3h)Fig.1 Changes of emission spectra of compounds 3d, 3e, 3f and 3h(from left to right) with the different anions |
测试结果表明, 不同的配体对不同的阴离子具有不同的猝灭值, 并且不同的配体对同一种阴离子的猝灭效果也有一定的变化。 当阴离子浓度为目标化合物分子浓度20倍的条件下, I-对所有的目标化合物都表现出了优良的猝灭效果, 而其它的阴离子的猝灭效果不明显或者是没有猝灭, 表明该类目标分子对I-可以达到专一识别作用, 其最低检测限度可达到10 mg/L, 该目标分子可制成试纸用于检测水中的I-。
为进一步验证目标分子对I-的专一识别效果, 由公式:猝灭率=( I0 - I) /I0(式中, I0为目标化合物溶液的最大荧光强度, I为目标化合物与阴离子混合后的最大荧光强度)计算荧光猝灭率, 结果如图2所示, 结果发现目标分子对I-的专一识别效果明显。
 | 图2 不同阴离子对化合物3d、3e、3f和3h的荧光淬灭作用Fig.2 Changes of fluorescent quenching of compounds 3d, 3e, 3f and 3h with the different anions |
2.2.2 目标化合物对阴离子的猝灭机理的讨论 因目标分子与阴离子间的相互作用, 使目标分子的荧光发生了猝灭。 通常猝灭的机理可分为动态猝灭和静态猝灭。 为探究猝灭的机理, 进一步说明淬灭的专一性, 本文选取了对I-具有最佳猝灭效果的化合物3e, 利用紫外分析光谱(UV)、变温荧光和1H NMR经典方法综合评价了猝灭机理。
以 V(乙腈): V(水)=99:1的溶剂配制5种不同浓度的I-溶液:1×10-4、2×10-4、3×10-4、4×10-4和5×10-4 mol/L, 并配制浓度为1×10-5 mol/L的化合物3e溶液。 分别对目标化合物溶液和不同浓度I-溶液进行体积比为1:1的混合, 并测试其紫外吸收, 结果如图3所示。
 | 图3 化合物3e和不同浓度I-离子混合后的紫外光谱Fig.3 UV absorption of compound 3e with different concentration of I- ion c(I-)/(mol·L-1): A.1×10-4; B.2×10-4; C.3×10-4; D.4×10-4; E.5×10-4 |
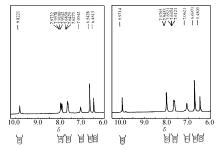
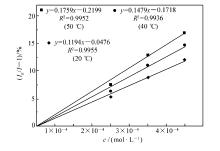
分别在20、40和60 ℃对上述混合溶液进行变温荧光测试, 结果如图4所示。1H NMR的测试:以DMSO-d6为溶剂, 分别进行单纯化合物3e和将20倍量I-浓度与化合物3e混合的1H NMR测试, 结果如图5所示。
 | 图4 化合物3e在不同I-离子浓度下淬灭系数与温度的关系Fig.4 Quenching coefficient curve of compound 3e in different concentration of I- ion and temperature |
分析紫外吸收结果发现:在浓度为1×10-5 mol/L的化合物3e溶液中加入含不同I-浓度的溶液时, 紫外吸收峰未发生位移, 初步说明该类猝灭为动态淬灭。 通过变温荧光测试发现:猝灭系数随着温度的升高而升高, 符合动态猝灭的规律。1H NMR实验结果中发现, 加入I-后, 各吸收峰未发生明显的位移, 进一步证明I-对目标化合物的猝灭方式为动态猝灭。 当动态猝灭发生时, 其它离子的存在一般不会对识别离子产生干扰。
由荧光光谱图和猝灭数据图分析发现, I-对三脚架型苯并咪唑季铵盐类分子具有显著的动态猝灭作用, 目标分子对I-具有优良的荧光识别作用。 当形成季铵盐的苯环上的取代基为甲氧基时, 其猝灭的效果明显;而当取代基为卤素时具有一定的猝灭效果, 但不如甲氧基明显, 说明供电子基在阴离子猝灭中能增强猝灭的效果。 上述结果可能由于苯并咪唑类阳离子受体具有独特的π-π堆积、苯并咪唑骨架中活跃的2-H的存在和目标分子独特的三脚架型结构产生的空间空穴, 当其与阴离子相互作用时, 发现只对与其匹配的I-选择性荧光识别。
设计合成了15种新型三脚架型多苯并咪唑季铵盐类分子, 其中7种目标分子具有较高的细胞分裂素活性, 有望成为植物生长调节剂, 9种目标分子具有优良的除草活性, 有望成为优良的除草剂。 I-对目标分子发生显著的动态猝灭, 化合物3e效果最佳, 猝灭率可以达到85.1%, 有望成为I-荧光识别探针。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|