设计合成了一种新型含磷的水溶性三足体衍生物[L: N-二(吡啶-二氨基乙酰基)甲基磷酸]及其Eu(Ⅲ)的配合物,用红外吸收光谱、元素分析、差热-热重和紫外光谱法等技术手段对该配合物进行了表征,用荧光光谱法研究了室温下该配合物和牛血清白蛋白(BSA)的相互作用。 结果表明,配体与苦味酸铕形成1:1型配合物Eu(pic)3L;配合物与BSA之间有很强的结合作用;配合物对BSA内源荧光的猝灭方式为静态猝灭;配合物与BSA的作用力为分子间氢键和范德华力。 分别考察了Fe3+和Cu2+对配合物与BSA结合作用的影响,证明Fe3+和Cu2+能够以金属离子桥键与配合物结合使配合物-BSA的稳定性增强。 根据Foster型偶极-偶极无辐射能量转移机理可知,配合物可以和BSA以偶极-偶极无辐射进行能量传递。
A novel water-soluble phosphorus-containing tripod ligand [L: N-bis(pyridine-aminoacetyl) methyl phosphate] and its europium complexes was synthesized and characterized by elemental analysis, TG-DSC, IR spectroscopy, UV spectroscopy and molar conductance analysis. In addition, the interaction between bovine serum albumin(BSA) and complexes was investigated with fluorescence spectra at room temperature. The experimental results show that the ligand forms the 1:1 complex Eu(pic)3L with europium picrate. There exists a strong combination action between complexes and BSA. The acting forces between the complexes and BSA are hydrogen bonding and van der Waals interaction. The quenching of BSA by complexes follows the static quenching mechanism. The influence of Fe3+ and Cu2+ on the combination process of the complexes with BSA was investigated. It is found that Fe3+ and Cu2+ can strengthen the interaction of the complex with BSA through the formation a metal bridge bond with the complex. According to Foster type dipole-dipole nonradiative energy transfer mechanism, there is no radiation energy transfer between complexes and BSA by dipole-dipole.
有机膦化合物在医学方面具有重要的应用价值,一些有机膦化合物(如环磷酰胺)曾经作为抗癌药物被应用于临床,因其毒副作用较大己渐渐被其它抗癌药取代。 但是,科研工作者对新型的有机膦抗癌药物的探索从未停止,开发无毒副作用或毒副作用小的高效有机抗癌药物仍是人们研究的热点[1]。 水溶性的含磷衍生物及其配合物是一种DNA的束缚、光敏化剂,它对于DNA的光诱导单电子氧化作用能产生一个新型的发光团。 基于该系列化合物具有体积适中,发光稳定及对环境敏感等性质,该类化合物作为生物荧光探针在分子生物学研究领域具有潜在的应用前景[2,3,4]。 稀土配合物的研究一直深受人们的关注,特别是其在化学或生物系统中作为发光探针、传感器、发光材料的活性中心和电致发光的设备有着广泛的潜在应用[5]。
血清白蛋白是血浆中最为丰富的蛋白质,它具有结合和运输内源性与外源性物质的功能[6],是药物发挥药效的重要载体和靶分子。 探讨具有药理活性的小分子与白蛋白的相互作用机理,对解释药物的代谢和运输过程、研究药物作用机制及药物分子设计等均有重要的理论意义[7,8]。
基于此,本文设计合成了端基带磷酸基团的新型水溶性三足体衍生物(L),并用荧光光谱法研究了其苦味酸铕Eu(pic)3配合物[Eu(pic)3L]与BSA的相互作用机理,并考察了温度、Cu2+和Fe3+对配合物和BSA构象的影响。 为稀土药物的研究开发、更加合理而安全地推广我国丰富的稀土资源在药物领域的应用,合成高效低毒药物以及临床用药提供了实验数据和理论依据。
INOVA-400MHz型核磁共振仪(德国布鲁克公司);FIPR-8400S型红外光谱仪(日本岛津公司);Elementar Vario EL型元素分析仪(德国布鲁克公司);DT-40型热分析仪(日本岛津公司);F-4600型荧光光谱仪(日本日立公司)。
2-氨基吡啶、 N-(膦酰甲基)亚氨基二乙酸、草酰氯等均为分析纯试剂,苯、四氢呋喃、吡啶均用CaH2干燥,实验用水为二次蒸馏水。 光谱法研究配合物与BSA相互作用时,牛血清蛋白(BSA)为市售生化试剂,用pH=7.3的Tris-HCl缓冲溶液(5 mmol/L Tris,50 mmol/L HCl )配制,用于维持离子强度,4 ℃保存备用。
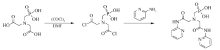
在连有无水CaCl2干燥管和尾气吸收装置的三颈瓶中,加入6 g N-(膦酰甲基)亚氨基二乙酸,50 mL干燥的苯做溶剂,2 mL DMF作催化剂,磁力搅拌均匀,慢慢升高温度,缓慢滴加20 mL草酰氯,控制滴加速度,温度不超过40 ℃,反应56 h,得到淡黄色液体,用旋转蒸发仪除去溶剂和未反应的草酰氯,得黏稠状淡黄色液体,加入50 mL苯溶解并转入连有无水CaCl2干燥管和尾气吸收装置的三颈瓶中。 在冰浴和磁力搅拌下缓慢加入21.9 mL(47.08 mmol)的2-氨基吡啶立即有大量的白烟生成,滴加完毕,恢复室温,升温至40 ℃反应,TCL跟踪,反应10 h,溶液变为黄色。 在旋转蒸发仪上除去溶剂,进行柱分离,梯度洗脱,得到配体L,其合成路线如图1所示。 IR, σ/cm-1:3429(O—H),3412(N—H),1465( 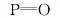
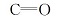
室温下向圆底烧瓶中加入10 mL(0.1 mmol)含配体的无水乙醇溶液,缓慢滴加含有10 mL(0.1 mmol)的铕苦味酸盐,搅拌过夜,离心过滤,并用无水乙醇洗涤数次,于干燥器里干燥,得到淡黄色的稀土配合物Eu(pic)3L。
Eu(pic)3L的元素分析理论值(测定值)/%:C 32.62(32.67),H 1.90(1.73),N 16.15(16.17),Eu 12.52(12.54)。
1.3.1 温度对BSA与配合物作用的影响 用pH=7.3的Tris-HCl缓冲溶液配制1.0×10-5 mol/L的牛血清蛋白溶液和1.0×10-5 mol/L的配合物溶液。 在10个10.0 mL的容量瓶中用微量取样器注入100 μL的BSA溶液,分别一系列浓度配合物溶液,用Tris-盐酸溶液定容,混合均匀,放入30 ℃的水浴中2 h后取出。 于1 cm石英比色皿中,以 λex=280 nm记录溶液的荧光光谱,扫描波长范围为250500 nm,观察荧光强度大小的变化。 实验过程中水浴控制样品的温度。 用同样的方法扫描体系在20 ℃时反应的发射光谱,并观察荧光强度大小的变化。
1.3.2 Cu2+和Fe3+对BSA与配合物作用的影响 先用Tris-盐酸缓冲溶液配制5×10-3 mol/L的FeCl3溶液50.0 mL,再用微量取样器取100 μL该溶液至另一个50.0 mL容量瓶中,用前面配好的BSA标液定容至刻度,配成含有1.0×10-5 mol/L Fe3+的BSA标液。 在10个10.0 mL的容量瓶中分别加入1000 μL该含Fe3+的BSA标液,再分别加入一系列浓度配合物溶液,用Tris-盐酸溶液定容,分别将它们置于30 ℃的水浴中反应2 h后取出,于1 cm石英比色皿中,以 λex=280 nm记录溶液的荧光光谱,扫描波长范围为250500 nm,观察荧光强度大小的变化。
用同样的方法扫描含有1.0×10-5 mol/L Cu2+的BSA标液与配合物反应的荧光发射光谱,观察荧光强度的变化。
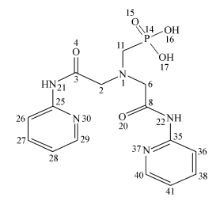
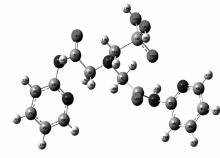
2.1.1 配体的量化计算图2为配体原子编号,其优化后的结构示意图如图3所示。 由图3可见,此三足体的结构并非平面的对称结构而是立体的非对称结构,它的3条支链向空间三维方向发展,并且每两条支链的夹角也各不相同。 由于三足体衍生物的三条支链是可以自由翻转的,当它与金属离子结合时,可以利用三条支链的柔性调整其配位结构,形成一个合适的空腔来容纳金属离子,使金属离子尽可能多的与配体中的配位原子配位。 因三足体衍生物所形成空腔空间大小的限制,配体与稀土离子倾向于形成的1:1配位化合物。
空间上,吡啶环的平面结构会阻碍37N和30N与金属离子形成配位键。 由表1中Mulhken布局分析得到配体中部分原子的净电荷分布可知,21N、22N、15O、16O、20O和4O均带有较多的负电荷,且它们可以随支链的翻转来调配自己的位置,使其刚好处于配体的空腔内部,与金属离子形成配位键。 根据配体的结构可知,氨基是与吡啶环直接连接的,氨基氮被去质子化,去质子化后酰胺C—N键变短,还有更多双键的性质[9],这大大减弱了C—N的旋转, 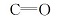
| 表1 配体的部分原子净电荷分布 Table 1 The net charge distribution of the partial ligand |
2.1.2 红外吸收光谱 配体及配合物的红外数据见表2,配体中—NH的振动吸收峰在3412 cm-1处,而配合物中—NH的振动吸收峰却发生了蓝移,可以推断是由于配位效应使21N和22N所处化学环境发生了改变[10],且明显对相连官能团 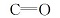
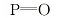
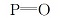
| 表2 配体及配合物的IR数据 Table 2 The IR data of the complex and ligand(cm-1) |
2.1.3 元素分析 配合物易溶于DMSO、DMF、乙醇、甲醇、水,微溶于乙酸乙酯、氯仿,不溶于苯和乙醚。 配体及配合物的元素分析数据结果(见1.2节)表明铕的苦味酸盐与配体形成了1:1型配合物[13]。
2.1.4 摩尔比法 对于配合物体系而言,组成配合物的中心离子和配体的吸收光谱与配合物不重合,所以用摩尔比法测定350 nm处配体与稀土金属离子的配位比。 摩尔比法的紫外光谱图如图4 A所示,随着Eu3+离子浓度的增加,吸收曲线的变化反映出了配合物不断形成的过程。 在摩尔比法得到的曲线(图4 B)中,当浓度比大于1之后,出现平台,说明配体与稀土离子配位以1:1的形式配位[14,15]。
 | 图4 配何物350 nm处的紫外吸收光谱Fig.4 UV-Vis spectra of the Ligand with complexes in 350 nm c(Eu(pic)3L)=1×10-5 mol/L, 106 c(Eu3+)/(mol·L-1):0, 2, 4, 6, 8, 10, 12, 14, 16 18, 20 |
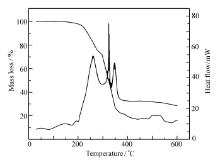
2.1.5 差热-热重 在升温速度10 ℃/min,N2流速为40 mL/min条件下,测定了配合物20~600 ℃的TG-DSC曲线如图5所示。 配合物在低于200 ℃无热现象和失重现象,表明配合物中不存在结晶水。 温度由200 ℃升至300 ℃的过程中配合物渐渐失去配体。 当温度达到300 ℃时配合物完全失去了配体,在此过程中的失重率为30.97%,与理论1:1配位配体的失重率31.24%基本吻合。 随着温度的继续升高,配合物渐渐失去苦味酸根离子。 当温度达到600 ℃时,配合物完全失去苦味酸根离子,在此过程中配合物的失重率为55.32%,与理论1:1配位苦味酸根的失重率56.389%基本吻合。 由上述实验结果可知,Eu(Ⅲ)与配体以1:1配位[16]。
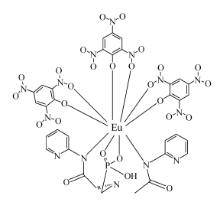
2.1.6 配合物的组成和结构 由以上元素分析、红外光谱、差热-热重和配体与金属离子的配位反应的结果可知,金属离子与配体的配位比为1:1,从而得出配合物的组成为Eu(pic)3L,配合物的分子结构示意图如图6所示。
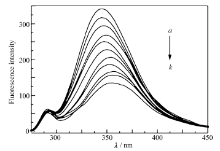
2.2.1 荧光光谱 蛋白质分子因其自身的氨基酸残基(酪氨酸,色氨酸及苯丙氨酸等)使其具有内源性荧光。 酪氨酸、色氨酸及苯丙氨酸的结构不同,它们的荧光强度比为100:9:0.5[17],因此认为蛋白质的荧光主要由色氨酸残基提供,且蛋白质原本的荧光及其变化能直接反映蛋白质内色氨酸残基自身及其所处环境的变化。 模拟生理条件,以激发波长 λex=280 nm分别激发BSA溶液和配合物溶液,BSA在 λem=350 nm处有很强的发射峰。图7为30 ℃时Eu(pic)3L对BSA溶液荧光影响发射光谱。 固定BSA的浓度,依次加入等体积的Eu(pic)3L溶液,随着Eu(pic)3L浓度的增加,BSA的荧光发射强度呈现有规律的猝灭,说明Eu(pic)3L与BSA通过一定的作用形成了不发荧光的复合物Eu(pic)3L-BSA。 从图7还可以看到,BSA的最大荧光发射峰有略微的红移(由348 nm移至357 nm),BSA中348 nm处的发射峰是由色氨酸残基产生的,而色氨酸残基的最大发射波长与它周围的环境有关,发射波长红移表明BSA中色氨酸残基周围的疏水性降低。
ak: c(BSA)=1×10-7 mol/L, 107 c(Eu(pic)3L)/(mol·L-1):0, 1.0, 2.0, 3,0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0
2.2.2 荧光猝灭方式 使BSA荧光发生猝灭的主要方式为静态猝灭和动态猝灭[18]。 无论是静态猝灭还是动态猝灭,配合物和BSA的猝灭效率均遵循Stern-Volmer方程(1)[19] :
F0/F=1+k qt0c Q=1+K svc Q(1)
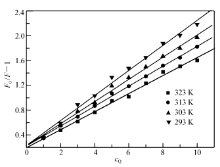
式中, F0与 F分别为BSA及BSA与配合物的混合体系的荧光发射光谱在350 nm处的相对荧光强度, Kq为猝灭速率常数, τ0为荧光寿命(约为10-8 s), Ksv为Stern-Volmer常数, cQ为猝灭剂的浓度,根据以上实验结果,以 F0 /F与所加入的配合物的浓度 cQ作图,得到牛血清蛋白的Stern-Volmer猝灭曲线,结果如图8所示,由Stern-Volmer方程求得猝灭速率常数见表3。
| 表3 不同温度时配合物与BSA作用的 Ksv值 Table 3 Ksv date of Eu complex and BSA at different temperatures |
由于动态猝灭与分子的扩散有关,温度升高将增大扩散系数,从而使荧光猝灭效率增大,猝灭常数增大[20]。 而静态猝灭与之相反,温度升高可能会引起配合物的稳定性下降,使荧光猝灭效率降低。此反应中,Eu(pic)3L对BSA荧光猝灭过程的速率常数,要比文献中报道的各类猝灭剂对生物高聚物的最大动态猝灭常数(2.0×1010 L/(mol·s))[21]大2个数量级,且反应的 Ksv随着温度的升高而降低,表明Eu(pic)3L对BSA的猝灭方式为静态猝灭[17]。
2.2.3 静态猝灭法 分析配合物与BSA的结合常数和结合位点对于静态猝灭,猝灭剂与蛋白质荧光强度的关系求可用Scatchard方程(2)[22]进行描述:
lg
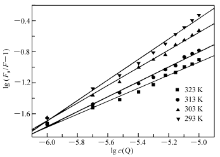
式中, F0为未加猝灭剂时的荧光强度, F为加入猝灭剂后的荧光强度, K为荧光体-猝灭剂的结合常数, cQ为配合物的浓度, n为结合位点数。 将不同温度下BSA与配合物混合体系的荧光发射光谱在350 nm处的 F0及 F带入上式,以 lg ( F0 /F-1)对lg cQ作图,得一直线。 可根据图求出不同温度下配合物和BSA的结合常数 K,相关系数 r2及结合位点数 n。
图9给出了Eu(pic)3L猝灭BSA的双对数曲线,在20、30、40和50 ℃时,Eu(pic)3L与BSA之间的结合常数( Ka),相关系数以及结合位点数 n见表4。 由表4数据可以看出,随着温度的升高,结合常数减小,结合位点数增大。 由于温度升高导致了Eu(pic)3L-BSA复合物的扩散系数增大,使 Eu(pic)3L-BSA复合物的稳定性降低[19],结合常数减小。 但是温度升高会导致BSA的构象发生变化,使Eu(pic)3L与BSA可发生作用的位点增多。 由上述实验结果可知,当温度在30 ℃与40 ℃之间时,Eu(pic)3L与BSA之间不仅有很强的作用力而且有较多的结合位点,而生物体内环境的温度刚好在此温度范围之内,由此可见,此配合物在生物体内可以很好的与牛血清白蛋白结合发挥药效。
| 表4 不同温度时配合物与BSA作用的 K和 n值 Table 4 Binding constant, R2 and binding site of complex-BSA |
2.2.4 配合物与BSA的作用力类型 药物分子和白蛋白等生物大分子间的结合力主要有氢键、静电引力、疏水作用力、范德华力等。不同的药物分子与白蛋白的结合力类型不同,通过方程(3)、(4)和(5)计算出的热力学参数焓变Δ H和熵变Δ S的相对变化,来解释配合物与BSA之间的相互作用。 如果温度变化不是很大,焓变值(Δ H)可以看作常数,可以通过热力学公式求得相关参数。
ΔG=-RT ln K a(3)
式中, R为气体常数, T为实验温度, K为与 T相对应的结合常数。 焓变值和熵变值可以通过下列方程式计算得到:
ln K2/K1=(
式中, K1和 K2分别是温度 T1、 T2下的结合常数。
ΔG= ΔH-T ΔS(5)
Mohammed等总结出判断生物大分子与小分子结合力的热力学规律,即:当体系为疏水及静电作用力时Δ S>0;主要为疏水作用力时Δ S>0,Δ H>0;主要为静电作用力时Δ S>0,Δ H≈0或Δ H<0;为氢键和范德华力时Δ S<0,Δ H<0[23]。 从表5数据中可以看出,配合物与BSA相互作用时Δ G<0,说明该反应为自发过程;Eu(pic)3L-BSA体系的Δ S和Δ H均小于0,表明Eu(pic)3L与BSA之间的主要作用力为氢键和范德华力。
| 表5 配合物与BSA相互作用的热力学参数 Table 5 The thermodynamic parameters of complex-BSA binding process |
2.2.5 配合物与BSA相互作用时的距离 根据Foster型偶极-偶极无辐射能量转移机理[22],转移效率( E)与给体(BSA)-受体(配合物)间距离( d)及临界能量转移距离( d0/nm)[即转移效率为50%时的临界距离]有关:
E=
式中, k为偶极空间取向因子, n为介质的折射指数, Φ为BSA的荧光量子产率, J为配合物的荧光发射光谱与配合物的吸收光谱间的光谱重叠积分,可表示为:
J=ΣF D(ν)ε Aν-4Δ v/ΣFD νΔ ν(8)
式中,F(ν)为 BSA在波数ν处的荧光强度,ε(ν)为配合物在波数ν处的摩尔吸收系数。
E=1 -F/F0(9)
式中,F和F0分别为加入猝灭剂和不加猝灭剂时的荧光强度[24]。
在30 ℃下分别测定 BSA的荧光发射光谱和配合物与 BSA的摩尔比为1 :1时的紫外吸收光谱,其光谱重叠情况如图10所示。 用微积分的方法求得光谱重叠部分的面积J;K取给体 -受体各向随机分布的平均值K2 =2 /3,n取水和有机物的平均值n =1 .336, BSA中色氨酸的量子产率Φ =0 .15[25],将这些值分别代入上面各式求得:J =1 .75 ×104 ( cm3· L) /mol,R0 =1 .859 nm,E =0 .26,d =2 .213 nm。 这说明 Eu( pic)3 L与 BSA之间的能量传递机理为允许的电偶极 -偶极作用。
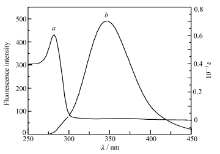 | 图10 BSA的荧光发射光谱及配合和 BSA1 :1时紫外吸收光谱Fig.10 Fluorescence emission of BSA(b) and UV absorption spectra of complexes |
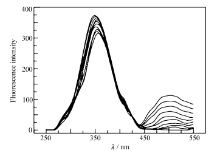 | 图11 配合物对 BSA的猝灭光谱Fig.11 The quenching effect of complexes on BSA fluorescence intensity Complexes. 0, 1 .0 ×10 -7, 2 .0 ×10 -7…9 .0 ×10 -7 mol/L |
2 .2 .6 Fe3 +、 Cu2 +对配合物 -BSA作用的影响 由于铜和铁均是人体必需的微量元素[26],它们均是体内一些酶的核心部分[21],并且参与人体的代谢过程,说明 Fe3 +和 Cu2 +对血液血浆中药物分子与靶细胞结合有很大的影响[27]。 因此,我们研究了30 ℃时 Fe3 +和 Cu2 +对配合物与 BSA荧光猝灭光谱的影响。
30 ℃时配合物对含有 Fe3 +和 Cu2 +的 BSA的荧光猝灭光谱见图12和图13,与配合物对 BSA的猝灭光谱图11相比, BSA发射光谱对应的荧光强度下降较明显,而对于配合物发射光谱的荧光强度基本没有太大的影响。 由此可以推断,这是由于 Fe3 +和 Cu2 +与 Eu( pic)3 L以金属桥键结合导致 BSA荧光猝灭程度增大。 随着配合物浓度的增加,含有 Fe3 +和 Cu2 +的 BSA溶液的最大荧光发射峰比 BSA溶液的最大荧光发射峰红移更明显,表明 Fe3 +和 Cu2 +与 Eu( pic)3 L以金属桥键结合后能够更好的与 BSA发生相互作用,导致 BSA中色氨酸残基周围疏水性更底[28]。 Fe3 +和 Cu2 +对 BSA荧光猝灭的 Stern-Volmer图见图14和图15。
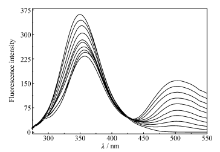 | 图12 30 ℃时配合物对含有 Fe3 +BSA的荧光猝灭效应Fig.12 The quenching effect of complex on BSA in presence of Fe3 +ions |
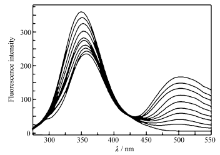 | 图13 30 ℃时配合物对含有 Cu2 +BSA的荧光猝灭效应Fig.13 The quenching effect of complex on BSA in presence of Cu2 +ions |
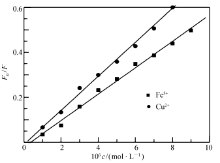 | 图14 Fe3 +和 Cu2 +对 BSA猝灭效应的 Stern-Volmer曲线Fig.14 The Stern-Volmer curves of fluorescence quenching of BSA in presence of Cu2 + and Fe3 + ions, respectively |
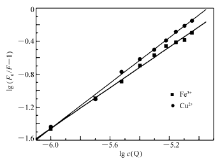 | 图15 Fe3 +和 Cu2 +对 BSA猝灭效应的双对数曲线Fig.15 Double-log plot of puerarin quenching effect on BSA in presence of Cu2 + and Fe3 + ions, respectively |
从表6可以看到,加入 Cu2 +和 Fe3 +后 Eu( pic)3 L-BSA结合常数增大一个数量级,这可能与通过金属离子桥键结合的金属离子 -配合物的形成有关,导致 Eu( pic)3 L与 BSA的结合位点数增多,使 Eu( pic)3 L与 BSA形成的复合物稳定性增强。 这说明加入 Fe3 +和 Cu2 +可以延长 Eu( pic)3 L在血液血浆中的存在时间,使其发挥作用的时间增长。
| 表6 Fe3+、Cu2+存在时配合物与BSA体系的结合参数 Table 6 The binding parameters for the system of complex-BSA system with Fe3+and Cu2+ |
合成了一种新型水溶性含磷三脚架配体及其铕的配合物Eu(pic)3L,采用荧光光谱法研究了配合物与BSA的相互作用。 结果表明,该配合物对BSA的荧光猝灭方式为静态猝灭过程,荧光猝灭归因于配合物-BSA为不发荧光的复合物,但Eu(pic)3L与BSA仍然只有单一的作用位点,它是以分子间氢键和范德华力的作用形式改变BSA内的氨基酸残基的构象及其周围环境;加入Fe3+和Cu2+后,金属离子与Eu(pic)3L通过金属离子桥键结合,导致配合物与BSA的结合点数增加,使Eu(pic)3L-BSA复合物的稳定性增强,延长了该配合物在血浆中的停留时间;根据Foster型偶极-偶极无辐射能量转移机理,求得Eu(pic)3L-BSA的能量转移效率 E为0.26,二者间相互作用的最近距离为2.213 nm,这表明配合物可以和BSA以偶极-偶极无辐射进行能量传递。 这些信息对于了解配合物在生物体内的吸收、发布、代谢具有重要的意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|