比较了不同碱溶液中纳米Mn3O4的制备及其超级电容性能。用X射线粉末衍射仪、扫描电子显微镜和原子力显微镜等技术手段分别测试了晶体结构和表面形貌。用循环伏安、恒流充放电和交流阻抗测试了材料的电化学性能。结果表明,在氢氧化钠、氨水中Mn2+沉淀氧化可以直接制备纳米Mn3O4;碳酸钠中先生成MnCO3,加氢氧化钠可转化为纳米Mn3O4。NaOH、NH3和Na2CO3 3种介质中制备的Mn3O4晶粒尺寸分别为29.5、20.2和36.3 nm。纳米Mn3O4经连续充放电循环后可活化为Birnessite-type MnO2。氨水中制备的Mn3O4活化后比容量最大,达到239 F/g,是一种具有应用前景的超级电容器材料。
Mn3O4 nanoparticles were prepared in alkaline solution and their electrochemical characteristics were investigated. The obtained Mn3O4 nanoparticles were characterized by scanning electron microscopy(SEM), X-ray diffraction analysis(XRD), cyclicvoltammetry(CV), galvanostatic charge/discharge(GC/D), and electrochemical impedance spectroscopy(EIS). The Mn3O4 nanoparticles can be prepared directly in NaOH and NH3 solution. MnCO3 is only obtained in Na2CO3 solution, and can be transformed to Mn3O4 nanoparticles in the presence of NaOH. The crystalline sizes of the Mn3O4 nanoparticles prepared in NaOH, NH3 and Na2CO3 solution are 29.5 nm, 20.2 nm and 36.3 nm, respectively. The Mn3O4 nanoparticles could be conditioned and inverted to birnessite-type MnO2. A specific capacitance of 239 F/g is obtained for the conditioned Mn3O4 nanoparticles prepared in NH3 solution at a current rate of 0.25 A/g. Therefore, the Mn3O4 nanoparticles obtained in NH3 solution can be a promising electrode materials for supercapacitors.
超级电容器又叫电化学电容器。与传统电容器相比,超级电容器具有更高的功率密度和能量密度,具有广阔的应用前景。目前用于超级电容器的材料主要有活性碳[1,2]、过渡金属氧化物[3,4,5]、导电聚合物[6,7]等。锰具有多种氧化物,广泛应用于碱锰电池、锂离子电池[8,9]、电化学电容器[10,11,12,13]、软磁性铁氧体材料和催化材料。MnO2具有超级电容特性,由于其理论电容量大,循环性能稳定,容易制备,使用条件温和,无毒,且锰在地壳中储量大,被认为最有前景的超级电容器材料之一,因而受到了广泛研究。MnO2的超级电容与它的制备方法有关,MnO2粉末电极的比电容一般在100~200 F/g。Mn3O4是一种稳定的锰氧化物,广泛应用于软磁材料、催化材材和电池材料。一般认为Mn3O4的电化学活性较小,但研究表明Mn3O4在循环充放电过程中能够逐步转化成层状MnO2(Birnessite-type MnO2)[14,15,16,17,18,19,20,21],这种原位转化的层状MnO2具有优良的超级电容特性。Mn3O4的电化学转化电容与它的晶体结构取向、颗粒大小密切相关[15,16]。通过电化学转化,薄膜Mn3O4电极的转化电容可达330 F/g[17],粉末Mn3O4电极的电容一般在190~220 F/g[16,18]。目前制备超级电容器用的Mn3O4多采用水热法[15,18,21],这种方法制备的Mn3O4转(活)化时间较长,一般需要几百次的电势循环才能完全转化成层状MnO2。因此,制备活化时间短、转化电容高的Mn3O4具有重要意义,本文研究了不同碱性介质中制备纳米Mn3O4以及它们的电化学特性。
实验所用试剂均为分析纯。CHI760E型电化学工作站(上海辰华仪器有限公司),Quanta 200型扫描电子显微镜(SEM, 荷兰FEI公司),Bruker Dimension icon PT型原子力显微镜(AFM,德国Bruker公司),Bruker-D-8Advance Cu Kα型X射线粉末衍射仪(XRD,德国Bruker公司)。
采用3种不同的碱沉淀Mn2+离子,再利用空气氧化制备Mn3O4。称取3 g MnCl2·4H2O、0.2 g聚乙烯吡咯烷酮(PVP),加入20 mL乙醇、100 mL水溶解,强烈搅拌下分别加入不同的碱(50 mL 1 mol/L NaOH,50 mL 1 mol/L NH3,50 mL 1.5 mol/L Na2CO3),室温下继续搅拌4 h,然后抽滤,洗涤至中性,60 ℃干燥12 h。为方便起见,3种产物简记为SMn-1、SMn-2和SMn-3。为研究Na2CO3碱性介质中制备Mn3O4,也制备了SMn-4:在制备SMn-3步骤中,加入50 mL 1.5 mol/L Na2CO3后,再加入50 mL 1 mol/L NaOH,室温下继续搅拌4 h,然后抽滤,洗涤至中性,60 ℃干燥12 h。
分别称取质量配比为80∶15∶5的样品(SMn-1、SMn-2、SMn-3和SMn-4)、乙炔黑、聚偏氟乙烯(PVDF),混和均匀后加入适量的 N-甲基吡咯烷酮(NMP),搅拌成糊状,涂在泡沫镍基体上(1 cm×1 cm),活性物质质量控制在4 mg左右,90 ℃下真空干燥5 h。泡沫镍在使用前用0.1 mol/L HCl仔细清洗,再用蒸馏水反复清洗。电化学测试采用三电极系统:SCE为参比电极、铂片为辅助电极,电解液为0.5 mol/L Na2SO4溶液。
晶体结构及形貌测试分别在X射线粉末衍射仪、扫描电子显微镜和原子力显微镜上进行。
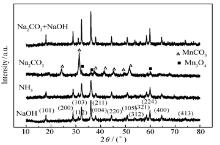
图1为制备产物的XRD图谱。SMn-1、SMn-2和SMn-4衍射图谱的峰位置相同,所有的衍射峰与标准图谱(JCPDS No.80-0382)匹配,确定为Hausmannite-type Mn3O4。除此之外,没有其它的衍射峰,表明产品很纯。SMn-3衍射图谱主要相为MnCO3(JCPDS No.86-017)和少量Mn3O4相。表明在氢氧化钠和氨水介质中Mn2+沉淀氧化可以直接制备Mn3O4,在碳酸钠碱性介质中Mn2+沉淀只能得到MnCO3,不能得到Mn3O4。生成的MnCO3在NaOH介质中可以转化成Mn3O4。有关反应如下:
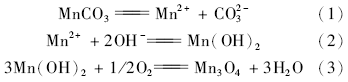
由于Mn(OH)2和MnCO3的 Ksp分别为:1.9×10-13、2.2×10-11,二者相差不是特别大,由于碳酸钠过量,MnCO3离解产生的Mn2+浓度很小,因而需加入强碱性的NaOH,才能将MnCO3转化为Mn3O4。
图1中SMn-1、SMn-2和SMn-4衍射峰宽度也明显不同:SMn-2明显宽化,表明晶粒细小。由Scherrer公式: d=
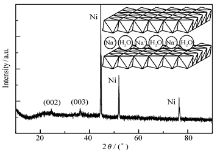
图2 A、 B、 C为SMn-1、SMn-4和SMn-2的SEM图。由图可见,所有的Mn3O4尺寸均小于100 nm,大小不一,且小颗粒团聚成较大颗粒,导致3种Mn3O4颗粒尺寸看上去相差不大。图2 D为SMn-2的AFM图。图中可以看出,氨水中制备的Mn3O4颗粒大小为20~40 nm。
采用连续电势循环可将Mn3O4氧化成层状MnO2[14,15,16,17,18,19,20,21],电极反应式为:
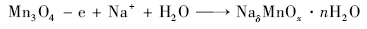 |
Mn3O4具有尖晶石结构,Mn(Ⅱ)占据四面体空隙,Mn(Ⅲ)占据八面体空隙。首先,Mn(Ⅱ)从晶格位置释放出来,在阳极氧化,Mn(Ⅱ)变成Mn(Ⅳ),在Mn3O4表面上形成纳米结构MnO2。Mn(Ⅲ)的3 d轨道电子排布为(
图4 A、 B、 C分别为SMn-1、SMn-2、SMn-4在不同恒电流充放电(GC/D)次数时的充放电曲线。充放电曲线为对称三角形,这是典型的电容特性。图中显示,SMn-1、SMn-2和SMn-4分别经过120、60和200次1 A/g充放电循环后,充放电曲线接近稳定,充放电时间不再增加,容量(质量比电容,SC)分别达到182、217和180 F/g。SMn-4活化次数最长,这与它的晶粒尺寸最大有关,因为Mn3O4电化学转化成MnO2是由表及里进行,因而晶粒越大,转化越慢。SMn-1、SMn-2、SMn-4电化学转化后容量也不完全相同,这可能与3种Mn3O4晶粒取向不同有关。有文献报道[15],Mn3O4晶体取向会影响它的转化电容。因为Mn3O4电化学转化成MnO2过程中,涉及到Mn(Ⅱ)的释放。从图1可以看出,SMn-2衍射峰(103)和(211)的强度差比SMn-1、SMn-4的小一些,显示SMn-2与SMn-1、SMn-4的晶体取向有差异,可能与SMn-2具有最短的活化时间和最大的比电容有一定的关系。
为比较Mn3O4电化学转化(活化)成Birnessite-type MnO2前后的电化学性能,测试了材料电化学转化前后的循环伏安曲线和交流阻抗曲线。图5为SMn-2活化前后的循环伏安曲线和交流阻抗曲线。SMn-2经1 A/g充放电循环60次后,循环伏安曲线包围的面积明显增大,且在0.41和0.62 V出现了氧化还原峰,与文献报道一致[16,17,18]。这是因为MnO2存储电荷只涉及到近表层MnO2,多次充放电循环后会有部分离子(H+,Na+)嵌入到MnO2内部,受扩散控制,从而形成氧化还原峰。充放电循环活化后交流阻抗中高频区半圆半径变小了,表明MnO2比Mn3O4更易于进行充放电反应,具有更好的电化学电容特性。
图6 A为SMn-2不同扫描速率循环伏安图。在低扫描速率下曲线呈矩形,扫描速率增大,曲线渐渐偏离矩形,这是因为电极材料存在电阻;图6 B为SMn-1、SMn-2和SMn-4循环伏安图(10 mV/s)。SMn-2伏安曲线包围的面积明显大于SMn-1和SMn-4,说明SMn-2具有更好的电容行为。图6 C为SMn-2不同电流倍率充放电曲线,曲线为对称的三角形。图6 D为SMn-1、SMn-2、SMn-4不同电流倍率对电容关系曲线。该图显示,SMn-2的电容最大,在0.25 A/g电流倍率下放电电容达到239 F/g,在8 A/g电流倍率下电容仍达到128 F/g,说明SMn-2具有高的质量比电容和倍率电容。值得说明的是我们制备的电极为粉末电极,电极质量达到4×10-3 g/cm2。这一结果好于文献报道的Mn3O4电容值:球磨的Mn3O4(190 F/g)[16];水热法制备的Mn3O4微球(219 F/g)[17];水热法制备的Mn3O4纳米片(237 F/g)纳米颗粒(226 F/g)[21],化学池沉积的Mn3O4薄膜(223 F/g)[20]。这些结果说明氨水法制备的Mn3O4电化学转化成Birnessite-type MnO2后具有优良的超级电容性能,是一种理想的超级电容器材料。
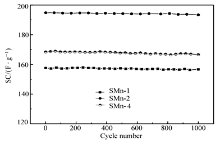
图7表明SMn-1、SMn-2和SMn-4 均具有很好的循环稳定性,1000次2 A/g充放电循环后,容量下降小于1.5%。表明这3种方法制备的Mn3O4均可以用于超级电容器材料。
在氢氧化钠、氨水介质中Mn2+沉淀氧化可直接制备纳米Mn3O4;而在碳酸钠介质下只得到MnCO3,加入氢氧化钠可将碳酸锰转化为Mn3O4。不同条件下制备的Mn3O4晶粒尺寸不同,活化次数、超级电容也有差异。氨水介质中制备的Mn3O4具有最小的晶粒尺寸;最容易活化成MnO2,60次1 A/g充放电循环后可转化层状MnO2,0.25 A/g的放电容量可达239 F/g。氨水介质中制备的Mn3O4具有最好的超级电容性能,是一种理想的超级电容器材料。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|