以4-羟基-2-丁酮和异丙叉丙酮为起始原料,经羟醛缩合、不对称氢化、羰基还原、钌催化氢化等4步反应制得左旋薄荷醇。总产率为33%,非对映体过量 de值达到93%。详细探讨了铜催化剂及其用量、手性配体的选择、反应溶剂和时间等因素对胡薄荷烯酮不对称氢化反应的影响。中间体及目标化合物均通过了1H NMR、13C NMR和HRMS等技术手段的分析测定及结构表征。
L-menthol was synthesized from the starting materials of 4-hydroxy-2-butanone and mesityl oxide in four steps consisting of aldol condensation, asymmetric hydrogenation, reduction of carbonyl group, and ruthenium catalyzed hydrogenation. The total yield is 33% and the diastereomeric excess is 93%. Furthermore, the effects of copper catalysts and their loading, chiral ligands, reaction time and solvents on the asymmetric hydrogenation of piperitenone were discussed in details. The intermediates and target compound were identified and characterized by1H NMR,13C NMR and HRMS.
左旋薄荷醇因其具有独特的薄荷香气和极强的清凉作用,被广泛用于食品工业、日用精细化工和医药卫生等方面[1]。德国德之馨公司[2,3]和日本高砂公司[4,5,6]较早地开展了左旋薄荷醇合成研究,并已成功实现工业化生产。2010年,德国巴斯夫公司宣布进军薄荷醇市场,其借助先进的精馏设备和铑催化不对称氢化核心技术完成了左旋薄荷醇的制备[7]。2012年,日本高砂公司也相继报道了采用有机小分子催化氢化合成左旋薄荷醇的新方法[8,9]。
作为一种用途广泛的过渡金属,铜往往会呈现出多种价态,“铜化学”因此变得丰富多彩[10]。铜化合物一般具有低毒、价廉易得、催化反应条件温和等特点[11]。这就使得有机铜化合物在不对称催化研究领域始终扮演重要角色。近年来,铜催化不对称氢化反应进展迅猛,铜催化剂和系列手性配体组成的催化体系,在芳香酮[12,13,14]、杂环酮[14]、丙烯腈[15]和丙烯酸酯[16]等常见底物的不对称氢化还原反应中表现出优越的催化活性。
高旋光纯度的胡薄荷酮是合成左旋薄荷醇的重要中间体。Solodar等[17]最先报道了以胡薄荷烯酮为底物,通过均相铑配合物催化剂催化不对称氢化得到胡薄荷酮的方法。2008年,Ohshima等[18]采用配合物双(1,5-环辛二烯)四氟硼酸铑(Ⅰ){[Rh(COD)2]BF4}、手性配体( S)-(-)-5,5'-双[二(3,5-二叔丁基-4-甲氧基苯基)膦]-4,4'-二-1,3-苯并二氧烷[( S)-DTBM-SEGPHOS]、添加剂四亚甲基双(三苯基溴化膦鎓)[(CH2CH2PPH3Br)2]组成的催化体系催化胡薄荷烯酮不对称氢化,得到高旋光纯度的胡薄荷酮,反应转化率和对映体过量 ee值均达到98%。2009年,Shimizu等[19]尝试用双(三苯基膦)硝酸铜(Ⅰ)[Cu(NO3)(PPh3)2]代替铑配合物,同样获得了较高的产率和对映选择性。
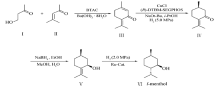
本文以常见的4-羟基-2-丁酮和异丙叉丙酮为合成起始原料,关键的第二步采用催化剂CuCl和手性膦配体( R)-DTBM-SEGPHOS组成的催化体系,在碱性介质中催化不对称氢化得到右旋胡薄荷酮,再经过连续的还原反应最终完成了左旋薄荷醇的合成。与[Rh(cod)2]BF4、[Cu(NO3)(PPh3)2]相比,CuCl更加价廉易得。因此,本文合成方法具有催化剂常见易得、合成成本降低、便于实现工业化生产等优点。左旋薄荷醇的合成路线见Scheme 1。
AB SCIEX TripleTOF 5600型高分辨质谱仪(美国AB SCIEX公司);Bruker Avance Ⅲ型核磁共振仪(瑞士Bruker公司);Agilent 7690型气相色谱仪(美国Agilent公司);Hydrodex- β-TBDAc 25m 0.25mm型 β-环糊精手性毛细管柱(德国MN公司);SGW-1型自动旋光仪(上海精密科学仪器有限公司);PARR 4751型高压反应釜(美国PARR公司)。
异丙叉丙酮、4-羟基-2-丁酮、苄基三乙基氯化铵、八水合氢氧化钡、CuCl、叔丁醇钠(百灵威科技有限公司);( R)-DTBM-SEGPHOS等手性配体、Ru(OAc)2[( S)-DM-BINAP](梯希爱(上海)化成工业发展有限公司);甲醇、异丙醇等常见溶剂为国产AR试剂,部分溶剂进行了无水处理。
化合物右旋胡薄荷酮(Ⅳ)、左旋胡薄荷醇(Ⅴ)、左旋薄荷醇(Ⅵ)手性GC分析条件为:气相色谱仪Agilent 7690;检测器:FID; β-环糊精手性毛细管柱Hydrodex- β-TBDAc 25m 0.25mm;柱箱温度:50.0 ℃;进样温度250.0 ℃;压力70.2 kPa;总流量20.7 mL/min;柱流量1.0 mL/min;线速度24.5 cm/sec;吹扫流量10.0 mL/min;分流比20.0;柱温箱升温程序:50 ℃保持4 min,以1.0 ℃/min的速率升温到120 ℃,保持1 min,以20.0 ℃/min的速率升温至180 ℃,保持3 min。
1.2.1 胡薄荷烯酮(Ⅲ)的合成 参考文献[20],将异丙叉丙酮137.0 mL(117.8 g,1.2 mol)、Ba(OH)2·8H2O(1.3 g,4.0 mmol)和苄基三乙基氯化铵BTAC(455.0 mg,2.0 mmol)依次加入500 mL三颈瓶中,升温至70 ℃后以滴液漏斗逐滴加入34.0 mL 4-羟基-2-丁酮(35.2 g,0.4 mol),加完后于70 ℃下继续搅拌反应30 min。冷至室温,加入适量冰醋酸将反应液调至pH值为7.0,减压精馏收集102~105 ℃(1333 Pa)(文献[20]值95~125 ℃,1333 Pa)馏分,得淡黄色液体33.6 g,产率56%。1H NMR(400 MHz,CDCl3), δ:5.85~5.84(m,1H),2.62(t, J=6.0 Hz,2H),2.26(t, J=6.0 Hz,2H),2.05~2.04(m,3H),1.90~1.89(m,3H),1.82(s,3H);13C NMR(100 MHz,CDCl3), δ:191.7 ,159.7,142.5,129.0,128.8,31.9,27.9,23.8,22.9,22.5;HRMS(ESI)理论值C10H14O(M+H)+: 151.1123;测定值151.1116。
1.2.2 右旋胡薄荷酮(Ⅳ)的合成 参考文献[19],将催化剂CuCl(5.3 mg,0.054 mmol)、手性膦配体( R)-DTBM-SEGPHOS(63.9 mg,0.054 mmol)和添加剂NaO t-Bu(51.9 mg,0.54 mmol)加入干燥洁净的100 mL高压反应釜中,抽真空用N2置换数次。取胡薄荷烯酮(811.0 mg,5.4 mmol)溶于20.0 mL无水异丙醇,并将其小心转移至反应釜中,用H2置换5次后升压至5.0 MPa于50 ℃下反应24 h。减压旋干溶剂,经硅胶柱层析( V(乙酸乙酯)∶ V(石油醚)=1∶30)提纯得浅黄色液体616.0 mg,产率75%。经手性GC分析对映体过量 ee值为92%。[ α
1.2.3 左旋胡薄荷醇(Ⅴ)的合成 参考文献[21],取右旋胡薄荷酮(1.5 g,10.0 mmol)溶于甲醇和水( V(甲醇)∶ V(水)=5∶1)的混合溶剂中,冰浴条件下搅拌。将NaBH4(416.0 mg,11.0 mmol)溶于30.0 mL乙醇,逐滴加入到右旋胡薄荷酮的混合溶液中,滴完后升至室温反应2 h。向混合物加入适量饱和食盐水,以石油醚萃取5次,合并有机相用无水硫酸钠干燥,过滤除去溶剂,经正己烷低温重结晶提纯得粉末状固体1.40 g。产率90%,经手性GC分析非对映体过量 de值为92%。[ α
1.2.4 左旋薄荷醇(Ⅵ)的合成 参考文献[18],将左旋胡薄荷醇(1.4 g,9.1 mmol)和Ru(OAc)2[( S)-DM-BINAP](87.0 mg,0.09 mmol)的甲醇溶液置于高压反应釜中,用N2置换数次后用H2置换5次,升压至2.0 MPa于室温反应4 h。过滤除去催化剂,用无水乙醇洗涤。真空除去溶剂,残余物用MeCN重结晶提纯得针状固体1.25 g。产率88%,经手性GC分析非对映体过量 de值为93%。[ α
胡薄荷烯酮的不对称氢化反应是左旋薄荷醇合成路线中关键步骤。本文从铜催化剂及其用量、手性配体的选择、反应溶剂和时间等因素来探讨该反应的产率及对映选择性。
首先,本文采用几种常见的铜催化剂分别和等当量的手性膦配体( R)-DTBM-SEGPHOS组成的催化体系,以 i-PrOH为溶剂,在NaO t-Bu碱性介质中尝试反应。实验结果如表1所示。
| 表1 铜催化剂及其用量对胡薄荷烯酮不对称氢化反应的影响 Table 1 Scope of copper catalyst and its loading for asymmetric hydrogenation of piperitenone |
由表1可知,以文献[18]报道的铜配合物[Cu(NO3)(PPh3)]作为催化剂,胡薄荷烯酮的不对称氢化反应取得了较高的产率及对映选择性。而二价铜盐Cu(NO3)2、Cu(OAc)2催化效果较差,最终得到了大量的过度还原产物。但是,价廉易得的CuCl却表现出良好的催化活性,其催化效果与[Cu(NO3)(PPh3)]相当。推测可能的原因是:与N
当增加催化剂用量时并未取得预期的催化效果,而减小催化剂用量时反应产率明显降低。因此,选择摩尔分数1%的CuCl作为催化剂时既取得了较好的催化效果,同时合成成本大幅度降低。
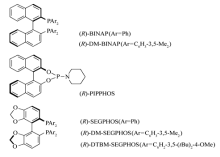
以CuCl为催化剂,讨论了几种手性配体(结构式见图1)对胡薄荷烯酮不对称氢化反应的影响。实验结果如表2所示。
| 表2 手性配体对胡薄荷烯酮不对称氢化反应的影响 Table 2 Scope of chiral ligand for asymmetric hydrogenation of piperitenone |
由表2可知,BINAP系列手性配体虽得到了中等的对映选择性,但反应产率过低。SEGPHOS类配体催化效果相对较好,其中( R)-DTBM-SEGPHOS取得了最高的产率和对映选择性,而配体( R)-PIPPHOS对于该反应基本无催化活性。
如图1所示,BINAP、SEGPHOS均是具有C2对称轴的手性双膦配体。与BINAP相比,SEGPHOS系列配体手性骨架平面形成的二面角较小。同时,随着SEGPHOS系列配体二芳基膦结构单元上取代基数目的增多及复杂化,由于位阻关系,中心金属与其更易形成有效的手性环境[18]。因此,( R)-DTBM-SEGPHOS取得了最优的催化效果。手性单膦配体( R)-PIPPHOS在制成催化剂后,构型易变,因而反应产率和对映选择性较低。
本文进一步探究了反应时间和溶剂对胡薄荷烯酮不对称氢化反应的影响。实验结果如表3所示。
| 表3 反应时间和溶剂对胡薄荷烯酮不对称氢化反应的影响 Table 3 Scope of time and solvent for asymmetric hydrogenation of piperitenone |
由表3可知,当延长反应时间至24 h时,反应产率可达到75%。当再将反应时间延长至36、48 h反应产率未见明显增加。实验结果表明,质子性溶剂异丙醇、甲醇、乙醇、叔丁醇等对氢化反应有利,其中异丙醇是最优的反应溶剂;而甲苯、THF等非质子性溶剂反应效果相对较差,仅取得了中等的产率和对映选择性。
以4-羟基-2-丁酮和异丙叉丙酮为合成原料,通过羟醛缩合、不对称氢化、还原羰基、钌催化氢化等4步反应制得左旋薄荷醇。在关键第2步骤胡薄荷烯酮的不对称氢化反应中,以价廉易得的CuCl作为催化剂,配体( R)-DTBM-SEGPHOS为手性助剂, i-PrOH为溶剂,NaO t-Bu碱性介质中升温至50 ℃反应24 h取得了最优的实验结果。产率为75%,对映体过量 ee值达到92%。四步合成左旋薄荷醇总产率为33%,目标产物非对映体过量 de值达到93%。本文合成方法原料来源方便,催化剂价格低廉,合成总产率较高,具有一定的潜在工业应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|