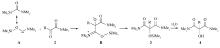
N, N-二甲氨酰基三甲基硅烷与一系列 α-羰基酰胺在无水无氧、105 ℃的条件下反应, 较高产率地合成了 α -羟基 -α-氨甲酰基酰胺类化合物或 α-三甲基硅氧基- α-氨甲酰基酰胺衍生物。 其结构用元素分析、1H NMR、13C NMR和IR等技术手段进行了表征。 通过研究反应机理和影响反应的因素发现, 在 α-羰基上连的烃基的空间位阻是该加成反应的重要影响因素, 而电子效应则影响反应的速率。 提出了可能的反应机理。
α-Hydroxy- α-carbamoylamides are important synthetic intermediates and also serve as valuable agents in medicinal chemistry. Herein, a novel method for synthesis of α-hydroxy- α-carbamoylamides was developed and the reaction mechanism involving two intermediates was proposed. Good yields of α-hydroxy- α-carbamoylamides or α-trimethylsiloxy- α-carbamoylamides are obtained by the addition of N, N-dimethylcarbamoyl(trimethyl)silane to a series of α-ketoamides under anhydrous condition at 105 ℃. Their structures were characterized by elemental analysis,1H NMR,13C NMR and IR spectra. The steric hindrance is found to be an important factor in the addition reaction and the electronic effect can influence the rate of the reaction.
氨甲酰基硅烷作为一种氨酰化试剂被广泛地进行了研究。 它能与亚胺盐和亚胺反应合成 α-氨基酰胺[1,2,3,4], 与酰卤反应合成 α-羰基酰胺[5], 还可与卤代芳烃、卤代烯烃、卤苄进行碳碳间的交叉偶联反应合成酰胺[6,7,8,9]。 氨甲酰基硅烷与羰基反应合成 α-羟基酰胺的研究较少[10], 如果用其与 α-羰基酰胺反应合成 α -羟基 -α -氨甲酰基酰胺将无疑是一个具有重要意义的研究课题。 α -羟基酰胺和 α -羟基 -α -氨甲酰基酰胺应用广泛, 不仅在有机合成中是重要的合成中间体, 而且在药物化学中是具有较强生物活性的试剂[11,12,13]。 其现代合成方法之一是用氨酰基锂在醛或酮的羰基碳上通过亲核加成反应引入氨酰基的方法直接合成[14,15]。 此方法有其明显的缺陷, 即试剂难保证稳定性, 反应产生自缩合, 以及试剂的强碱性[16]。 另一合成方法是通过异腈的三或四组份偶联反应来实现[17,18], 这种方法必须在强酸或Lewis酸存在下才能完成[19,20], 并且产物有毒性异腈的残留, 适用范围受到限制。 因此利用氨甲酰基硅烷来合成 α -羟基酰胺和 α -羟基 -α -氨甲酰基酰胺的方法在有机合成上具有十分重要的价值。 文献[10]报道, N-甲基 -N-甲氧甲基氨酰基三甲基硅烷与醛发生反应可生成 α-三甲基硅氧基酰胺, 我们研究发现它难与酮发生反应, 与α -羰基酰胺不反应。 然而, 在研究 N, N-二甲氨酰基三甲基硅烷与酰氯的反应中, 在一些例子中观察到 α -三甲基硅氧基 -α-氨甲酰基酰胺的生成[5], 于是开展了 N, N-二甲氨酰基三甲基硅烷与 α-羰基酰胺的反应研究, 结果反应能顺利地发生, 成功地合成了一系列 α -羟基 -α-氨甲酰基酰胺衍生物(见Scheme 1)。
Bruker AV600型核磁共振波谱仪(瑞士布鲁克公司), TMS为内标; IMPACT-410型傅里叶红外光谱仪(美国尼高力公司), KBr压片; EA-1108型四元素分析仪(意大利卡劳尔巴公司); WP-2型熔点测定仪(北京第三光学仪器厂), 温度未经校正。
所有试剂为分析纯试剂, 液体试剂需重蒸后使用。 α-羰基酰胺和氨甲酰基硅烷参照文献[5, 21]报道方法制备; 三甲基氯硅烷、二异丙胺、正丁基锂、 N, N-二甲基甲酰胺等试剂均为分析纯; 甲苯需加钠后加热回流, 直到二苯甲酮变蓝即可使用。 反应过程由TLC硅胶预制板跟踪检查。
在一只带有聚四氟乙烯真空塞的Schlenk管中, 加入微型搅拌子, 减压下用火焰烧烤后, 反复充Ar气, 在Ar气保护下, 向其加入51.2 mg(0.36 mmol) α-羰基酰胺2a和1 mL无水甲苯, 在0 ℃ 冷却20 min后, 搅拌下加入62.3 mg(0.43 mmol) N, N-二甲氨酰基三甲基硅烷1, 再加入1 mL无水甲苯, 然后室温搅拌30 min, 加热到105 ℃恒温反应, TLC跟踪反应, 76 h后完成反应, 减压浓缩, 硅胶柱色谱分离( V(丙酮): V(石油醚)=1: 3洗脱), 得59.2 mg淡黄色固体4a, 产率76%; mp 82~84 ℃。1H NMR(600 MHz, CDCl3), δ:5.02(s, 1H, OH), 3.03(s, 6H, 2NCH3), 2.97(s, 6H, 2NCH3), 1.99(t, J=8.4 Hz, 2H, CH2), 1.25(m, J=8.4 Hz, J=7.2 Hz, 2H, CH2), 0.94(t, J=7.2 Hz, 3H, CCH3);13C NMR(151 MHz, CDCl3), δ: 170.9, 77.6, 38.4, 37.4, 37.1, 16.2, 14.3; IR(KBr), σ/cm-1:3480, 1720, 850; 元素分析C10H20N2O3实测值(理论值)/%:C 55.69(55.53), H 9.48(9.32), N 12.73(12.95)。
按同样操作分别合成化合物4b4f、3g3i、4j和4k。
N, N, N', N'-四甲基- α -异丙基 -α-羟基丙二酰胺(4b):产率69.1%; mp 66~68 ℃。1H NMR(600 MHz, CDCl3), δ:4.99(s, 1H, OH), 3.01(s, 12H, 4NCH3), 2.69(m, J=6.6 Hz, 1H, CH), 0.89(d, J=6.6 Hz, 6H, 2CCH3);13C NMR(151 MHz, CDCl3), δ:170.5, 80.9, 37.8, 37.4, 32.2, 17.2; IR(KBr), σ/cm-1:3503, 1665, 1438, 1370, 1134; 元素分析C10H20N2O3实测值(理论值)/%:C 55.43(55.53), H 9.23(9.32), N 12.88(12.95)。
N, N, N', N'-四甲基 -α -环己基 -α-羟基丙二酰胺(4d):产率80.1%; mp 100~101 ℃。1H NMR(600 MHz, CDCl3), δ:5.03(s, 1H, OH), 3.02(s, 12H, 4NCH3), 2.36(m, 1H, CH), 1.76(m, 2H, CH2), 1.64~1.13(m, 8H, 4CH2);13C NMR(151 MHz, CDCl3), δ:170.4, 81.1, 42.3, 37.8, 37.4, 27.1, 26.6, 26.4; IR(KBr), σ/cm-1:3490, 1701, 1361, 861 cm-1; 元素分析C13H24N2O3实测值(理论值)/%:C 60.91, H 9.44, N 10.93; found C 60.75, H 9.16, N 10.78。
N, N, N', N'-四甲基 -α -苯基 -α-羟基丙二酰胺(4e):产率86%; mp 100~102 ℃。1H NMR(600 MHz, CDCl3), δ:7.40~7.31(m, 5H, C6H5), 6.60(s, 1H, OH), 3.08(s, 6H, 2NCH3), 2.84(s, 6H, 2NCH3);13C NMR(151 MHz, CDCl3), δ:170.5, 139.5, 128.6, 128.3, 127.3, 82.0, 38.9, 37.7; IR(KBr), σ/cm-1:3475, 1658, 1470, 685; 元素分析C13H18N2O3实测值(理论值)/%:C 62.63(62.38), H 7.21(7.25), N 11.42(11.20)。
N, N, N', N'-四甲基 -α -邻氯苯基 -α-羟基丙二酰胺(4f):产率80.9%; mp 133~134 ℃。1H NMR(600 MHz, CDCl3), δ:7.45~7.27(m, 4H, C6H4), 6.43(s, 1H, OH), 3.08(s, 6H, 2NCH3), 2.87(s, 6H, 2NCH3);13C NMR(151 MHz, CDCl3), δ:170.1, 136.5, 134.1, 132.0, 129.9, 129.5, 126.9, 82.3, 39.0, 37.8; IR(KBr), σ/cm-1:3469, 1615, 1400, 1125, 806; 元素分析C13H17N2O3Cl实测值(理论值)/%:C 54.63(54.84), H 5.99(6.02), N 9.63(9.84)。
N, N, N', N'-四甲基 -α -对硝基苯基 -α-三甲基硅氧基丙二酰胺(3g):产率85%; mp 139~140 ℃。1H NMR(600 MHz, CDCl3), δ:8.23~7.57(q, 4H, C6H4), 3.06(s, 6H, 2NCH3), 2.98(s, 6H, 2NCH3), 0.05(s, 9H, Me3Si);13C NMR(151 MHz, CDCl3), δ:169.1, 147.5, 146.6, 129.6, 122.7, 85.3, 37.9, 37.4, 2.0; IR(KBr), σ/cm-1:1630, 1503, 1150, 623; 元素分析C16H25N3O5Si实测值(理论值)/%:C 52.33(52.30), H 6.82(6.86), N 11.29(11.43)。
N, N, N', N'-四甲基 -α -间甲氧基苯基 -α-三甲基硅氧基丙二酰胺(3h):产率95%; mp 135~136 ℃。1H NMR(600 MHz, CDCl3), δ:7.27~6.87(m, 4H, C6H4), 3.82(s, 3H, OCH3), 3.05(s, 6H, 2NCH3), 2.94(s, 6H, 2NCH3), 0.05(s, 9H, Me3Si);13C NMR(151 MHz, CDCl3), δ:170.4, 159.8, 141.0, 129.4, 119.6, 113.7, 113.1, 81.8, 55.3, 39.0, 37.7, 1.95; IR(KBr), σ/cm-1:1620, 1350, 1120, 550; 元素分析C17H28N2O4Si实测值(理论值)/%:C 57.72(57.92), H 8.15(8.01), N 7.98(7.95)。
N, N, N', N'-四甲基 -α -对甲苯基 -α-三甲基硅氧基丙二酰胺(3i):产率85.6%; mp 130~131 ℃。1H NMR(600 MHz, CDCl3), δ:7.21~7.15(q, 4H, C6H4), 3.05(s, 6H, 2NCH3), 2.93(s, 6H, 2NCH3), 2.37(s, 3H, CH3), 0.01(s, 9H, Me3Si);13C NMR(151 MHz, CDCl3), δ:170.7, 138.2, 136.5, 129.2, 127.1, 81.8, 39.0, 37.6, 21.2, 2.0; IR(KBr), σ/cm-1:1605, 1408, 1132, 785 cm-1; 元素分析C17H28N2O3Si实测值(理论值)/%:C 60.65(60.68), H 8.45(8.39), N 8.10(8.32)。
N, N, N', N'-四甲基 -α -苯乙烯基 -α-羟基丙二酰胺(4j):产率70.4%; mp 128~129 ℃。1H NMR(600 MHz, CDCl3), δ:7.57~7.32(m, 5H, C6H5), 6.96(d, 1H, 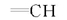
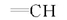
N, N, N', N'-四甲基 -α -(2 -呋喃基) -α-羟基丙二酰胺(4k):产率80%; mp 107~108 ℃。1H NMR(600 MHz, CDCl3), δ:7.42(d, 1H, Furyl-5-H), 6.47(m, 1H, Furyl-4-H), 6.40(d, 1H, Furyl-3-H), 6.11(br s, 1H, OH), 3.06(s, 6H, 2NCH3), 2.93(s, 6H, 2NCH3);13C NMR(151 MHz, CDCl3), δ:168.5, 151.8, 142.5, 110.8, 109.3, 77.3, 37.8, 37.6; IR(KBr), σ/cm-1:3486, 1685, 1413, 758; 元素分析C11H16N2O4实测值(理论值)/%:C 54.76(54.99), H 6.98(6.71), N 11.40(11.66)。
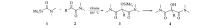
氨甲酰基硅烷1具有较弱的亲核性, 可进攻 α-羰基酰胺2中正电性较强的 α-羰基碳原子, 在碳氧双键上发生亲核加成反应, 把氨酰基直接引入到分子中生成 α -羟基 -α-氨甲酰基酰胺。 反应中通过改变 α-羰基酰胺2的结构, 考察了不同的空间位阻和不同的电子效应对反应的影响, 发现空间位阻是影响反应的主要因素。首先用含脂肪烃基的 α-羰基酰胺(表1, entries 1~4)进行反应, 发现随着脂肪烃基的位阻增加, 反应完成的时间增加, 反应的产率降低, 连有正丙基的2a需76 h完成反应, 产率76%, 而连有异丙基的2b需6 d才能完成反应, 产率69.1%, 连有叔丁基的 α-羰基酰胺2c由于位阻太大不与氨甲酰基硅烷1反应。 其次采用含有芳基的 α-羰基酰胺(表1, entries 5~9)进行反应, 并在芳基上变换给出不同电子效应的取代基考察对反应的影响, 发现苯环上连有不同的取代基对反应产率的影响不大, 而对反应速率有所影响。 连有吸电子基取代基时, 由于增加了羰基碳的正电性, 使得反应速率加快(化合物2f、2g、2h), 连有推电子基取代基时(化合物2i)则正好相反, 而这一作用主要与取代基的诱导效应有关。 化合物2f和2g连有氯和硝基, 具有较强的吸电子诱导效应, 反应时间均比化合物2e短, 化合物2f的氯处于邻位, 化合物2g的硝基处于对位, 诱导效应化合物2f大于2g, 反应时间化合物2f比2g短; 化合物2h虽然连有具较强给电子作用的甲氧基, 但其诱导效应仍是吸电子作用, 并位于间位, 反应时间反而较短(与化合物2e比), 接近化合物2f; 化合物2i的对位甲基有推电子作用, 使反应时间增加。 化合物2j是具有不饱和羰基结构的 α-羰基酰胺, 与氨甲酰基硅烷1发生反应后发现, 只进行1, 2加成反应, 没有出现1, 4加成产物, 反应时间比苯环直接连在羰基上的化合物2e要短, 也证明空间位阻减小反应速率加快。 化合物2k是含有富电子呋喃环的结构, 它也能与氨甲酰基硅烷1发生反应, 得到较高产率的产物, 但反应时间比含苯环的各反应物都长, 其电子效应对反应速率的影响与上述是一致的。 在反应产物中只有化合物3g、3h、3i是含有三甲基硅氧基的酰胺衍生物, 而其余的都是含羟基的酰胺衍生物, 这是由于这几个化合物较稳定, 在分离过程中没有被水解, 而其它化合物在分离过程中, 受溶剂中微量水的作用发生水解生成了羟基。
| 表1 α -羰基酰胺2与氨甲酰基硅烷1反应合成 α -羟基 -α-氨甲酰基酰胺4(或3) Table 1 α-Hydroxy-α -carbamoylamides 4(or 3) from α-Ketoamides 2 and carbamoylsilane 1 |
研究发现了 N, N-二甲基氨甲酰基三甲基硅烷1与 α-羰基酰胺发生亲核加成反应, 直接制备 α -羟基 -α-氨甲酰基酰胺衍生物的合成新方法。 反应在中性条件下一步完成, 反应温和, 操作简单, 原料稳定, 不使用催化剂, 并具有较高的产率, 可操作性较强, 故该方法具有重要的合成价值。 该方法是合成叔酰胺的方法, 还可扩展到合成仲酰胺和伯酰胺, 并且可尝试不对称合成方法, 反应所需的氨甲酰基硅烷可以较高产率地合成[21], 后续的研究工作正在进行中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|