在pH值3.4~3.9的Britton-Robinson(BR)缓冲介质中,甲苯咪唑(MBZ)与曙红Y(EY)反应形成1∶1的离子缔合物,体系反应不仅导致荧光光谱的猝灭,还使共振瑞利散射(RRS)和倍频散射(FDS)显著增强,最大的RRS峰位于326 nm处。 荧光猝灭法、RRS法、FDS法的检出限分别为32.31、7.24和11.65 μg/L,其中RRS法的灵敏度最高。 实验讨论了反应的最佳条件以及共存物质的影响。 该方法用于甲苯咪唑片剂以及尿样中MBZ的测定,结果令人满意。
In pH 3.4~3.9 Britton-Robinson(BR) buffer solution, mebendazole(MBZ) reacts with eosin Y(EY) to form a 1∶1 ion-association complex, which not only results in the quenching of fluorescence, but also results in the great enhancement of resonance Rayleigh scattering(RRS) and frequency doubling scattering(FDS). Furthermore, a new RRS spectrum appears, and the maximum RRS wavelength is located at 326 nm. The detection limit for MBZ is 32.31 μg/L using the fluorophotometry, 7.24 μg/L by the RRS method and 11.65 μg/L by the FDS method. Among them, the RRS method has the highest sensitivity. The experimental conditions were optimized and effects of coexisting substances were evaluated. These methods have been applied to the determination of MBZ in tablets and human urine samples. The composition and structure of the ion-association complex and the reaction mechanism are discussed.
甲苯咪唑(mebendazole,简称MBZ),化学名为5-苯甲酰基-1 H-苯并咪唑-2-基氨基甲酸甲酯(Scheme 1)。 MBZ是人工合成的广谱驱虫药[1],对在人和动物体内常见的线虫类寄生虫包括蛔虫、蛲虫、钩虫和鞭虫有很好的疗效[2,3] 。 甲苯咪唑在动物体内的代谢产物主要是氨基甲苯咪唑(MBZ-NH2)和羟基甲苯咪唑(MBZ-OH),报道称MBZ-OH及MBZ有胚胎毒性,为此欧盟定制了最高残留限量(MRL)为60 μg/kg[4]。 我国也规定了最高残留限量为60 μg/kg。 因此,进一步研究和发展测定MBZ的新方法具有重要的意义。
 | Scheme 1 Structure of mebendazole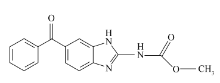 目前,测定MBZ的方法主要有滴定法、紫外分光光度法(SP)、红外光谱法、荧光光度法(F)、高效液相色谱法(HPLC)和磷光法[5,6,7,8,9,10,11,12]等。 其中,分光光度法操作简便,但灵敏度不高不能对MBZ进行痕量分析,高效液相色谱法对于测定一些复杂样品中痕量的MBZ非常有用,但是需要经过繁琐的预处理。 其它一些报告的方法,如荧光法和磷光法在选择性、灵敏度以及简便性方面需要也有一些不足。 因此,发展一种方便,快速和灵敏的方法测定MBZ是必要的。RRS法作为一种新的分析技术因其高灵敏度和易操作使其广泛应用在生物大分子、药物和无机离子的分析[13,14,15,16,17,18]。 本文研究了MBZ与曙红Y相互作用形成离子缔合物,体系反应的荧光光谱、RRS光谱和FDS光谱特征、最佳反应条件及其它影响因素,结果表明药物浓度与光谱强度呈线性相关,据此可建立快速简捷灵敏的痕量MBZ的分析方法。 此外还讨论了离子缔合物形成的机理。 目前,测定MBZ的方法主要有滴定法、紫外分光光度法(SP)、红外光谱法、荧光光度法(F)、高效液相色谱法(HPLC)和磷光法[5,6,7,8,9,10,11,12]等。 其中,分光光度法操作简便,但灵敏度不高不能对MBZ进行痕量分析,高效液相色谱法对于测定一些复杂样品中痕量的MBZ非常有用,但是需要经过繁琐的预处理。 其它一些报告的方法,如荧光法和磷光法在选择性、灵敏度以及简便性方面需要也有一些不足。 因此,发展一种方便,快速和灵敏的方法测定MBZ是必要的。RRS法作为一种新的分析技术因其高灵敏度和易操作使其广泛应用在生物大分子、药物和无机离子的分析[13,14,15,16,17,18]。 本文研究了MBZ与曙红Y相互作用形成离子缔合物,体系反应的荧光光谱、RRS光谱和FDS光谱特征、最佳反应条件及其它影响因素,结果表明药物浓度与光谱强度呈线性相关,据此可建立快速简捷灵敏的痕量MBZ的分析方法。 此外还讨论了离子缔合物形成的机理。1 实验部分 1.1 仪器和试剂F-2500型荧光分光光度计(日本日立公司),参数:RRS法狭缝宽度5.0 nm,FDS法和荧光法狭缝宽度10.0 nm,PMT电压400 V;U-4100型紫外/可见/近红外分光光度计(日本日立公司);pH-S20K型精密pH计(上海梅特勒-托利多仪器有限公司)。甲苯咪唑(MBZ,阿拉丁化学试剂):精确称取0.0250 g MBZ溶解后移入250 mL的容量瓶中作为储备溶液(1.0 g/L),用时稀释成20 mg/L作为工作溶液;曙红Y(简写EY,分析纯试剂,成都科龙化工试剂):配制成浓度为2.0×10-3 mol/L的储备液,用时稀释至2.0×10-4 mol/L作为工作溶液;BR缓冲溶液:用0.2 mol/L的NaOH与0.04 mol/L的H3PO4、H3BO3和CH3COOH按照一定比例混合,配成不同 pH值的缓冲溶液,然后用酸度计校正pH值。所用试剂均为分析纯,实验用水均为超纯水。 1.2 实验方法室温下,于10 mL比色管中,依次加入1.0 mL pH值为3.7的BR缓冲溶液,0.8 mL EY以及适量的MBZ溶液,加蒸馏水稀释至刻度,摇匀,放置10 min。 在荧光分光光度计上以 λex= λem进行同步扫描,同时记录RRS光谱,然后以2 λem= λex进行扫描记录下FDS光谱。 再分别于各自最大的散射波长处测定样品的强度 IRRS和 IFDS以及试剂空白的强度 |
当EY与MBZ反应形成离子缔合物后,体系的荧光显著猝灭,荧光猝灭程度在一定范围内与MBZ的浓度呈线性关系,故此法可定量测定MBZ。
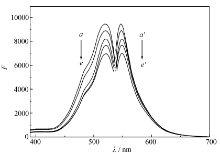
图2 A为EY-MBZ体系的RRS光谱图。 由图2 A可以看出,EY和MBZ本身的RRS均很微弱,当EY与MBZ混合形成离子缔合后,RRS显著增强,且最大散射波长位于326 nm处附近。图2 B为不同浓度的MBZ的RRS光谱。 从图2 B可以看出,326 nm处的Δ I值随浓度的增大而成线性增强,可用于药物的定量测定。
在荧光分光光度计上,以较长波长入射光透过溶液时,可以看到在入射光波长的1/2处( λem=1/2 λex)出现FDS光谱。 在入射波长440~800 nm范围以内,以10 nm的间隔进行扫描,得到FDS图(如图3 A)。 从图3 A可知,不同的入射光产生的FDS强度不同;EY和MBZ本身的FDS均很弱,当二者结合后FDS显著增强。 最大的FDS峰 λem/ λex位于396/792 nm处。 从图3 B可知,在最大的FDS波长处,FDS强度在一定范围内与MBZ的浓度成正比,故此法可用于MBZ的定量测定。
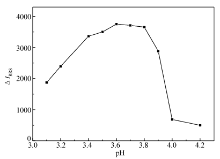
2.4.1 溶液酸度的影响 实验考察了HAc-NaAc、Na2HPO4-KH2PO4、BR和C6H5O7Na3-HCl缓冲溶液作为反应介质对EY-MBZ体系的RRS影响。 实验结果表明,用BR缓冲溶液作为反应介质,效果最好。 因此,选用了BR缓冲溶液作为本实验的反应介质。 实验了pH值不同的BR缓冲溶液对反应体系散射增强(Δ I)的影响如图4所示。 当pH值在3.4~3.9之间时,体系的Δ I达到最大。 但溶液pH值大于3.9和小于3.4时Δ I减小,不利于药物的测定。 本实验选用pH=3.7的BR缓冲溶液作为反应介质,缓冲溶液的最佳用量1.0 mL。
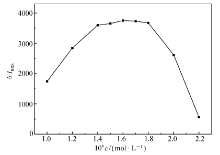
2.4.2 EY浓度的影响 实验结果表明,反应体系EY的浓度在1.4×10-5~1.8×10-5 mol/L时体系的Δ I值达到最大(图5)。 当浓度小于1.4×10-5 mol/L时反应不完全,大于1.8×10-5 mol/L时空白将增大,不利于药物的测定。 故本实验针对反应体系选用EY的浓度为1.6×10-5 mol/L。
2.4.3 温度的影响及共振瑞利散射强度( IRRS)的稳定性 实验了温度对体系RRS强度的影响。 结果表明,在室温(10~30 ℃)条件下,RRS强度无明显变化,EY与MBZ的结合反应在10 min内即可完成,此后体系的RRS强度至少可以稳定20 h,因此散射信号有良好的稳定性。
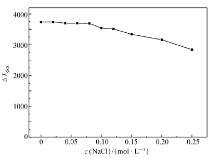
2.4.4 离子强度的影响 用不同浓度的NaCl溶液研究了离子强度对反应体系RRS强度的影响(图6)。 结果表明,当NaCl浓度低于0.08 mol/L时,Δ IRRS基本无影响,随着NaCl浓度的增加,Δ IRRS逐渐降低。 因此,反应体系应避免引入盐类。
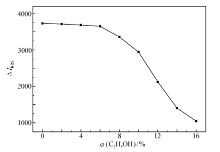
2.4.5 乙醇的影响 考察了乙醇对反应体系RRS强度的影响(图7)。 从图7可以看出,当乙醇的体积浓度低于6%时,Δ IRRS基本保持不变,随着乙醇体积浓度的继续增加,Δ IRRS显著降低。 因此,实验中应尽量减少醇类有机溶剂的加入。
在最佳实验条件下,测量了不同浓度的MBZ与EY形成离子缔合物的Δ IRRS,Δ IFDS及Δ F。 以Δ IRRS、Δ IFDS以及Δ F对MBZ浓度绘制标准曲线。 标准曲线的线性范围、线性回归方程、相关系数 r以及方法的检出限列于表1。 从表1可以看出,RRS法的灵敏度最高,RRS法的检出限(3 σ)为7.42 μg/L,其灵敏度远远高于一般的荧光分光光度法和高效液相色谱法,更利于痕量MBZ的定量测定。
| 表1 标准曲线的某些参数及检出限 Table 1 Parameters for the calibration curves and the detection limits for MBZ |
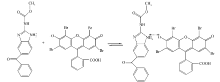
用摩尔比法和等摩尔连续变化法测定了EY与MBZ的组成比,结果表明。EY与MBZ形成为1∶1离子缔合物。
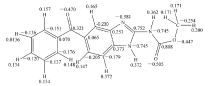
本实验采用量子化学AM1法对MBZ基态电荷的分布作了近似计算如图8所示。 从图8可以看出,3个带本实验采用了量子化学AM1法负电荷的氮原子的电荷密度是不均匀的,分别为-0.742、-0.581和-0.745。 电荷密度最高的N原子在酸性介质中最容易和溶液中的H+结合从而质子化带一个单位的正电荷。
在pH值为3.7左右的弱酸性介质中,EY的一个羟基发生解离,因为羟基附近有强吸电子基,使羟基氧上的电子云密度大大降低,因此它比苯基上—COOH更容易解离。 当MBZ与EY混合后,可以通过静电引力的作用从而形成1∶1的离子缔合物。 实验结果表明,EY-MBZ体系的离子缔合物结构如图9所示的单边结构。
研究了共存物质对MBZ测定的影响,当相对误差≤±5%时,共存物质允许的倍数列于表2。 由表2可知,常见的一些酸根离子、金属离子、糖类等允许量较大,也允许大量的氨基酸存在,因此方法有良好选择性,可用于药物的分析。 但加入少量的Co2+和Fe2+的干扰比较严重,若样品中存在此类金属离子,应加入1.0 mL 0.1 mol/L EDTA溶液掩蔽。
| 表2 共存物质的影响( ρ(MBZ)=1.0 mg/L) Table 2 Effects of coexistent substances( ρ(MBZ)=1.0 mg/L) |
取甲苯咪唑片10片(西安杨森制药有限公司,规格:0.100 g/片),研磨,混匀,用少量乙酸溶解后转入1000 mL的容量瓶中,用超纯水定容至刻度,摇匀,静置。用移液管移取10 mL样液并稀释至500 mL混匀。 取1.0 mL按照上述的实验方法进行测定,并且与分光光度法进行对照,结果基本上是一致的(见表3)。
| 表3 片剂中MBZ的测定结果 Table 3 Results for the determination of MBZ in tablets |
取正常人新鲜尿样离心,取上层清液用于1.0 mL,按照实验方法测定MBZ结果列于表4。 标准加入法可以看出,方法有较好的准确度和精密度。
| 表4 尿样中MBZ的测定结果 Table 4 Results for the determination of MBZ in urine samples |